Навигация
Mg
МАГНИЙ
План:
1. Характеристика элемента.
2. Получение магния.
3. Свойства магния.
3.1. Физические свойства магния.
3.2. Химические свойства магния.
4. Соединения магния.
4.1. Неорганические соединения
4.2. Магнийорганические соединения
5. Природные соединения магния
6. Определение магния в почвах, в воде
7. Биологическое значение магния
8. Области применения магния
9. Жесткость воды
10. Практическая работа «Определение жесткости воды»
1. Характеристика элемента
Название «магнезия» встречается уже в III веке н.э., хотя не вполне ясно, какое вещество оно обозначает. Долгое время магнезит - карбонат магния - ошибочно отождествляли с известняком - карбонатом кальция. Слово магнезия происходит от названия одного из Греческих городов - Магнесии. До XVIII века соединения магния считали разновидностями кальциевых или натриевых солей. Открытию магния способствовало изучение состава минеральных вод. В 1695 году английский врач Крю сообщил, что им выделена из воды эпсомского минерального источника соль, обладающая лечебными свойствами, и вскоре был доказан её индивидуальный характер. Затем стали известны и другие соединения магния. Карбонат магния получил название "белая магнезия", в отличие от «чёрной магнезии» - оксида марганца. Отсюда и созвучие названий металлов, выделенных впоследствии из этих соединений.
Впервые магний был получен Деви (XIX в.) из окиси магния. Бюсси, Либих, Девильс, Карон и др получали магний действием паров калия или натрия на хлористый магний.
В 1808 г. английский химик Г. Деви электролизом увлажнённой смеси магнезии и оксида ртути получил амальгаму неизвестного металла, которому и дал название "магнезии", сохранившееся до сих пор во многих странах. В России с 1831 года принято название "магний". В 1829 г. Французский химик А. Бюсси получил магний, восстанавливая его расплавленный хлорид калием. Следующий шаг к промышленному получению сделал М. Фарадей. В 1830 г. он впервые получил магний электролизом расплавленного хлористого магния.
Промышленное производство магния электролитическим способом предпринято в Германии в конце XIX в. Перед второй мировой войной началось освоение термических способов получения магния.
В настоящее время наряду с развитием электролитического способа совершенствуются силикотермический и карботермический способы получения магния. На первой стадии развития магниевой промышленности в качестве сырья применяли хлористые соли карналлит, природные рассолы, хлоромагниевые щёлочи калийной промышленности.
Сейчас наряду с хлористыми солями широко используют доломит и магнезит. Большой интерес представляет применение в качестве сырья для производства магния из морской воды. В России электролитический метод получения магния впервые разработал П.П. Федотьев в 1914 г. в Петроградском политехническом институте. В 1931 г. в Ленинграде вступил в строй первый опытный магниевый завод. Промышленное производство магния в СССР начато в 1935 г.
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() +12Mg ))) 1S2 2S2 2P6 3S2 3P0 –электронная формула нормального атома
+12Mg ))) 1S2 2S2 2P6 3S2 3P0 –электронная формула нормального атома
![]()
![]()
![]()
![]() 282
282
При затрате необходимой энергии один из электронов переходит в P-состояние, т.е. оба электрона становятся неспаренными. Поэтому магний проявляет степень окисления +2.
3S2-валентные электроны
1S2 2S2 2P6 3S1 3P1
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() - электронная формула возбуждённого атома
- электронная формула возбуждённого атома
![]() +12Mg +P12,n012
+12Mg +P12,n012
![]() e12
e12
Строение внешней электронной оболочки магния, обладающей структурой 3S2, с двумя слабо связанными электронами объясняет восстановительный характер типичных реакций, в которых магний переходит в двухвалентный катион Mg2+. Благодаря большому химическому сродству к кислороду, магний способен отнимать кислород у многих окислов и хлор у хлоридов. Это свойство в последнее время используется при магниетермическом получении титана, циркония, урана. При комнатной температуре на воздухе компактный магний химически стоек. На его поверхности образуется окисная пленка, предохраняющая от окисления. При нагревании химическая активность магния возрастает. Считается, что верхний температурный предел устойчивости магния в кислороде находится в интервале 350-400 оС. Кипящую воду магний разлагает с выделением водорода.
На магний не оказывает заметного действия дистиллированная вода, фтористоводородная кислота любой концентрации, хромовая кислота, водные растворы фтористых солей и др.
Разрушающее действие оказывает на магний морская и минеральная вода, водные растворы соляной, серной, азотной, фосфорной, кремнефтористоводородной кислот, водные растворы галоидных солей, сернистых соединений, аммиак и его водные растворы, органические кислоты, гликоли и гликолевые смеси, многи альдегиды.
Магний - один из самых распространенных в земной коре элементов, по распространенности занимает шестое место после кислорода, кремния, алюминия, железа и кальция. Содержание магния в литосфере, по А.П. Виноградову, сотавляет 2,10%. В природе магний встречается исключительно в виде соединений и входит в состав многих минералов: карбонатов, силикатов и др. Важнейшими являются следующие из них: магнезит MgCO3, доломит MgCO3*CaCO3, карналлит MgCl2*KCL*6H2O, бруцит Mg(OH)2, кизерит MgSO4, эпсонит MgSO4*7H2O, каинит MgSO4*KCl*3H2O, оливин (Mg,Fe)2 [SiO4], серпентин H4Mg3Si2O9.
Природный или естественный магний представляет собой смесь трех устойчивых изотопов 24Mg -78,6 %, 25Mg -10,1 %, 26Mg -11,3 %.
В реакциях магний практически всегда проявляет степень окисления +2 (валентность II). Для того, чтобы перевести атом магния из состояния 3S2 в реакционноспособное состояние 3S13P1, нужно затратить 259 КДж/моль, а при последовательном отрыве электронов, т.е. ионизации Mg до Mg+ и Mg+2, требуется соответственно 737 КДж/моль и 1450 КДж/моль. Магний кристаллизуется в гексагональную плотноупакованную решетку.
Похожие работы
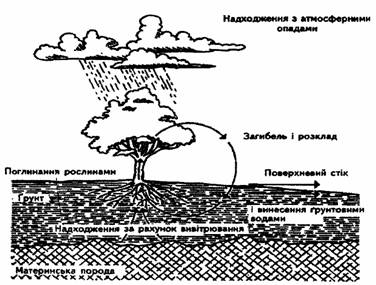
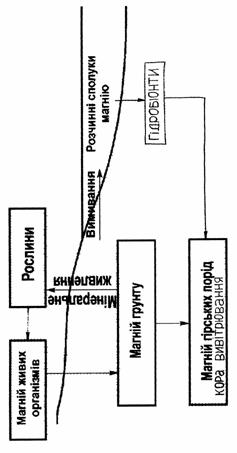
... його, якщо необхідно, і виводять будь-які надлишки, тому і нестача, і надлишок магнію в організмі - явище достатньо рідкісне, але коли таке трапляється, виникають дуже небезпечні захворювання. III. Схема біогеохімічного циклу магнію. Кругообіг макроелементів. Калій, кальцій, натрій і магній не зв'язані з органічними сполуками хімічно, хоча вони містяться у великих кількостях у клітинних і позакл ...
... тного поля в точці на осі колового провідника радіусом R на відстані d від центра колового провідника дорівнює: . Аналогічно обчислюється індукція магнітного поля, створена іншими провідниками з струмом. 2. ЗАКОН ПОВНОГО СТРУМУ ТА ЙОГО ВИКОРИСТАННЯ ДЛЯ РОЗРАХУНКУ МАГНІТНИХ ПОЛІВ. ВИХРОВИЙ ХАРАКТЕР МАГНІТНОГО ПОЛЯ У електростатиці було встановлено, що робота при переміщенні одиничного ...
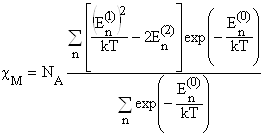
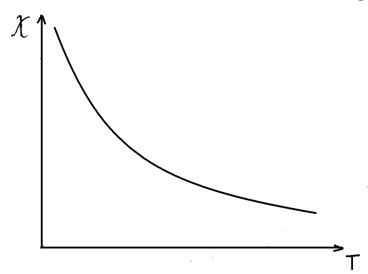
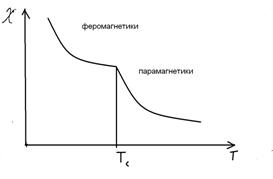
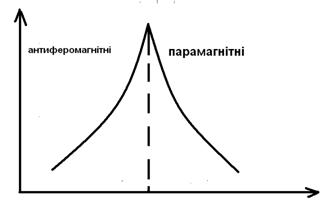
... вираз для макроскопічної магнітної сприйнятливості з урахуванням больцманівського розподілу ансамблю магнітних моментів по енергетичних рівнях приймає вигляд: Це і є рівняння Ван-Флека – основне в магнетохімії, пов’язуюче магнітні властивості з будовою молекул. Тут NA – число Авогадро, k – постійна Больцмана. З деякими крайніми випадками його ми вже зустрічалися вище. Якщо Е(0) = 0, а Е(2) ...
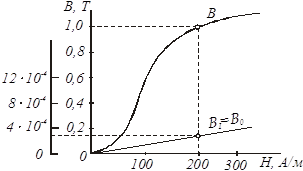
... І = const при вимірюванні. 5.3 Програма роботи 1. Вивчити будову та принципи дії мілівеберметра і мілітесламетра. 2. Вивчити лабораторну установку дослідження характеристик Ш-подібного електромагніта. 3. Експериментальним шляхом зняти вебер-амперну характеристику електромагніта . На підставі експериментальних даних провести необхідні розрахунки і побудувати криву намагнічування B = f(H) і ...
0 комментариев