Навигация
Химические свойства магния
3.2. Химические свойства магния.
Химические свойства магния довольно своеобразны. Он легко отнимает кислород и хлор у большинства элементов, не боится едких щелочей, соды, керосина, бензина и минеральных масел. С холодной водой магний почти не взаимодействует, но при нагревании разлагает ее с выделением водорода. В этом отношении он занимает промежуточное положение между бериллием, который вообще с водой не реагирует и кальцием, легко с ней взаимодействующим. Особенно интенсивно идет реакция с водяным паром, нагретым выше 380 оС:
![]()
![]()
![]()
![]() -2e
-2e
![]() Mg0(тв)+H2+O(газ)
Mg+2O(тв)+H20 (газ).
Mg0(тв)+H2+O(газ)
Mg+2O(тв)+H20 (газ).
Поскольку продуктом этой реакции является водород ясно, что тушение горящего магния водой недопустимо: может произойти образование гремучей смеси водорода с кислородом и взрыв. Нельзя потушить горящий магний и углекислым газом: магний восстанавливает его до свободного углерода -4е
![]()
![]() 2Mg0 + C+4O2
2Mg+2O+C0,
2Mg0 + C+4O2
2Mg+2O+C0,
Прекратить к горящему магнию доступ кислорода можно засыпав его песком, хотя и с оксидом кремния (IV) магний взаимодействует, но со значительно меньшим выделением теплоты:
-4е
![]()
2Mg0 + Si+4O2=2Mg+2O+Si0
этим и определяется возможность использования песка для тушения кремния. Опасность возгорания магния при интенсивном нагреве одна из причин, по которым его использование как технического материала ограничена.
В электрохимическом ряду напряжений магний стоит значительно левее водорода и активно реагирует с разбавленными кислотами с образованием солей. В этих реакциях есть у магния особенности. Он не растворяется во фтороводородной, концентрированной серной и в смеси серной и в смеси азотной кислот, растворяющей другие металлы почти столь же эффективно, как "царская водка" (смесь HCl и HNO3). Устойчивость магния к растворению во фтороводородной кислоте объясняется просто: поверхность магния покрывается нерастворимой во фтороводородной кислоте пленкой фторида магния MgF2. Устойчивость магния к достаточно концентрированной серной кислоте и смеси ее с азотной кислотой объяснить сложнее, хотя и в этом случае причина кроется в пассивации поверхности магния. С растворами щелочей и гидроксида аммония магний практически не взаимодействует. А вот с растворами аммонийных солей реакция хотя и медленно, но происходит:
2NH+4+Mg=Mg2+ + 2NH3 + H2
Удивительного в этой реакции нет. Эта реакция та же по существу, что и реакция вытеснения металлами водорода из кислот. В одном из определений кислотой называют вещество, диссоциирующее с образованием ионов водорода. Именно так может диссоциировать и ион NH4:
![]()
![]() NH4+ NH3+H+
NH4+ NH3+H+
-2e
Mg0 + 2HCl=Mg+2Cl2+H02
![]()
![]() 2H++Mg Mg2+ + H02
2H++Mg Mg2+ + H02
При нагревании магния в атмосфере галогенов происходит воспламенение и образование галоидных солей.
![]() -2e
-2e
![]()
![]()
![]()
![]() Mg + Cl20 Mg+2+Cl2-
Mg + Cl20 Mg+2+Cl2-
Причина воспламенения - очень большое тепловыделение, как и в случае реакции магния с кислородом. Так при образовании 1 моль хлорида магния из магния и хлора выделяется 642 КДж. При нагревании магний соединяется с серой (MgS), и с азотом (Mg3N2). При повышенном давлении и нагревании с водородом магний образует гидрид магния
-2e
![]() Mg0 + H20 Mg+2H2-.
Mg0 + H20 Mg+2H2-.
Большое сродство магния к хлору позволило создать новое металлургическое производство - "магниетермию" - получение металлов в результате реакции
MeCln+0,5nMg=Me+0,5nMgCl2этим методом получают металлы, играющие очень важную роль в современной технике - цирконий, хром, торий, бериллий. Легкий и прочный "металл космической эры" - титан практически весь получают таким способом.
Сущность производства сводится к следующему: при получении металлического магния электролизом расплава хлорида магния в качестве побочного продукта образуется хлор. Этот хлор используют для получения хлорида титана (IV) TiCl4, который магнием восстанавливается до металлического титана
-4e
![]() Ti+4Cl4 + 2Mg0 Ti0+2Mg+2Cl2
Ti+4Cl4 + 2Mg0 Ti0+2Mg+2Cl2
Образовавшийся хлорид магния вновь используется для производства магния и т.д. На основе этих реакций работают титаномагниевые комбинаты. Попутно с титаном и магнием получают при этом и другие продукты, такие, как бертолетову соль KClO3, хлор, бром и изделия - фибролитовые и ксилитовые плиты, о которых будет сказано ниже. В таком комплексном производстве степень использования сырья, рентабельность производства высока, а масса отходов не велика, что особенно важно для охраны окружающей среды от загрязнений.
Похожие работы
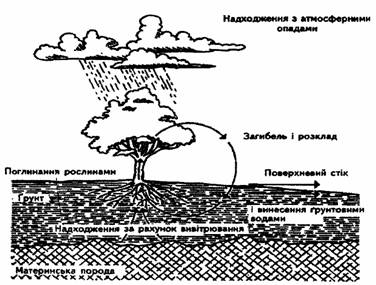
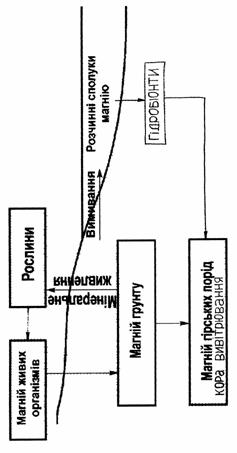
... його, якщо необхідно, і виводять будь-які надлишки, тому і нестача, і надлишок магнію в організмі - явище достатньо рідкісне, але коли таке трапляється, виникають дуже небезпечні захворювання. III. Схема біогеохімічного циклу магнію. Кругообіг макроелементів. Калій, кальцій, натрій і магній не зв'язані з органічними сполуками хімічно, хоча вони містяться у великих кількостях у клітинних і позакл ...
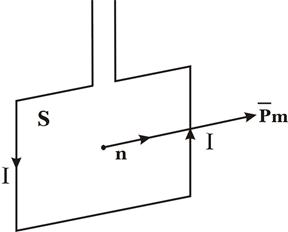
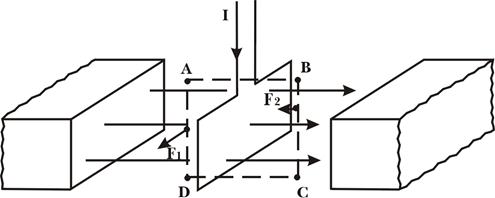
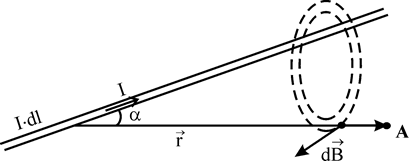
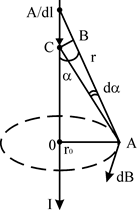
... тного поля в точці на осі колового провідника радіусом R на відстані d від центра колового провідника дорівнює: . Аналогічно обчислюється індукція магнітного поля, створена іншими провідниками з струмом. 2. ЗАКОН ПОВНОГО СТРУМУ ТА ЙОГО ВИКОРИСТАННЯ ДЛЯ РОЗРАХУНКУ МАГНІТНИХ ПОЛІВ. ВИХРОВИЙ ХАРАКТЕР МАГНІТНОГО ПОЛЯ У електростатиці було встановлено, що робота при переміщенні одиничного ...
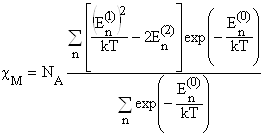
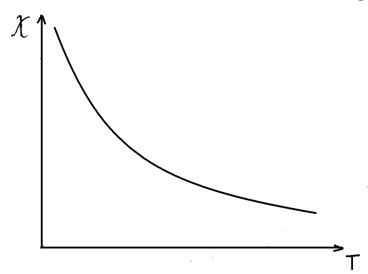
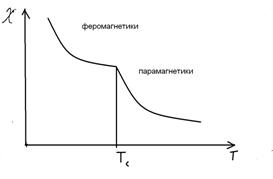
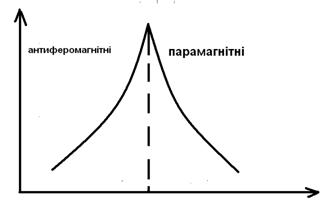
... вираз для макроскопічної магнітної сприйнятливості з урахуванням больцманівського розподілу ансамблю магнітних моментів по енергетичних рівнях приймає вигляд: Це і є рівняння Ван-Флека – основне в магнетохімії, пов’язуюче магнітні властивості з будовою молекул. Тут NA – число Авогадро, k – постійна Больцмана. З деякими крайніми випадками його ми вже зустрічалися вище. Якщо Е(0) = 0, а Е(2) ...
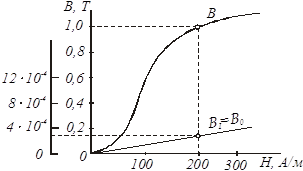
... І = const при вимірюванні. 5.3 Програма роботи 1. Вивчити будову та принципи дії мілівеберметра і мілітесламетра. 2. Вивчити лабораторну установку дослідження характеристик Ш-подібного електромагніта. 3. Експериментальним шляхом зняти вебер-амперну характеристику електромагніта . На підставі експериментальних даних провести необхідні розрахунки і побудувати криву намагнічування B = f(H) і ...
0 комментариев