Навигация
Во многих случаях реакции Гриньяра с карбонильными соединениями протекают с количественным выходом
10. Во многих случаях реакции Гриньяра с карбонильными соединениями протекают с количественным выходом.
RMgHal + CH2=O → RCH2OMgHal
RCH2OMgHal + H2O → RCH2OH + Mg(OH)Hal
Затруднения возникают при синтезе веществ с разветвленными радикалами. Наиболее распространенные побочные реакции – енолизация и восстановление, например:
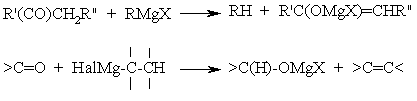
Первая реакция может происходить, если в карбонильном соединении имеется хотя бы один -атом Н, вторая – когда в реактиве Гриньяра имеется атом Н в -положении. Образующийся алкоголят, подобно алкоголятам Аl, может реагировать как восстановитель, например:
RRCH(OMgX) + R'CHO → R2CO + R'CH2OH
Следствием енолизации может быть конденсация, подобно альдольно-кротоновой или Кляйзена.
Реакции с ароматическими кетонами часто сопровождаются образованием пинаконов. В реакциях с -непредельными карбонильными соединениями возможно как 1,2-, так и 1,4-присоединение, а с ароматическими производными – и 1,6-присоединение.
RCH=CH-C(R*)=O + R**MgHal → R(R**)CH-CH=C(R*)OMgHal
R(R**)CH-CH=C(R*)OMgHal + H2O → R(R**)CH-CH2-C(R*)=O
Обычно эта реакция идёт наряду с 1,2-присоединением, дающим третичный спирт:
RCH=CH-C(R*)=O + R**MgHal → RCH=CH-C(R**)(R*)OMgHal
RCH=CH-C(R**)(R*)OMgHal + H2O → RCH=CH-C(R**)(R*)OH
Чем более объёмист R**, тем более он склонен к 1,4-присоединению. Наиболее способен к нормальному 1,2-присоединению CH3MgHal. Объёмистость радикала R действует в обратном направлении. То есть альдегиды (R* = Н) в большей степени, чем кетоны, способны к реакциям 1,2-присоединения.
Гриньяровские реактивы присоединяются к ароматическим кетонам в положения 1,4. В случае настолько пространственно загромождённых ароматических кетонов, что орто-положение бензольного ядра недоступно, радикал реактива Гриньяра вступает в пара-положение, т. е. 1,6-присоединение.
Наиболее вероятный механизм реакции с карбонильными соединениями – гетеролитический. Предполагается, что переходное состояние представляет собой квазишестичленный цикл (1,4-присоединение):
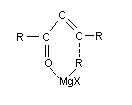
11. Ацетиленилмагнийгалогениды могут быть получены взаимодействием алкилмагнийгалогенидов с производными ацетилена (Ж. И. Иоцич)
R-C≡CH +RMgHal → R-C≡C-MgHal +RH
12. Важны магнийорганические производные пиррола, индола и других пятичленных гетероциклов, имеющие связь N-MgHal.
C4H4NH + RMgHal → C4H4N-MgHal + RH
13. С окисью азота гриньяровы реактивы реагируют по схеме:
RMgHal + 2NO → R-N(NO)OMgHal
R-N(NO)OMgHal + H2O → R-N(NO)OH
После гидролиза образуется алкил- или арилнитрозогидроксиламин.
14. Хлористый нитрозил даёт с реактивом Гриньяра нитрозосоединения:
RMgCl + ClNO → R-NO + MgCl2
15. С хлорамином (Колеман) образуются первичные амины:
RMgCl + ClNH2 → RNH2 + MgCl2
16. Из оснований Шиффа и реактива Гриньяра получают вторичные амины (Буш):
ArN=CHAr* + RMgHal + H2O → ArNH-CH(R) Ar*
17. Алкил- или арилазиды с реактивом Гриньяра образуют триазены (диазоаминосоединения):
R-N=N=N + R*MgHal + H2O → R-N=N-NH- R*
18. Нитрозосоединения превращаются в N-диалкил (диарил-) гидроксиламины:
R-N=O + R*MgHal + H2O → R(R*)N-OH
19. По химическим свойствам R2Mg в целом аналогичны RMgHal, однако часто химические реакции R2Mg протекают с большими скоростями. Таковы, например, реакции с О2, СО2, Н2, реакции с органическими соединениями. Однако наблюдаются и некоторые различия. Например, 1,2-присоединения R2Mg к -ненасыщенным кетонам, тогда как для RMgHal характерно 1,4-присоединение.
Применение
Магнийорганические соединения в основном используют в органическом синтезе и для получения металлоорганических соединений. В промышленности их в смеси с другими металлоорганическими соединениями применяют как катализаторы полимеризации.
Для аналитической химии магния большое значение имеют окрашенные соединения его с органическими реагентами, используемые в качестве комплексонометрических индикаторов, для фотометрического определения и для обнаружения магния. Ион магния не обладает хромофорным действием, поэтому цветные реакции дают только соединения его с окрашенными органическими реагентами. Из них наиболее важны азосоединения, меньшее значение имеют соединения магния с азокрасителями.
При взаимодействии магния с некоторыми азокрасителями образуются интенсивно окрашенные внутрикомплексные соединения. Саввин и Петрова изучили цветные реакции магния с азосоединениями на основе хромотропной кислоты. Некоторые из них с магнием дают интенсивно окрашенные комплексы, пригодные для фотометрического определения магния. Диль и Эллингбоэ изучили образование магнием окрашенных соединений с 26 моноазосоединениями с целью использования их в качестве индикаторов для комплексонометрического определения магния.
Заключение
Как мы видим, магнийорганические соединения – это обширный класс веществ, используемый в основном как реагент для получения разнообразных химических соединений: спиртов, альдегидов, кетонов, эфиров, органических кислот, аминов и др.
К сожалению, создание крупномасштабного производства на основе магнийорганических соединений встречает значительные трудности из-за исключительной пожароопасности эфира. В настоящее время разрабатываются методики применения магнийорганических соединений с использованием не столь горючих растворителей. Вероятно, недалеко то время, когда магнийорганические соединения будут широко применяться в химической технологии при получении соединений других классов.
Список литературы
1. Агрономов А.Е. Избранные главы органической химии. М.: Химия, 1990.
2. Бартон Д., Оллис У.Д. - Общая органическая химия (том 7). Металлоорганические соединения. 1984.
3. А.С.Днепровский, Т.И. Темникова. Теоретические основы органической химии. Химия, 1979.
4. Иоффе Ф.Т., Несмеянов А.Н., Магний, берилий, кальций, стронций, барий, в сборнике: Методы элементоорганической химии, под редакцией А.Н. Несмеянова, К.А. Кочешкова, [ч. 1], М., 1963.
5. Несмеянов А.Н., Несмеянов Н.А. Начала органической химии. Книга 2. Издание второе. М., 1978.
6. Реутов О.А., Белецкая И.П., Соколов В.И. Механизмы реакций металлоорганических соединений. М.: Химия, 1972
7. Робертс Дж., Касерио М. Основы органической химии. Том 1. М.: «Мир», 1978.
8. Д.Ж. Харвуд. Промышленное применение металлоорганических соединений. Химия, 1970.
9. А.Е.Чичибабин. Основные начала органической химии. Том.1 Госхимиздат, 1953.
Похожие работы
... неметаллов алкильные (или арильные) производные элементов III, II и I (для лития) групп превращаются в обратноониевые комплексы: . Природа связи углерод-металл изменяется в металлоорганических соединениях в широких пределах – от ионной до ковалентной. Увеличение электроположительных свойств металла и размеров его ковалентного радиуса усиливает ионный характер связи металл – углерод (например, в ...
... с образованием эфиратов: RMgX • 2(С2Н5,)2О. Эфираты хорошо растворимы, и это дает возможность галогеналкилам проникать к поверхности металла, которая в иных условиях обволакивается металлорганическим соединением. Для приготовления реагентов Гриньяра могут быть также использованны другие донорные растворители, особенно тетрагидрофурап, а также третичные амины. Образованию магнийорганических ...
... соединение металлоорганический Вывод В работе были рассмотрены важнейшие способы получения алкилсиланов: · взаимодействие металлоорганических соединений с алкилхлорсиланами; · взаимодействие гидридов металлов с алкилхлорсиланами; · каталитическое диспропорционирование соединений, содержащих алкилгидридсилановый фрагмент; · гидрирование алкилхлорсиланов и тетраалкилсиланов. У ...
... водорода. Именно так может диссоциировать и ион NH4: NH4+ NH3+H+ Реакция же -2e Mg0 + 2HCl=Mg+2Cl2+H02 2H++Mg Mg2++ H02 При нагревании магния в атмосфере галогенов происходит воспламенение и образование галоидных солей. -2e Mg + Cl20 Mg+2+Cl2- Причина воспламенения - очень большое тепловыделение, как и в ...
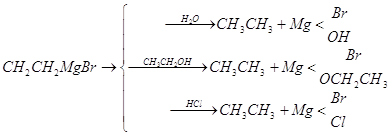
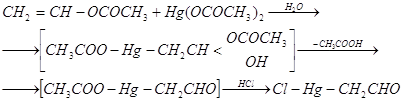
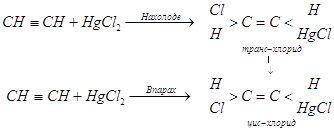
0 комментариев