Навигация
Теоретические основы электрохимической коррозии
ФЕДЕРАЛЬНОЕ АГЕНТСТВО ПО ОБРАЗОВАНИЮ
ГОСУДАРСТВЕННОЕ ОБРАЗОВАТЕЛЬНОЕ УЧРЕЖДЕНИЕ
ВЫСШЕГО ПРОФЕССИОНАЛЬНОГО ОБРАЗОВАНИЯ
Тверской Государственный Технический Университет
(ГОУВПО “ТГТУ”)
Кафедра Биотехнологии и химии
КУРСОВАЯ РАБОТА
на тему:
«Теоретические основы электрохимической коррозии»
Выполнил: студент 3 курса
дневного отделения
факультета АС
группы Химия - 0714
Алексеева В. Н.
Принял: доц., к.х.н.
Громова Н. Ю.
Тверь 2010
Содержание
Введение
1 Общая характеристика процессов коррозии
2 Классификация процессов коррозии
3 Условия возникновения коррозионного процесса
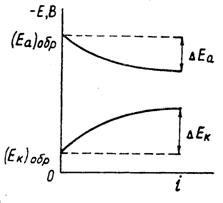
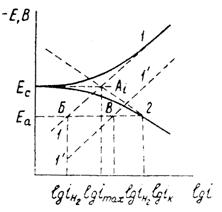
4 Основы кинетической теории коррозии и ее приложение к коррозии идеально чистых металлов
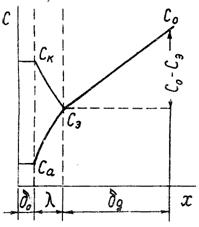
5 Коррозия технических металлов
6 Методы защиты металлов от коррозии
Заключение
Список использованных источников
Введение
Металлы составляют одну из основ цивилизации на планете Земля. Их широкое внедрение в промышленное строительство и транспорт произошло на рубеже XVIII-XIX веков. В это время появился первый чугунный мост, спущено на воду первое судно, корпус которого был изготовлен из стали, созданы первые железные дороги. Начало практического использования человеком железа относят к IX веку до нашей эры. Именно в этот период человечество перешло из бронзового века в век железный.
Термин коррозия происходит от латинского слова «corrodere», что означает «разъедать , разрушать». Коррозия - это самопроизвольный процесс разрушения материалов и изделий из них под химическим воздействием окружающей среды. Коррозия металлов - разрушение металлов вследствие физико-химического воздействия внешней среды, при котором металл переходит в окисленное (ионное) состояние и теряет присущие ему свойства.
Особое место в комплексе мероприятий по обеспечению бесперебойной эксплуатации оборудования отводится надежной защите его от коррозии и применению в связи с этим высококачественных химически стойких материалов.
Целью курсового проекта является изучение теоретических основ электрохимической коррозии. Для ее достижения были поставлены следующие задачи: дать общую характеристику и классифицировать процессы коррозии, выявить условия возникновения коррозиционного процесса, изучить основы кинетической теории коррозии и ее приложение к коррозии идеально чистых металлов, коррозию технических металлов и методы защиты.
1 Общая характеристика процессов коррозии
Коррозия металлов определяется как процесс (и как результат) самопроизвольного разрушения металлов при их химическом, электрохимическом или биохимическом взаимодействии с окружающей средой. Коррозия представляет собой нежелательный и непреднамеренный процесс. Электрохимическое растворение анодов из черновой меди в ванне по ее рафинированию нельзя считать коррозионным процессом, так как оно является необходимым и желательным звеном в очистке меди от примесей. В то же время электрохимическое растворение железного анода в ванне по электролизу воды следует отнести к категории коррозионных процессов, поскольку оно здесь нежелательно. Разъедание стенок железной цистерны при перевозке в ней серной кислоты считается коррозионным разрушением, а растворение железа в серной кислоте с целью получения чистого реактивного сульфата железа не принято рассматривать как его коррозию, хотя в основе обоих процессов лежат одни и те же явления.
Коррозия - это не только нежелательный, но и самопроизвольный процесс, и в подавляющем большинстве случаев ее протекание не связано с подведением энергии от какого-либо внешнего ее источника. Эту особенность коррозии легко понять, если учесть, что корродируют обычно металлы (черные и цветные), встречающиеся в природе не в самородном состоянии, а как соответствующие минералы и руды. На извлечение этих металлов из руд или минералов расходуется большое количество энергии. Эти же металлы переходят в результате их коррозионного разрушения снова в окислы, сульфаты, карбонаты и другие соединения, в форме которых они обычно встречаются в природе. Процесс коррозии, поскольку он приводит к регенерации исходных соединений, термодинамически более устойчивых по сравнению с чистыми металлами, протекает с уменьшением свободной энергии и совершается самопроизвольно. Напротив, металлы, которые в природе обычно встречаются в чистом виде (золото, платина и другие), не корродируют, если только условия их использования не слишком отличаются от природных. Неудивительно поэтому, что разрушение многих металлов проходит со значительной скоростью и приносит колоссальный ущерб всем отраслям народного хозяйства [1].
2 Классификация процессов коррозии
Различают химическую, биохимическую и электрохимическую коррозию металлов. Химическая коррозия металлов представляет собой их самопроизвольное разрушение, в основе которого лежат законы обычных гетерогенных химических реакций. Разрушение металлов под действием агрессивных газов при высоких температурах, исключающих конденсацию влаги на поверхности металла, а также, по-видимому, их растворение в условиях контакта с органическими средами, не проводящими тока, относятся к процессам химической коррозии. Биохимическая коррозия, или биокоррозия, вызывается жизнедеятельностью различных микроорганизмов или использующих металл как питательную среду, или выделяющих продукты, действующие разрушающе на металл. Биокоррозия обычно накладывается на другие виды коррозии. Для ее развития наиболее благоприятны почвы определенных составов, застойные воды и некоторые органические продукты.
Электрохимическая коррозия подчиняется законам электрохимической кинетики. Скорость ее можно определить на основе законов Фарадея. Электрохимическая коррозия встречается чаще всего и наиболее опасна для металлов. Она может протекать в газовой атмосфере, когда на поверхности металла возможна конденсация влаги (атмосферная коррозия), в почвах (почвенная коррозия) и в любых растворах электролитов (жидкостная коррозия).
Особым случаем электрохимической коррозии следует считать электрокоррозию - коррозию за счет внешнего электрического тока. К электрокоррозии, кроме разрушения нерастворимых анодов, относятся коррозия трубопроводов с токопроводящими жидкостями, а также растворение стенок электролитических ванн и подземных металлических сооружений под действием ответвленного постоянного тока (коррозия блуждающими токами). Один из участков металлического сооружения принимает ток (катодный участок) от какого-либо внешнего источника электрической энергии, а на другом - ток переходит в окружающую ионнопроводящую среду (анодный участок); разрушается при этом анодный участок.
В зависимости от характера разрушений, сопровождающих процесс электрохимической коррозии, различают сплошную коррозию, захватывающую всю поверхность металла, и местную, локализующуюся на определенных участках. Металлы, в зависимости от скорости их коррозии в данной среде, разделяют на устойчивые и неустойчивые. По тому, с какой скоростью разрушается металл в различных средах, их определяют как агрессивные или неагрессивные в коррозионном отношении. Для оценки коррозионной устойчивости металлов и агрессивности сред были предложены различные условные шкалы. Скорость коррозии выражают несколькими способами. Наиболее часто пользуются весовым и токовым показателями коррозии. Первый из них дает потерю веса (в граммах или килограммах) за единицу времени (секунду, час, сутки, год), отнесенную к единице площади (квадратный сантиметр, квадратный метр) испытуемого образца. Во втором случае скорость коррозии выражается силой тока (в амперах или миллиамперах), приходящейся на единицу площади образца [1,2].
Похожие работы
... хлоридом аммония в вакууме по методике, разработанной авторами [ 98, 108 ]. Глава III Исследование механизма электровосстановления ионов самария в хлоридных и хлоридно - фторидных расплавах. Исследование процесса электровосстановления ионов Sm3+ вольтамперометрическим методом при стационарных и нестационарных режимах поляризации ...
... ; е) отсутствуют заусенцы на кромках реза. Известный русский химик Е.И.Шпитальный в 1911г. разработал процесс электролитического полирования. В 1928 г. В.Н.Гусев применил этот процесс для размерной обработки станин крупных металлорежущих станков. Электролит не прокачивался. Катод-плиту на время убирали и ручным инструментом удаляли слой продуктов растворения. Процесс был трудоемким и медленным. ...
... и кондуктометрия. Наиболее эффективными вольтамперометрическими методами являются дифференциальная импульсная полярография (ДИП) и инверсионный электрохимический анализ (ИЭА). Сочетание этих двух методов позволяет проводить определение с очень высокой чувствительностью - приблизительно 10-9 моль/л, аппаратурное оформление при этом несложно, что дает возможность делать анализы в полевых условиях. ...
... меньшего количества ингибитора не достигается высокого значения степени защиты, введение ингибитора в большем количестве не ведет к увеличению степени защиты (таблица 1.2). Таблица 1.2 – Эффективность применения борат метилфосфита в качестве ингибитора коррозии в нейтральных средах. Количество ингибитора, мг/л Скорость коррозии Защитный эффект, % мм/год г/(м2·час) прототип – – 93 ...
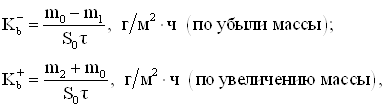
0 комментариев