Навигация
Пути повышения эффективности ингибиторов
1.4 Пути повышения эффективности ингибиторов
Все эффекты, приводящие к снижению скорости коррозии при добавлении в кислые растворы ПАВ, связаны с адсорбцией добавок. Поэтому повышение адсорбируемости ПАВ в общем случае должно сопровождаться увеличением их эффективности как ингибиторов.
Повышение эффективности следует ожидать от ПАВ, проявляющих одновременно и блокировочный, и Ψ1-эффекты. При введении такого ингибитора суммарный эффект будет определяться величинами γθ и γΨ1 . Одновременного проявления обоих эффектов можно ожидать, в частности, когда катионоактивный ингибитор содержит в своём составе хорошо адсорбирующиеся анионы, усиливающие адсорбцию органических катионов. Именно этому явлению обязаны так называемые эффекты межмолекулярного синергизма, когда сложный ингибитор обладает большим защитным эффектом, чем составляющие его компоненты.
Новым направлением в создании комбинированных ингибиторов можно назвать подбор смесей из органических и неорганических соединений. Одной из причин повышения эффективности органического компонента являются контактное осаждение ионов металлов на поверхности корродирующего металла. Осадок металла изменяет заряд поверхности, и по этой причине – условия адсорбции органического компонента смеси.
Химическая структура и защитное действие органических ПАВ – ингибиторов коррозии – детально обсуждены в монографии В.П. Григорьева и В.В. Экилика (4) и других работах. (3)
1.5 Способы оценки эффективности действия ингибиторов
Существуют различные количественные показатели оценки эффективности действия ингибиторов. Наиболее распространённый – по потере массы металла в единицу времени с единицы поверхности. В этом случае эффективность защиты оценивают коэффициентом торможения (ингибиторным эффектом) γ или степенью защиты z. Ингибиторный эффект показывает, во сколько раз ингибитор замедляет скорость коррозии и вычисляется по формуле.
γ = ρ0/ρ,
где ρ, ρ0 – скорости коррозии в присутствии ингибитора и без него.
Степень защиты характеризует полноту коррозии и вычисляется обычно в процентах.
z = 100 (ρ0 -ρ)/ ρ0 ; z = 100 [1-(1/ γ)].
Оценку эффективности ингибитора можно проводить также по поляризационным кривым, отражающим изменения в ходе протекания коррозионного процесса в присутствии ингибитора. В этом случае
γ = ί0/ ί; z = 100 (ί 0 - ί)/ ί 0,
где ί и ί0 – ток коррозионного процесса в коррозионной среде с ингибитором и без него.
1.6 Адсорбция ингибиторов
Адсорбция ингибиторов на поверхности металла может иметь различную природу. Различают физическую, химическую и специфическую адсорбцию. Под физической адсорбцией понимается явление концентрирования вещества из объема фаз на поверхность металла, вызванное электростатическими или дисперсионными силами, под химической адсорбцией – то же явление концентрирования вещества на поверхности металла, но обусловленное их химическим взаимодействием: изменением или разрушением старых и образованием новых химических связей, приводящих к образованию поверхностных химических соединений. Физическая и химическая формы адсорбции – крайние случае межатомного или молекулярного взаимодействия. Для различия этих форм адсорбции существует ряд экспериментальных критериев и прежде всего теплота адсорбции. При химической адсорбции она значительно больше (10-100кДж/моль), чем при физической (не превышает 10кдж/моль ). В качестве другого критерия иногда используют энергию активации. Считают, что хемосорбция протекает с активацией и сильно возрастает с температурой, физическая адсорбция – без активации. (5)
1.7 Кислотная коррозии
Ингибиторами кислотной коррозии называют вещества, наличие которых в кислоте или кислой среде в небольших количествах приводит к значительному торможению или почти полному подавлению коррозии. Ингибиторы вводят обычно в небольших количествах, не превышающих 5 г/л. Для кислых сред в качестве ингибиторов используются преимущественно органические соединения и в меньшей мере – неорганические. Широкое применение имеют смеси органических веществ, представляющих собой в большинстве случаев отходы химических производств, в той или иной степени модифицированные для придания им необходимых свойств.(5)
Наиболее эффективными ингибиторами кислотной коррозии металлов в области активного состояния являются органические ПАВ, имеющие в своём составе азот, серу, кислород, фосфор, а также непредельные соединения. (3)
1.8 Защита от коррозии в органических электропроводящих средах
Выявление зависимости эффективности ингибитора от химической структуры органического соединения является важнейшей научно-технической задачей. При изучении реакционной способности отдельных классов соединений, обладающих единым центральным реакционном ядром, свойства конкретного соединения можно прогнозировать, исходя из свединий о других соединениях этого класса.
Если в качестве стандартного берут соединение, описываемое в общем виде X-Y-H, то по отношению к нему следует рассматривать соединение X-Y-R, отличающееся радикалом R. Если эти вещества не вызывают блокировки поверхности, а изменяет только энергию активации реакции коррозии, то справедливо уравнение:
lgγR = γH + ρσ,
где γR и γH – коэффициенты торможения реакции коррозии соответственно каждым из соединений; ρ – реакционный параметр, принятый за единицу для стандартного соединения; σ – константа.
Если реализуется оба механизма действия ингибитора – блокировка поверхности и снижения энергии активации, то применяют уравнение:
lg (γR / γH) = ρσ – lg ( ΘR / ΘH ),
где Θ – степень заполнения поверхности каждым из ингибиторов. (7)
Закономерности коррозионных процессов в неводных (органических) средах определяются физико-химическими свойствами растворителей. (1')
Коррозионная стойкость цветных металлов.
Алюминий и его сплавы. Стандартный электродный потенциал алюминия -1.66 В. На основании этой величины можно предположить, что алюминий весьма активный металл, однако практически он обладает достаточно высокой стойкостью во многих агрессивных средах, так как на поверхности металла образуется защитная оксидная плёнка. Такая пленка появляется почти мгновенно при соприкосновении свежего среза металла с воздухом, но рост её продолжается медленно. Толщина плёнки зависит от многих условий : для алюминия, хранящегося в помещении, она составляет 0,01-0,02 мкм, при действии сухого кислорода от 0,02-0,04 мкм, а при термической обработке металлов доходит до 0,1 мкм. В зависимости от окружающих условий поверхностная плёнка состоит из аморфного или кристаллического оксида алюминия либо из гидроксида алюминия. Она обладает хорошим сцеплением и удовлетворяет условию сплошности. Таким образом, алюминий устойчив во всех средах, где на его поверхности может существовать защитная плёнка, и нестоек там, где эта плёнка разрушается, либо нет условий для её образования. Защитная плёнка на алюминии может образовываться даже при отсутствии окислителей; вода, водные растворы нейтральных солей пассивируют поверхность алюминия.
Коррозионная стойкость алюминия определяется рядом факторов – это природа агрессивной среды, её концентрация, температура, а также влиянием этих факторов на формирование защитной плёнки на поверхности металла.
В отдельных случаях алюминий проявляет исключительную стойкость в концентрированных кислотах, например, в азотной кислоте высоких концентраций стойкость алюминия выше, чем у нержавеющих сталей.
Наиболее опасными для алюминия являются растворы серной кислоты средних концентраций. В концентрированной кислоте и в высокопроцентном олеуме при 200°С алюминий достаточно устойчив. Снижение скорости коррозии в кислотах более высокой концентрации связывают с уменьшением концентрации водородных ионов, с затрудненностью диффузии продуктов реакции с поверхности металла, с возможным пассивированием. Стойкость алюминия в растворах кислот увеличивается с повышением его чистоты.
Галогеноводородные кислоты интенсивно действуют на алюминий, степень их агрессивности снижается согласно следующему ряду: НF - НCL – НBr – НI. В фосфорных и уксусных кислотах при комнатной температуре алюминий достаточно устойчив. Муравьиная, щавелевая, хлорорганические кислоты разрушают алюминий.
Серьёзные разрушения алюминия вызывают хлорсодержащие органические растворители, даже безводные, например CCL4, разрушают алюминий:
2Al + 6CCl4 ↔ 3C2Cl6 + 2AlCl3
Алюминиевые сплавы обладают меньшей коррозионной стойкостью, чем алюминий.
Контакт алюминия и его сплавов с другими металлами может вызвать интенсивную коррозию, особенно в растворах электролитов или в очень влажной атмосфере, поскольку большинство металлов является катодами в отношении к алюминию. Особенно опасен для алюминия и его сплавов контакт с медью, сплавами меди и нержавеющих сталями.
Цинк . Нормальный электродный потенциал цинка – 0,76В. В качестве конструкционного материала цинк не применяется. А используется для защиты от коррозии железоуглеродных сплавов. При нагревании в воде цинк устойчив, исключая интервал температур 50-80°С , когда на поверхности металла образуется рыхлая плёнка Zn(OH)2, которая отслаивается от поверхности. В растворах солей с более электроотрицательным катионом цинка устойчив. Присутствие в растворах более положительного катиона приводит к разрушению цинка:
Zn + FeSO4 ↔ Fe + ZnSO4
В растворах щелочей (рН>12) и кислот цинк неустойчив, но он обладает высокой стойкостью в нейтральных и слабощелочных средах в связи с образованием на поверхности Zn(OН)2.
2 Экспериментальная часть
2.1 Объекты исследования
В качестве ингибиторов коррозии цинка в 1 М растворе H2SO4 исследовали РС оксиазометина.
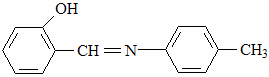
Изучали влияние адсорбции не замещённого оксиазометина хлорид анионов, которые вводили в ингибированный раствор H2SO4 в виде КCL на фоне постоянной (10 моль/л)
Концентрации органического оединения варьировали в пределах от 0.25 до 0.0625 моль/л.
Приготовление рабочих растворов.
Для проведения опытов использовали 1М водные растворы H2SO4.
0 комментариев