Составы равновесных жидкости и пара
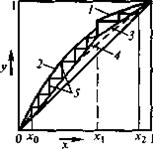
В случае совершенного раствора состояние равновесных жидкости и пара в общем случае не совпадает. На диаграмме давление-состав принято наносить точки, которые характеризуют состояние равновесного пара. Для совершенного раствора состоящего их 3-х компонентов завис. общего давления пара над раствором от состава выражается прямой линией.
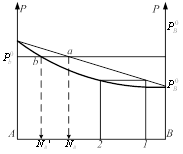
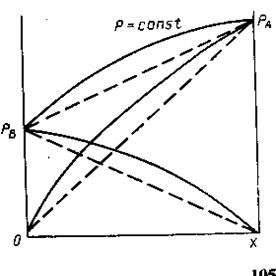
Если на эту диаграмму нанести точку выражающую состояние равновесного пара, то каждый давление. На диаграмме будут соответствовать - состояние жидкости в соответствии равновесного пара. Точка, выражающая состояние пара при различных давлениях соединяется плавной линией (линия пара). Т.о. на диаграмме 2 линии одна из которых (верхняя) характеризует состояние жидкост. раствора, она же является зависимостью общего давления пара над раствором от состояния. Эта линия называется линия жидкости. 2-ая линия (нижняя) называется линией пара и характеризует состояние равновесного пара. Чтобы определить состояние пара, находят равновесное с жидким состоянием: 1. мы должны из точки, характеризующей состояние жидкости восстановить перпендикуляр до пересечения с линией жидкости, через точку пересечения провести изобару до пересечения её с линией пара. Как видно из диаграммы в случае совершенного раствора равновесный пар всегда обогащен по сравнению с жидкостью более летучим компонентом, то есть тем компонентом, давление насыщенного пара которого выше. Линия жидкости и линия пара разделяют диаграмму на три области. Выше линии жидкости характеризуется жидким составом. Ниже линии пара – пар. Между линиями жидкости и пара характеризуется гетерогенной системой, состоящей из двух фаз – жидкости и насыщенного пара. В случае отклонения от закона Рауля линия жидкости перестаёт быть прямой, а в случае очень большого отклонения могут образовываться диаграммы с экстремами точек на линии общего давления.
В реальной системе как показывает опыт, пар не всегда обогащен по сравнению с жидкостью более летучим компонентом в отношении составом равновесной жидкости и пара. Коноваловым были сформулированы два закона. Первый закон: а) повышение относительного содержания данного компонента в жидкой фазе всегда вызывает увеличение относительного содержания его в паровой фазе. б) пар более богат тем компонентом раствора, добавление которого повышает общее давление пара или понижает температуру кипения при данном давлении. Второй закон: в экстремальной точке на кривой давления пара состав пара совпадает с составом жидкости. Растворы такого состава называются постоянно кипящими или азеотропными. Законы Коновалова выводят исходя из уравнения Гиббса-Дюгема. Т/д вывод приводит к следующему выражению: ![]() для бинарного раствора соединений компонента А и В.
для бинарного раствора соединений компонента А и В. ![]() – всегда >0, т к с ростом содержания компонента В в жидкости парциальное давление его насыщенного пара может только возрасти. В экстремальной точке на линии общего давления пара
– всегда >0, т к с ростом содержания компонента В в жидкости парциальное давление его насыщенного пара может только возрасти. В экстремальной точке на линии общего давления пара ![]() , т к
, т к ![]() ,
, ![]() , то есть содержание компонента В в паровой фазе
, то есть содержание компонента В в паровой фазе ![]() равно его содержанию в жидкости, то есть соблюдается второй закон Коновалова.
равно его содержанию в жидкости, то есть соблюдается второй закон Коновалова.
Диаграммы давление-состав и температура кипения-состав
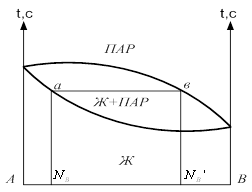
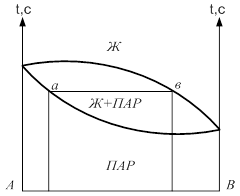
Диаграмма давление-состав с экстремальными точками имеет вид:
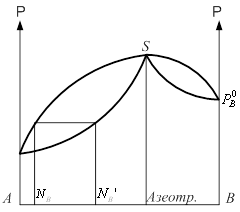
Совокупность равновесных состояний в двойной жидкостной системе может быть изображена в виде диаграммы давление-состав построенной при ![]() .
.
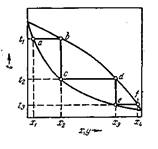
Если взять точку гетерогенной области, то она характеризует состав гетерогенной системы состоящей из жидкости и насыщенного пара. Чтобы определить состав насыщенной жидкости и пара нужно через эту точку провести изобару до пересечения её с линиями жидкости и пара. Точка в укажет на состав жидкости. Следовательно, в соответствии с первым законом Коновалова пар по сравнению с жидкостью будет более богат компонентом В. Массы равновесных фаз могут ![]() выражаться в массовых долях. Состояние равновесных жидкости и пара называется сопряжёнными. Диаграмма кипение–состав напоминает обратную диаграмму давление-состав. На диаграмме кипение – состав верхняя линяя – пар, нижняя – жидкость. Через точку проводим изотерму. Можно применить правила расчёта для определения качества равновесных фаз. Диаграмма кипение-состав и давление-состав широко используются для анализа и расчёта продуктов перегонки и ректификации.
выражаться в массовых долях. Состояние равновесных жидкости и пара называется сопряжёнными. Диаграмма кипение–состав напоминает обратную диаграмму давление-состав. На диаграмме кипение – состав верхняя линяя – пар, нижняя – жидкость. Через точку проводим изотерму. Можно применить правила расчёта для определения качества равновесных фаз. Диаграмма кипение-состав и давление-состав широко используются для анализа и расчёта продуктов перегонки и ректификации.
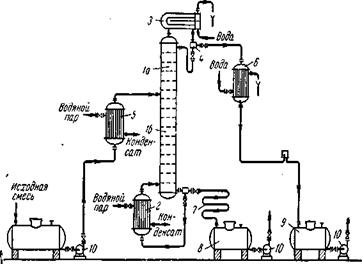
Дробная перегонка и ректификация
Дистилляцией называется процесс разделения раствора на те или другие составляющие части путём перегонки. В основе метода лежит различие в составе равновесных жидкости и пара. Чем больше это различие, тем легче осуществляется разделение. Для количественной характеристики раствора в этом отношении пользуются величиной коэффициента разделения
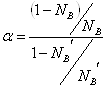 .
.
В случае совершенных растворов коэффициент разделения не зависит от состава ![]() . Процесс фракционной перегонки заключается в чередовании операций испарения и конденсации раствора. Процесс легко рассмотреть на примере диаграммы давление-состав или
. Процесс фракционной перегонки заключается в чередовании операций испарения и конденсации раствора. Процесс легко рассмотреть на примере диаграммы давление-состав или ![]() - состав использующийся законом Коновалова. Двойная система образующая диаграмму давления-состав
- состав использующийся законом Коновалова. Двойная система образующая диаграмму давления-состав ![]() без экстремальных точек путём фракционной перегонки можно разделить на практические чистые компоненты А и В. если же диаграмма с экстремальными точками, то систему этих компонентов дробной перегонкой можно разделить либо на компонент А и азеотропный раствор, либо на компонент В и азеотропный раствор В зависимости от свойства исходных жидкостей. Процесс дробной перегонки сложен и трудоёмок в промышленном масштабе. Разделение удаётся осуществить более успешно, проводя перегонку в форме непрерывного процесса, в котором операции конденсации и дистилляции отдельных фракций автоматизированы - ректификация. Разделение зависит от 3 факторов: 1) коэффициент разделения который свойственен данному раствору и зависимость его от состава в данной системе 2) от числа тарелок в колонне 3) от эффективности работы каждой тарелки.
без экстремальных точек путём фракционной перегонки можно разделить на практические чистые компоненты А и В. если же диаграмма с экстремальными точками, то систему этих компонентов дробной перегонкой можно разделить либо на компонент А и азеотропный раствор, либо на компонент В и азеотропный раствор В зависимости от свойства исходных жидкостей. Процесс дробной перегонки сложен и трудоёмок в промышленном масштабе. Разделение удаётся осуществить более успешно, проводя перегонку в форме непрерывного процесса, в котором операции конденсации и дистилляции отдельных фракций автоматизированы - ректификация. Разделение зависит от 3 факторов: 1) коэффициент разделения который свойственен данному раствору и зависимость его от состава в данной системе 2) от числа тарелок в колонне 3) от эффективности работы каждой тарелки.
Зависимость состава паровой фазы от температуры
При повышении температуры пар равновесный с летучей смесью постоянного состава, обогащается тем компонентом, парциальная молярная теплота испарения которого больше. Этот закон справедлив для летучих смесей как без азеотропа, так и с азеотропом.
В системе с макс. на кривой давления пара при повышении температуры в азеотропной смеси возрастает относительное содержание компонентов с большим парциальным молярной теплотой испарения, а в летучей смеси с мин. На кривой давления пара относительной содержание компонентов обратное.
При повышении температуры в системе с макс на кривой давления пара состав равновесного пара и состав азеотропной смеси изменяется в одном направлении. В системе с мин состав равновесного пара и азеотропной смеси изменяется в противоположных направлениях.
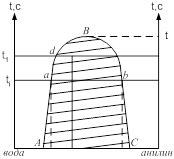
Многие жидкости обладают ограниченной взаимной растворимостью и в некотором интервале температур и состав при их смешении образует 2 фазы. Например, анилин – вода: АВ – характеризует изменение растворимости анилина в воде с изменением температуры. ВС – характеризует изменение растворимости воды в анилине при изменение Т. АВ и ВС сходятся в точке В которая называется верхней критической температурой растворимости. Выше этой температуры объёмы жидкостей смешиваются в любых соотношениях. Если провести изотерму ![]() , то она пересечёт кривую АВС, то она пересечёт в точке а и в, а характеризует состав водного слоя, а в – состав анилинового слоя. Растворы, соответствующие по составам точкам А и В называются сопряжёнными, а отрезок АВ называется нодой. Если взять смеси анилина и воды состава тачки d и нагреть эту смеси до температуры
, то она пересечёт кривую АВС, то она пересечёт в точке а и в, а характеризует состав водного слоя, а в – состав анилинового слоя. Растворы, соответствующие по составам точкам А и В называются сопряжёнными, а отрезок АВ называется нодой. Если взять смеси анилина и воды состава тачки d и нагреть эту смеси до температуры ![]() , то мы будем наблюдать в стакане 2 фазы: 1) водный раствор d1, а другой анилиновый слой. Массы сопряжённых фаз растворов можно определить по правилу рычага
, то мы будем наблюдать в стакане 2 фазы: 1) водный раствор d1, а другой анилиновый слой. Массы сопряжённых фаз растворов можно определить по правилу рычага ![]() . Для нахождения критической температуры растворимость можно использовать правило прямолинейного диаметра.
. Для нахождения критической температуры растворимость можно использовать правило прямолинейного диаметра.
Давление насыщенного пара в системах с ограниченной взаимной растворимостью компонентов
В подобных рассмотренных системах оба жидких слоя при равновесии обладают одинаковым паром (по общему давлению состава и по парциальному давлению компонента С).
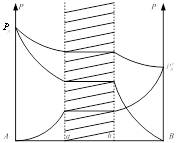
Различие в общем составе жидкости предельной гетерогенной области означает только разницу относительного количества того и другого слоя при постоянном составе каждого из них. Как общее так и парциальное давление насыщенного пара для всей указанной области сохраняет постоянные значения.
Взаимно нерастворимые жидкости
Если жидкости взаимно нерастворимы, то они образуют гетерогенные системы в которых каждый компонент существует независимо от другого. Давление пара каждого из компонентов над смесью равно давлению пара чистого компонента.

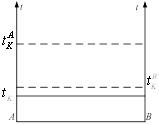
Общее давление пара смеси взаимно нерастворимых жидкостей равно сумме давлений насыщенного пара чистых компонентов при той же температуре. Поэтому такие смеси кипят при температуре более низкой чем температура кипения каждого из компонентов. По мере испарения гетерогенной смеси температура её кипения остаётся постоянной пока полностью не испарится одним из компонентов, после этого температура кипения системы скачкообразно изменяется до температуры кипения оставшегося компонента. Это используется в технике и лабораторной практике для перегонки с водяным паром. Состав насыщенного пара не зависит от соотношения компонентов в жидкости. обозначая и числа молей компонентов А и В в паре и полученного из пара конденсате. Если - V пара, то уравнение Менд-Клап можно записать![]()
![]()
![]() . Если вторым компонентом является вода, то
. Если вторым компонентом является вода, то ![]() .
. ![]() – расходный коэффициент пара. Он тем больше, чем меньше
– расходный коэффициент пара. Он тем больше, чем меньше ![]() и
и ![]() . Перегонка с водяным паром применяется для отгонки бензола из каменноугольной смолы, очистки анилина.
. Перегонка с водяным паром применяется для отгонки бензола из каменноугольной смолы, очистки анилина.

Похожие работы
... Точками области 1 соответствует газообразное, области 2 - жидкое, области 3 - твердое состояние вещества. Плоскость ТР с указанными тремя кривыми равновесия называется диаграммой состояния. Диаграмма состояния позволяет судить, какие будут происходить фазовые превращения при том или ином процессе. Допустим, например, что производится нагревание при постоянном давлении. На диаграмме состояния такой ...
... резкое изменение температуры, обусловленное скачкообразным изменением концентрации РА. [12] Постановка задачи Целью данной работы является поиск оптимальной схемы экстрактивной ректификации смеси бензол-циклогексан-этилбензол-н-пропилбензол, содержащей один бинарный азеотроп. Для этого необходимо выполнить: · параметрическую оптимизацию традиционных схем экстрактивной ректификации; · ...
... применяют, главным образом, при ректификации спирта и жидкого воздуха (кислородные установки). Для повышения к.п.д. в ситчатых тарелках (как и в колпачковых) создают более длительный контакт между жидкостью и паром. 2. Теоретические основы расчета тарельчатых ректификационных колонн Известно два основных метода анализа работы и расчета ректификационных колонн: графоаналитический ( ...
... смеси на четыре продукта [17]. I – IV — продукты. 2. ПОСТАНОВКА ЗАДАЧИ ИССЛЕДОВАНИЯ. Целью настоящей работы является определение оптимальных рабочих параметров процесса экстрактивной ректификации смеси ацетон-хлороформ азеотропного состава в сложной колонне с боковой укрепляющей секцией. К таким параметрам относятся температура и расход разделяющего агента, тарелки подачи исходной смеси и ...

0 комментариев