Навигация
3. Продукты разделения
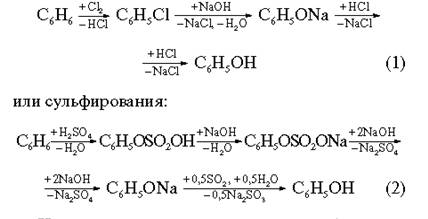
3.1. ХлорбензолХлорбензол молучают по следующим реакциям:
Таблица 3.1.1.
«Получение Хлорбензола»
| а) каталитическое хлорирование бензола; | С6Н6 + С12 —> С6Н5С1 + НС1 |
| б) окислительное хлорирование бензола; | С6Н6 + НС1 + 0,5О2 —> СеН5С1 + Н2О |
| в) синтез из анилина через реакцию диазотирования | HNO2 N2 CSH5NH2 —> C6H5N = N+Cl- —> C6H5C1 HC1 |
| г) Электрохимический синтез. Бензол хлорируют моноксидом хлора в присутствии кислот. | Т=40—60°С С6Н6 + С12 —> С6Н5С1 + НС1 Кат: димитилформамид |
Окислительное хлорирование проводят при 235—245°С в присутствии катализатора, состоящего из хлоридов меди и железа, осажденных на оксиде алюминия. Бензол, хлороводород и кислород в соотношении 10:2:3 направляют в реактора в котором бензол превращается за один проход на 10—15%. Продукт хлорирования состоит из хлорбензола (95—98%) и дихлорбензола 3—5%; соотношение п- и о-изомеров 7:3.Окислительное хлорирование бензола в хлорбензол проводят в кипящем слое катализатора (СuС12/А12Оз с удельной поверхностью 250—400 м2/г) при 190—230 °С с использованием в качестве хлорирующего агента НС1, НС1+С12.Возможно подвергать окислительному хлорированию контактный газ, выходящий из хлоратора прямого хлорирования бензола, что позволяет повысить единичную мощность одного агрегата. (На 1 т продукта хлорбензола, в качестве отхода, образуется 330 кг хлороводорода, из которого можно получить дополнительно до 0,9 т хлорбензола).
Синтез хлорбензола из анилина промышленного значения не имеет.
Принципиальная технологическая схема процесса хлорирования бензола.
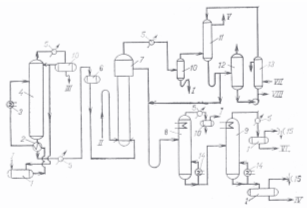
Рис. 3.1.1. Технологическая схема хлорирования бензола:
1 — емкость; 2, 3 — подогреватели; 4 — колонна азеотропной осушки;
5 — конденсатор; 6 — напорный бачок; 7 — хлоратор; 8, 9 — насадочные колонны;
10 — сепаратор; 11— конденсатор смешения; 12 — сборник; 13 — холодильник;
14 — кипятильник; 15 — вакуум.
/ — бензол; // — хлор; III — вода; IV — полихлориды; V — НС1; VI — хлорбензол; VII — рассол; VIII—в аппарат 8
Бензол проходит колонну азеотропной осушки 4, сверху которой выходит азеотроп (91,2% бензола и 8,8% воды), после конденсации и охлаждения (5) расслаивающийся на бензол и воду в сепараторе 10, откуда водный бензол направляют на орошение колонны 4, а другая его часть возвращается на осушку (1), Снизу колонны 4 уходит осушенный бензол [0,001—0,003% (масс.) воды] и собирается в напорный бачок 6. Предварительная очистка бензола от сернистых соединений (CS2, тиофен) и тщательная осушка его обеспечивают повышенную активность катализатора. Осушка хлора до 0,04% влаги достигается пропусканием хлора через серную кислоту. Хлор в реактор подают через газовый затвор, исключающий попадание бензола в линию хлора при возможных прекращениях его подачи.
Таблица 3.1.2.
| Высота затвора ,м | 11 (от верхнего уровня реакционной массы в реактор). |
| Катализатор ( в процессе генерируется) В реакционной массе не более 0,015%. | FeCI3 |
| Давление хлора, поступающего в реактор, МПа | 0,1h*+0,02 (h*. — высота реакционной массы в реакторе, м). |
| Стальние и керамические кольца ,мм | 25х25 или 50x50 |
| Температура в хлораторе ,оС | 76—83 |
| Унос паров бензола (т/1т НСl) | 1,4-1,5 |
| Тепло реакции, (кДж/1моль Сl) | 92,11 |
| Оптимальное время пребывания, с | 9-10 |
| Соотношение бензол : хлор, (мол.). | 3,5:1 |
| Производительность реактора ,кг/м3 | 250—300 |
Разработана математическая модель промышленного реактора хлорирования бензола, что позволило оптимизировать процесс.
Реакция развивается по схеме:
С6Н6 —> С6Н5С1 —> С6Н4С12 и т. д. (3.1.1.)
Поскольку хлорбензол хлорируется в 8 раз медленнее, чем бензол (за счет дезактивации ароматического кольца под влиянием атома хлора), нет необходимости вводить в реакцию чрезмерный избыток бензола по отношению к хлору.
Для повышения селективности процесса ограничиваются невысокой степенью превращения бензола. Реакционная смесь, выходящая из расширенной части реактора, содержащая 64—65% бензола, 33,5— 34% хлорбензола, 1,5% полихлоридов, немного растворенных НС1 и FeCl3, вместе с раствором, отбираемым из конденсатора 11, направляется на разделение в секцию ректификации (8, 9). Дистилляции предшествует промывка продуктов реакции от FeCl3 и НС1 обработкой в смесителях водным раствором NaOH (20—25 кг на 1 т хлорбензола) и сепарация от водной неорганической фазы (на схеме не показана). Колонны 8 и 9—насадочные; в первой (8) отделяют бензол и воду, после чего бензол возвращается на азеотропную осушку (99,5%—бензол, 0,5%—хлорбензол); во второй (9) выделяют хлорбензол (температура верха 80±2°С при 27 кПа, низа 138—142 °С). Перегонка под вакуумом позволяет уменьшить расход водяного пара в кипятильнике колонны 9. Товарный продукт содержит не более 0,25% бензола и 0,3—1,1% полихлоридов.
Выделение бензола из газов, покидающих реактор, осуществляют двухступенчатым охлаждением (12, 13). Вначале газы охлаждают до 30 °С (конденсируется до 90% бензола), а затем при —2 °С (выделяется дополнительно 9% бензола).
Таблица 3.1.3.
| Расход на 1 т хлорбензола. | |
| Бензол | 0,798 т |
| Хлор | 0,715 т |
| Электроэнергия | 58 кВт-ч |
Таблица 3.1.4.
| США | ФРГ | Япония | |
| Производство хлорбензола, (тыс.тонн) | 130 | 97 | 34 |
| Мощности, (тыс.тонн) | 168 | - | - |
| Общая потребность, (тыс.тонн) | 100 | - | - |
| Структура потребления, % : | |||
| -растворитель | 42 | - | - |
| -переработка в нитрохлорбензол | 32 | - | - |
| - в дифенилоксид и фенилфенолы | 15 | - | -- |
| -другие продукты | 11 | - | - |
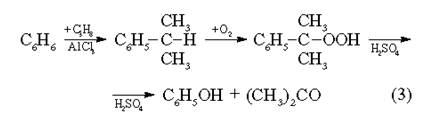
Гидролизом хлорбензола при 400—420 ºС без давления в присутствии фосфатов кальция и меди получают фенол (по Рашигу):
С6Н5С1 + Н2О —> С6Н5ОН + НС1 (3.1.2.)
Формально образующийся НС1 может быть использован повторно для получения хлорбензола окислительным хлорированием бензола.
Недостатки метода — большая энергоемкость процесса, а также необходимость применять специальное коррозионно-устойчивое оборудование. В прошлом метод Рашига преобладал среди промышленных методов получения фенола, например в США. В дальнейшем метод потерял конкурентоспособность в связи с появлением эффективного способа получения фенола из кумола через стадию образования гидропероксида кумола. Переработка хлорбензола в фенол в целом утратила свое значение, и тем более потерял практическую ценность некаталитический щелочной гидролиз хлорбензола (400 °С, давление более 30 МПа) или гидролиз его в присутствии меди, как катализатора:
C6H5Cl + 2NaOH —> C6H5ONa + NaCl +H2O (3.1.3.)
При нитровании хлорбензола нагреванием с азотной кислотой образуется смесь о- и n-изомеров:
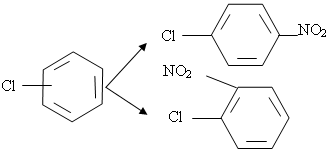
При обработке хлорбензола эквивалентным количеством HNO3 выход о-изомера снижается. Процесс ведут при 60—80 °С и отношении реактантов HNO3: С6Н5С1= (0,2—0,8) : 1 (мол.), концентрация HNO3![]() 95%.
95%.
Хлорнитробензолы восстанавливают в хлоранилины — важнейшие промежуточные соединения для синтеза эффективных пестицидов.
Селективность процесса 96%. Хлоранилины превращают вначале в арилизоцианаты действием фосгена,а образующиеся, арилизоцианаты конденсируют со спиртами и аминами.
В присутствии олеума хлорбензол конденсируется с хлоралем, образуя известный инсектицид дихлордифенилтрихлорме-тилметан (ДДТ). Длительное его использование привело к появлению резистентных штаммов насекомых. Обладая высокой персистентностью в растениях и организмах животных, он способен накапливаться в тканях, в связи с чем частично или полностью запрещен к применению. Его аналоги, не содержащие хлор в бензольном ядре, а также аналоги несимметричного строения не имеют указанных отрицательных свойств и используются в быту и в сельском хозяйстве.
При относительно невысокой температуре (200—250 °С) в присутствии меди (или ее солей) хлорбензол взаимодействует с фенолом, образуя дифенилоксид:
С6Н5С1 + С6Н5ОН —> (С6Н5)2О + НСl (3.1.4.)
Дифениловый эфир является термостойким теплоносителем.
3.2. Дихлорбензолы
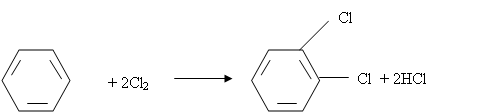 Единственным практически значимым методом получения о-дихлорбензола можно считать прямое хлорирование бензола или хлорбензола
Единственным практически значимым методом получения о-дихлорбензола можно считать прямое хлорирование бензола или хлорбензола
(3.2.1.)
Принципиальная схема производства 1,2- и 1,4- дихлорбензолов.
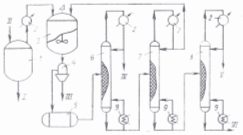
Рис. 3.2.1. Принципиальная схема производства 1,2- и 1,4-дихлорбензолов:
1 — перегонный куб; 2 — холодильник; 3 — кристаллизатор;
4 — центрифуга; 5 —сборник; 6, 7, 8 — ректификационные колонны;
9 — кипятильник.
/ — на сжигание; // — гсолнхлориды; III— 1,4-дихлорбензол;
IV — в производство хлорбензола; V— 1,2-дихлорбензол; VI — на сжигание
Принципиальная технологическая схема получения 1,2- и 1,4-дихлорбензолов приведена на рис. 3.2.1. Сырьем служат отходы производства хлорбензола.
Состав исходного сырья:
Таблица 3.2.1.
| Состав | % |
| Хлорбензол | 3—5 |
| 1,4-дихлорбензол | 55—60 |
| 1,2-дихлорбензол | 35 |
| Примеси трихлорбензола и смолообразных продуктов | - |
Сырье «осветляют», подвергая отгонке до 130 °С (20 кПа) из стального эмалированного перегонного куба 1. После конденсации и охлаждения (2) смесь поступает на кристаллизацию в аппарат 3, снабженный рубашкой для охлаждения и мешалкой, при температуре 0°С. Цикл кристаллизации составляет 5—6 ч. Выпавшие кристаллы n-дихлорбензола отделяются на центрифуге 4. Маточный раствор (5% хлорбензола, 35—50% 1,4-дихлорбензола, 52—57% 1,2-дихлорбензола и 3% трихлорбензола) сливается в сборник 5, откуда подается в секцию ректификации (6—8). В колонне 6 выделяют хлорбензольную фракцию (70% хлорбензола, 30% дихлорбензола), которую возвращают в цех получения хлорбензола. В колонне 7 отгоняют под вакуумом основное количество о- и п -дихлорбензолов, направляемых повторно на кристаллизацию (3). В колонне 8 выделяют под вакуумом о-дихлорбензол (до 95% основного компонента), а остаток (в основном трихлорбензол), объединив с отходами из куба 1, подают на сжигание. В качестве катализатора применяют МnСl2. Одно из преимуществ процесса жидкофазного хлорирования бензола — невысокая чувствительность к влаге, что снимает необходимость тщательной осушки реагентов. Температура хлорирования 27—74 °С.
Для разделения изомеров дихлорбензолов применяют экстрактивную дистилляцию с участием диолов или замещенных анилинов.
Дихлорбензолы можно получать окислительным хлорированием бензола или хлорбензола при 285—295 °С в присутствии катализатора CuCl2, LiCl, PbO в соотношении: 1:(0,5—0,7): (0,02 — 0,04) на алюмосиликатном носителе.
Основные показатели о- и п- производних дихлорбензола
Таблица 3.2.2.
| США | ФРГ | Япония | |
| Производство о – и n-дихлорбензолов, тыс. тон | 56 | 34 | 25 |
| Мощность по о-дихлорбензолу, тыс. тон | 36,24 | - | - |
| Потребность | 20,4 | 20,3 | 20,5 |
| Области потребления ортодихлорбензола, % : | |||
| - органический синтез | 90 | - | - |
| - другие цели | 5 | - | - |
Таблица 3.2.3.
| Мощность по n-дихлорбензолу , тыс. тон | 55.89 |
| Потребность п- дихлорбензола на ,тыс. т | |
| -1998 | 33.5 |
| -1999 | 34.9 |
| -2000 | 38.8 |
| . Структура потребления, %: | |
| -специальные дезодоранты | 34 |
| -1,2,4-трихлорбензол | 9 |
| -полифениленсульфидиые смолы | 27 |
4. Моделирование парожидкостного равновесия
Выбор модели, адекватно описывающей фазовое равновесие системы, является важным и необходимым шагом при решении массообменного процесса. На сегодняшний день разработано достаточно большое число методов математического моделирования различных типов парожидкостного равновесия.
В настоящей работе на основании общих рекомендаций по применению были выбраны три группы математических моделей, имеющих различное представление о структуре раствора и межмолекулярных взаимодействиях:
· Модели локальных составов (Wilson, NRTL, UNIQUAC);
· Уравнения состояния (SRK, Peng Robinson);
· Групповая модель (UNIFAC).
4.1. Модели локальных составовКонцепция локальных составов позволяет учитывать структуру раствора, свойства чистых веществ и межмолекулярные взаимодействия разных типов (слабые неспецифические и сильные специфические).
Согласно этой теории раствор рассматривается как упорядоченная структура.
Для бинарной смеси можно выделить молекулы двух сортов, при этом молекула одного вида находится в окружении молекул другого вида. Зависимость между концентрациями компонентов внутри такого образования с общей молярной концентрацией компонентов в растворе описывается соотношением, учитывающим вероятность возникновения связей между разноименными молекулами.
Похожие работы
... реакции относятся к самопроизвольным процессам. Со временем катализатор изменяется и после определенного срока может полностью необратимо потерять свою активность. Прогрессивные химико-технологические процессы Радиационно-химическую технология. За последние два десятилетия сформировалась новая область химической технологии - радиационно-химическая технология (РХТ). Ее предшественницей ...
0 комментариев