Навигация
4.2. Модель Вильсона [33-35]
Уравнение Вильсона было первым уравнением, в котором была применена концепция локального состава. Основная идея ее состоит в том, что из-за разницы в межмолекулярных взаимодействиях локальный состав вблизи конкретной молекулы в растворе будет отличаться от состава жидкости. Для бинарной пары два параметра связаны со степенью, в которой каждая молекула влияет на состав своего локального окружения. Выражение для коэффициента активности представлено ниже:
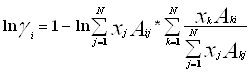 (4.2.1.)
(4.2.1.)
где: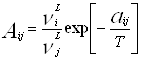 , (aij, °K); (4.2.2.)
, (aij, °K); (4.2.2.)
![]() – мольный объем жидкости компонента i.
– мольный объем жидкости компонента i.
Параметры aij представляет энергию взаимодействия между молекулами i и j.
Уравнение Вильсона может быть использовано в довольно широком интервале температур, несмотря на то, что его параметры в явном виде не включают температурную зависимость. Эта модель также дает хорошие результаты для смесей, содержащих полярные компоненты.
К недостаткам модели можно отнести то, что уравнение Вильсона не может описывать локальные максимумы или минимумы коэффициента активности, а также не подходит для описания равновесия с частично смешивающимися жидкими фазами.
4.3. Модель NRTL [36-37]Уравнение NRTL (non-random two-liquid – неслучайное двужидкостное) было разработано Реноном и Праузницем с целью использовать концепцию локального состава в тех случаях, когда уравнение Вильсона неспособно к предсказанию разделения фаз жидкость – жидкость. Модель NRTL дает хорошие результаты для широкого круга систем, в частности для смесей в высокой степени неидеальных и для частично несмешивающихся систем.
Выражение для коэффициента активности имеет вид:
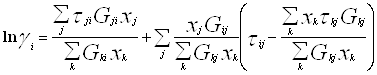 (4.3.1.)
(4.3.1.)
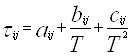 , (когда единицей измерения является °K); (4.3.2.)
, (когда единицей измерения является °K); (4.3.2.)
![]() (4.3.3.)
(4.3.3.)
Для каждой бинарной пары требуется три параметра (![]() ,
, ![]() ,
, ![]() ), которые могут быть расширены включением в них температурной зависимости.
), которые могут быть расширены включением в них температурной зависимости.
Уравнение UNIQUAC (universal quasi-chemical – универсальное квазихимическое) было развито Абрамсом и Праусницем на основании статистически-механических положений и решеточной квазихимической модели Гуггенхайма. Каждую молекулу характеризует два параметра: объем ![]() и площадь (поверхность)
и площадь (поверхность) ![]() .
.
Избыточная энергия Гиббса (и соответственно логарифм коэффициента активности) делится на комбинаторную и остаточную части. Комбинаторная часть зависит только от размеров и форм отдельных молекул, она не содержит бинарных параметров. Остаточная часть, которая учитывает энергетические взаимодействия, имеет два регулируемых бинарных параметра. Выражение для коэффициента активности имеет следующий вид:
![]() (4.4.1.)
(4.4.1.)
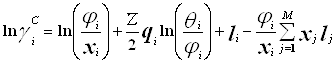 (4.4.2.)
(4.4.2.)
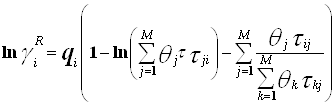 (4.4.3.)
(4.4.3.)
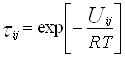 (4.4.4.)
(4.4.4.) 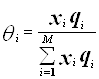 (4.4.5.)
(4.4.5.)
![]() (4.4.6.)
(4.4.6.) ![]() (4.4.7.)
(4.4.7.)
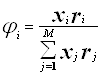 (4.4.8.)
(4.4.8.) 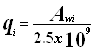 (4.4.9.)
(4.4.9.) ![]()
![]() (4.4.10.)
(4.4.10.)
где ![]() ,
, ![]() – объем и площадь Ван-дер-Ваальса молекулы i
– объем и площадь Ван-дер-Ваальса молекулы i
С и R – комбинаторный и остаточный вклады в коэффициент активности жидкости.
Для каждой бинарной пары необходимы два параметра: Uij и Uji, которые используются в вычислениях остаточной части коэффициента активности. По желанию параметры могут быть расширены включением температурной зависимости.
Уравнение UNIQUAC адекватно описывает широкий ряд систем, оно применяется для неэлектролитических смесей, содержащих полярные или неполярные компоненты, также подходит для частично смешивающихся систем.
4.5. Уравнения состояния [42-43]Уравнения состояния применимы для широкого диапазона температур и давлений. Они могут быть использованы для расчетов всех термодинамических свойств, таких как К-значения, энтальпия, энтропия и плотность. Стандартным состоянием, как для жидкости, так и для пара является идеальный газ, а отклонения от идеального поведения определяются расчетом коэффициентов фугитивности для обеих фаз.
4.6. Модель SRKВ 1972 г. для улучшения предсказания парового давления чистых компонентов и парожидкостного равновесия многокомпонентных смесей Соав предложил следующую температурную зависимость:
![]() (4.6.1.)
(4.6.1.)
![]() (4.6.2.)
(4.6.2.)
где ![]() – приведенная температура, Т/Тс
– приведенная температура, Т/Тс
![]() – ацентрический фактор
– ацентрический фактор
Константы в уравнении (4.6.2.) были получены из преобразования данных по паровому давлению для ограниченного числа обычных углеводородов. Эти пределы использования уравнения состояния СРК ограничены неполярными компонентами.
Уравнение состояния Соав-Редлих-Квонга – это модификация уравнения состояния Редлиха-Квонга (которое основано на уравнении Ван-дер-Ваальса). Соав заменил член ![]() более общей температурной зависимостью а(Т). Выражение получило следующий вид:
более общей температурной зависимостью а(Т). Выражение получило следующий вид:
![]() (4.6.3.)
(4.6.3.)
где ![]()
![]() (4.6.4.)
(4.6.4.)
![]() ,
, ![]() – критические температура и давление для i-го компонента
– критические температура и давление для i-го компонента
![]() (4.6.5.)
(4.6.5.)
![]() (4.6.6.)
(4.6.6.) ![]() (4.6.7.)
(4.6.7.)
![]() (4.6.8.)
(4.6.8.)
![]() (4.6.9.)
(4.6.9.)
![]() – ацентрический фактор для компонента i
– ацентрический фактор для компонента i
![]() – константа бинарного взаимодействия для компонентов i и j
– константа бинарного взаимодействия для компонентов i и j
Введение члена альфа позволило улучшить предсказание парового давления для чистых компонентов. Комбинированная формула для вычисления α(Т) с введенным членом ![]() означает улучшение предсказания свойств смеси.
означает улучшение предсказания свойств смеси.
Использование формулировки Соава для предсказания свойств смеси включает в себя два этапа. Во-первых, для каждого из компонентов подбирается ацентрический фактор компонента (wi) таким образом, чтобы точно предсказать давление паров компонента. Во-вторых, из экспериментальных данных для бинарных систем с компонентами i и j, для которых достигается фазовое равновесие, определяется параметр kij.
4.7. Модель Peng-RobinsonУравнение состояния Пенга-Робинсона было опубликовано в 1976 году и является модификацией уравнения Редлиха-Квонга. Во многих отношениях оно похоже на уравнение SRK, но все же он разработано для улучшения предсказания плотности жидкости. Как и в случае уравнения Соава-Редлиха-Квонга, в уравнении Пенга-Робинсона присутствует температурная зависимость а(Т) и выражение имеет следующий вид:
![]() (4.7.1.)
(4.7.1.)
где: ![]() (4.7.2.)
(4.7.2.)
![]() (4.7.3.)
(4.7.3.)
![]() ,
, ![]() – критические температура и давление компонента i
– критические температура и давление компонента i
![]() (4.7.4.)
(4.7.4.)
![]() (4.7.5.)
(4.7.5.) ![]() (4.7.6.)
(4.7.6.)
![]() (4.7.7.)
(4.7.7.)
![]() (4.7.8.)
(4.7.8.)
![]() – ацентрический фактор для компонента i
– ацентрический фактор для компонента i
![]() – константа бинарного взаимодействия для компонентов i и j
– константа бинарного взаимодействия для компонентов i и j
Введением члена α было достигнуто улучшение предсказания давления пара чистых компонентов, а добавлением члена ![]()
![]() в комбинированную формулу для вычисления а(Т) означало улучшение предсказания свойств смесей.
в комбинированную формулу для вычисления а(Т) означало улучшение предсказания свойств смесей.
Использование уравнения Пенга-Робинсона включает в себя два шага, аналогичные предыдущей модели.
4.8. Групповые моделиГрупповые модели основаны на предположении об аддитивности вкладов различных химических групп в термодинамические свойства компонентов и смесей. Наибольшее распространение получила модель UNIFAC. Именно её мы использовали для создания псевдоэкспериментальных данных парожидкостного равновесия. Рассмотрим модель более подробно.
Похожие работы
... реакции относятся к самопроизвольным процессам. Со временем катализатор изменяется и после определенного срока может полностью необратимо потерять свою активность. Прогрессивные химико-технологические процессы Радиационно-химическую технология. За последние два десятилетия сформировалась новая область химической технологии - радиационно-химическая технология (РХТ). Ее предшественницей ...
0 комментариев