Навигация
Фосфор и его соединения
Реферат
Содержание
Введение
Глава I. Фосфор как элемент и как простое вещество
1.1. Фосфор в природе
1.2. Физические свойства
1.3. Химические свойства
1.4. Получение
1.5. Применение
Глава II. Соединения фосфора
2.1. Оксиды
2.2. Кислоты и их соли
2.3. Фосфин
Глава III. Фосфорные удобрения
Заключение
Библиографический список
Введение
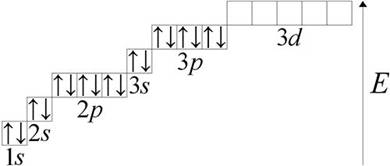
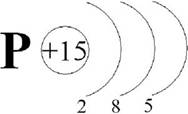 Фосфор (лат. Phosphorus) P – химический элемент V группы периодической системы Менделеева атомный номер 15, атомная масса 30,973762(4). Рассмотрим строение атома фосфора. На наружном энергетическом уровне атома фосфора находятся пять электронов. Графически это выглядит так:
Фосфор (лат. Phosphorus) P – химический элемент V группы периодической системы Менделеева атомный номер 15, атомная масса 30,973762(4). Рассмотрим строение атома фосфора. На наружном энергетическом уровне атома фосфора находятся пять электронов. Графически это выглядит так:
1s22s22p63s23p33d0
В 1699 г. гамбургский алхимик X. Бранд в поисках «философского камня», якобы способного превратить неблагородные металлы в золото, при выпаривании мочи с углём и песком выделил белое воскообразное вещество, способное светиться.
Название «фосфор» происходит от греч. «phos» – свет и «phoros» – несущий. В России термин «фосфор» введён в 1746 г. М.В. Ломоносовым.
К основным соединениям фосфора относят оксиды, кислоты и их соли (фосфаты, дигидрофосфаты, гидрофосфаты, фосфиды, фосфиты).
Очень много веществ, содержащих фосфор, содержатся в удобрениях. Такие удобрения называют фосфорными.
Глава I Фосфор как элемент и как простое вещество
1.1 Фосфор в природе
Фосфор относится к числу распространенных элементов. Общее содержание в земной коре составляет около 0,08%. Вследствие лёгкой окисляемости фосфор в природе встречается только в виде соединений. Главными минералами фосфора являются фосфориты и апатиты, из последних наиболее распространён фторапатит 3Ca3(PO4)2 • CaF2. Фосфориты широко распространены на Урале, в Поволжье, Сибири, Казахстане, Эстонии, Беларуси. Самые большие залежи апатитов находятся на Кольском полуострове.
Фосфор – необходимый элемент живых организмов. Он присутствует в костях, мышцах, в мозговой ткани и нервах. Из фосфора построены молекулы АТФ – аденозинтрифосфорной кислоты (АТФ – собиратель и носитель энергии). В организме взрослого человека содержится в среднем около 4,5 кг фосфора, в основном в соединении с кальцием.
Фосфор содержится также в растениях.
Природный фосфор состоит лишь из одного стабильного изотопа 31Р. В наши дни известно шесть радиоактивных изотопов фосфора.
1.2 Физические свойстваФосфор имеет несколько аллотропных модификаций – белый, красный, чёрный, коричневый, фиолетовый фосфор и др. Первые три из названных наиболее изучены.
Белый фосфор – бесцветное, с желтоватым оттенком кристаллическое вещество, светящееся в темноте. Его плотность 1,83 г/см3. Не растворяется в воде, хорошо растворяется в сероуглероде. Имеет характерный чесночный запах. Температура плавления 44°С, температура самовоспламенения 40°С. Чтобы защитить белый фосфор от окисления, его хранят под водой в темноте (на свету идёт превращение в красный фосфор). На холоде белый фосфор хрупок, при температурах выше 15°С становится мягким и режется ножом.
Молекулы белого фосфора имеют кристаллическую решётку, в узлах которой находятся молекулы Р4, имеющие форму тетраэдра.
Каждый атом фосфора связан тремя σ-связями с другими тремя атомами.
Белый фосфор ядовит и даёт труднозаживающие ожоги.
Красный фосфор – порошкообразное вещество тёмно-красного цвета без запаха, в воде и сероуглероде не растворяется, не светится. Температура воспламенения 260°С, плотность 2,3 г/см3. Красный фосфор представляет собой смесь нескольких аллотропных модификаций, отличающихся цветом (от алого до фиолетового). Свойства красного фосфора зависят от условий его получения. Не ядовит.
Чёрный фосфор по внешнему виду похож на графит, жирный на ощупь, обладает полупроводниковыми свойствами. Плотность 2,7 г/см3.
Красный и чёрный фосфоры имеют атомную кристаллическую решётку.
1.3 Химические свойстваФосфор – неметалл. В соединениях он обычно проявляет степень окисления +5, реже – +3 и –3 (только в фосфидах).
Реакции с белым фосфором идут легче, чем с красным.
I. Взаимодействие с простыми веществами.
1. Взаимодействие с галогенами:
2P + 3Cl2 = 2PCl3 (хлорид фосфора (III)),
PCl3 + Cl2 = PCl5 (хлорид фосфора (V)).
2. Взаимодействие с нематаллами:
2P + 3S = P2S3 (сульфид фосфора (III).
3. Взаимодействие с металлами:
2P + 3Ca = Ca3P2 (фосфид кальция).
4. Взаимодействие с кислородом:
4P + 5O2 = 2P2O5 (оксид фосфора (V), фосфорный ангидрид).
II. Взаимодействие со сложными веществами.
3P + 5HNO3 + 2H2O = 3H3PO4 + 5NO↑.
1.4 ПолучениеФосфор получают из измельченных фосфоритов и апатитов, последние смешиваются с углем и песком и прокаливаются в печах при 1500°С:
2Ca3(PO4)2 + 10C + 6SiO2![]() 6CaSiO3 + P4↑ + 10CO↑.
6CaSiO3 + P4↑ + 10CO↑.
Фосфор выделяется в виде паров, которые конденсируются в приёмнике под водой, при этом образуется белый фосфор.
При нагревании до 250-300°С без доступа воздуха белый фосфор превращается в красный.
Чёрный фосфор получается при длительном нагревании белого фосфора при очень большом давлении (200°С и 1200 МПа).
1.5 ПрименениеКрасный фосфор применяется при изготовлении спичек (см. рисунок). Он входит в состав смеси, наносимой на боковую поверхность спичечного коробка. Основным компонентом состава головки спички является бертолетова соль KClO3. От трения головки спички о намазку коробка частицы фосфора на воздухе воспламеняются. В результате реакции окисления фосфора выделяется тепло, приводящее к разложению бертолетовой соли.
KClO3![]() KCl + .
KCl + .![]()
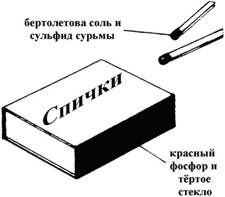
Образующийся кислород способствует воспламенению головки спички.
Фосфор используют в металлургии. Он применяется для получения проводников и входит в состав некоторых металлических материалов, например оловянных бронз.
Также фосфор используют при производстве фосфорной кислоты и ядохимикатов (дихлофос, хлорофос и др.).
Белый фосфор используют для создания дымовых завес, так как при его горении образуется белый дым.
Глава II. Соединения фосфора
Похожие работы
... алюминия. В нейтральных почвах, например в черноземах, минеральный фосфор представлен более доступными для растений фосфатами кальция и магния. 6.4. Геоэкологический мониторинг: определение фосфора в воде ОБЩИЙ ФОСФОР Соединения фосфора относятся к физиологически важным компонентам химического состава морских вод, определяющим их продуктивность. Существует много форм фосфорных соединений в ...
... пород, накопленных на дне геосинклиналей. Таким образом, замкнутый цикл осадочных элементов имеет продолжительность, измеряемую геологическими периодами, т.е. десятками и сотнями миллионов лет. Рассматривая круговорот фосфора в масштабе биосферы за сравнительно короткий период, можно отметить, что он полностью не замкнут. Действительно, происходит частичное поступление фосфора из океана на сушу, ...
... среды. 3.1 Урок по теме «Кальций и его соединения» в 9-ом классе с. Карасу, позволяющий развить экологическое сознание школьников Цель урока: познакомить учащихся с основными способами получения кальция и его соединений, возможностями применения соединений кальция, показать необходимость контроля содержания ионов кальция и магния в питьевых и сточных водах и обозначить значимость кальция ...
... разовая) – 0,01%. 4 Содержание Введение......................................................................................................................4 Глава 1. Межпредметные связи в курсе школьного предмета химии на примере углерода и его соединений.......................................................................5 1.1 Использование межпредметных связей для формирования у учащихся ...







0 комментариев