Навигация
2.1 Оксиды
Фосфор образует несколько оксидов. Важнейшими из них являются оксид фосфора (V) P4O10 и оксид фосфора (III) P4O6. Часто их формулы пишут в упрощённом виде – P2O5 и P2O3. В структуре этих оксидов сохраняется тетраэдрическое расположение атомов фосфора.
Оксид фосфора (III) P4O6 – воскообразная кристаллическая масса, плавящаяся при 22,5°С и превращающаяся при этом в бесцветную жидкость. Ядовит.
При растворении в холодной воде образует фосфористую кислоту:
P4O6 + 6H2O = 4H3PO3,
а при реакции со щелочами – соответствующие соли (фосфиты).
Сильный восстановитель. При взаимодействии с кислородом окисляется до Р4О10.
Оксид фосфора (III) получается окислением белого фосфора при недостатке кислорода.
Оксид фосфора (V) P4O10 – белый кристаллический порошок. Температура возгонки 36°С. Имеет несколько модификаций, одна из которых (так называемая летучая) имеет состав Р4О10. Кристаллическая решётка этой модификации слагается из молекул Р4О10, связанных между собой слабыми межмолекулярными силами, легко разрывающимися при нагревании. Отсюда и летучесть этой разновидности. Другие модификации полимерны. Они образованы бесконечными слоями тетраэдров РО4.
При взаимодействии Р4О10 с водой образуется фосфорная кислота:
P4O10 + 6H2O = 4H3PO4.
Будучи кислотным оксидом, Р4О10 вступает в реакции с основными оксидами и гидроксидами.
Образуется при высокотемпературном окислении фосфора в избытке кислорода (сухого воздуха).
Благодаря исключительной гигроскопичности оксид фосфора (V) используется в лабораторной и промышленной технике в качестве осушающего и дегидратируюшего средства. По своему осушающему действию он превосходит все остальные вещества. От безводной хлорной кислоты отнимает химически связанную воду с образованием её ангидрида:
4HClO4 + P4O10 = (HPO3)4 + 2Cl2O7.
2.2 Кислоты и их соли
а) Фосфористая кислота H3PO3. Безводная фосфористая кислота Н3РО3 образует кристаллы плотностью 1,65 г/см3, плавящиеся при 74°С.
Структурная формула:
![]() .
.
При нагревании безводной Н3РО3 происходит реакция диспропорционирования (самоокисления-самовосстановления):
4H3PO3 = PH3↑ + 3H3PO4.
Соли фосфористой кислоты – фосфиты. Например, K3PO3 (фосфит калия) или Mg3(PO3)2 (фосфит магния).
Фосфористую кислоту Н3РО3 получают растворением в воде оксида фосфора (III) или гидролизом хлорида фосфора (III) РCl3:
РCl3 + 3H2O = H3PO3 + 3HCl↑.
б) Фосфорная кислота (ортофосфорная кислота) H3PO4.
Безводная фосфорная кислота представляет собой светлые прозрачные кристаллы, при комнатной температуре расплывающиеся на воздухе. Температура плавления 42,35°С. С водой фосфорная кислота образует растворы любых концентраций.
Фосфорной кислоте соответствует следующая структурная формула:
![]() .
.
Фосфорная кислота реагирует с металлами, расположенными в ряду стандартных электродных потенциалов до водорода, с основными оксидами, с основаниями, с солями слабых кислот.
В лаборатории фосфорную кислоту получают окислением фосфора 30%-ной азотной кислотой:
3P + 5HNO3 + 2H2O = 3H3PO4 + 5NO↑.
В промышленности фосфорную кислоту получают двумя способами: экстракционным и термическим. В основе экстракционного метода лежит обработка измельченных природных фосфатов серной кислотой:
Ca3(PO4)2 + 3H2SO4 = 2H3PO4 + 3CaSO4↓.
Фосфорная кислота затем отфильтровывается и концентрируется упариванием.
Термический метод состоит в восстановлении природных фосфатов до свободного фосфора с последующим его сжиганием до Р4О10 и растворением последнего в воде. Производимая по данному методу фосфорная кислота характеризуется более высокой чистотой и повышенной концентрацией (до 80% массовых).
Фосфорную кислоту используют для производства удобрений, для приготовления реактивов, органических веществ, для создания защитных покрытий на металлах. Очищенная фосфорная кислота нужна для приготовления фармацевтических препаратов, кормовых концентратов.
Фосфорная кислота не является сильной кислотой. Как трёхосновная кислота, в водном растворе диссоциирует ступенчато. Легче идет диссоциация по первой ступени.
1. H3PO4![]() H+ +
H+ + ![]() (дигидрофосфат-ион);
(дигидрофосфат-ион);
2. ![]()
![]() H+ +
H+ + ![]() (гидрофосфат-ион);
(гидрофосфат-ион);
3. ![]()
![]() H+ +
H+ + ![]() (фосфат-ион).
(фосфат-ион).
Суммарное ионное уравнение диссоциации фосфорной кислоты:
H3PO4![]() 3H+ +
3H+ + ![]() .
.
Фосфорная кислота образует три ряда солей:
а) K3PO4, Ca3(PO4)2 – трёхзамещённые, или фосфаты;
б) K2HPO4, CaHPO4 – двухзамещённые, или гидрофосфаты;
в) KH2PO4, Ca(H2PO4)2 – однозамещённые, или дигидрофосфаты.
Однозамещенные фосфаты имеют кислую реакцию, двухзамещённые – слабощелочную, трехзамещённые – щелочную.
Все фосфаты щелочных металлов и аммония растворимы в воде. Из кальциевых солей фосфорной кислоты растворяется в воде лишь дигидрофосфат кальция. Гидрофосфат кальция и фосфат кальция растворимы в органических кислотах.
При нагревании фосфорная кислота вначале теряет воду – растворитель, затем начинается дегидратация фосфорной кислоты и образуется дифосфорная кислота:
2H3PO4 = H4P2O7 + H2O.
Значительная часть фосфорной кислоты превращается в дифосфорную при температуре около 260°С.
в) Фосфорноватая кислота (гипофосфорная кислота) H4P2O6.
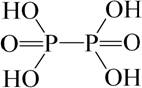 .
.
H4P2O6 – четырёхосновная кислота средней силы. При хранении гипофосфорная кислота постепенно разлагается. При нагревании её растворов превращается в Н3РО4 и Н3РО3.
Образуется при медленном окислении Н3РО3 на воздухе или окислении белого фосфора во влажном воздухе.
г) Фосфорноватистая кислота (гипофосфористая кислота) H3PO2. Эта кислота одноосновная, сильная. Фосфорноватистой кислоте соответствует следующая структурная формула:
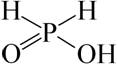 .
.
Гипофосфиты – соли фосфорноватистой кислоты – обычно хорошо растворимы в воде.
Гипофосфиты и Н3РО2 – энергичные восстановители (особенно в кислой среде). Их ценной особенностью является способность восстанавливать растворённые соли некоторых металлов (Ni, Cu и др.) до свободного металла:
2Ni2+ + ![]() + 2H2O → Ni0 +
+ 2H2O → Ni0 + ![]() + 6H+.
+ 6H+.
Получается фосфорноватистая кислота разложением гипофосфитов кальция или бария серной кислотой:
Ba(H2PO2)2 + H2SO4 = 2H3PO2 + BaSO4↓.
Гипофосфиты образуются при кипячении белого фосфора в суспензиях гидроксидов кальция или бария.
2P4 (белый) + 3Ba(OH)2 + 6H2O = 2PH3↑ + 3Ba(H2PO2)2.
Похожие работы
... алюминия. В нейтральных почвах, например в черноземах, минеральный фосфор представлен более доступными для растений фосфатами кальция и магния. 6.4. Геоэкологический мониторинг: определение фосфора в воде ОБЩИЙ ФОСФОР Соединения фосфора относятся к физиологически важным компонентам химического состава морских вод, определяющим их продуктивность. Существует много форм фосфорных соединений в ...
... пород, накопленных на дне геосинклиналей. Таким образом, замкнутый цикл осадочных элементов имеет продолжительность, измеряемую геологическими периодами, т.е. десятками и сотнями миллионов лет. Рассматривая круговорот фосфора в масштабе биосферы за сравнительно короткий период, можно отметить, что он полностью не замкнут. Действительно, происходит частичное поступление фосфора из океана на сушу, ...
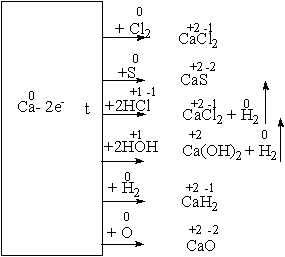
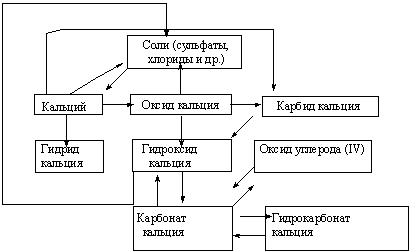
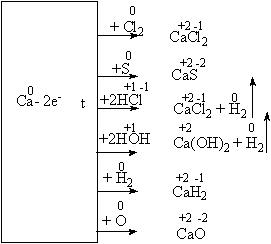
... среды. 3.1 Урок по теме «Кальций и его соединения» в 9-ом классе с. Карасу, позволяющий развить экологическое сознание школьников Цель урока: познакомить учащихся с основными способами получения кальция и его соединений, возможностями применения соединений кальция, показать необходимость контроля содержания ионов кальция и магния в питьевых и сточных водах и обозначить значимость кальция ...
... разовая) – 0,01%. 4 Содержание Введение......................................................................................................................4 Глава 1. Межпредметные связи в курсе школьного предмета химии на примере углерода и его соединений.......................................................................5 1.1 Использование межпредметных связей для формирования у учащихся ...







0 комментариев