Навигация
Урок-семинар по теме: «Природные источники углеводородов»
3.4 Урок-семинар по теме: «Природные источники углеводородов»
Урок рассчитан на 2 часа. Данный урок целесообразно проводить после изучения темы “Углеводороды”.
Цели урока:
Рассмотреть основные природные источники углеводородов, отрасли их использования: в качестве топлива и основы химического синтеза. На этом материале повторить, закрепить и обобщить полученные ранее знания о свойствах и применении важнейших углеводородов. Обучать самостоятельному поиску необходимой информации, умению делать выводы, развивать монологическую речь учащихся.
Предварительное задание:
Приблизительно за две недели до урока следует дать домашнее задание подготовить сообщения на следующие темы:
Природный газ.
Попутный газ.
Нефть.
Способы переработки нефти.
Каменный уголь.
Сообщение может быть выполнено как одним учеником, так и парой (по желанию).
План сообщений (кроме способов переработки нефти) следующий:
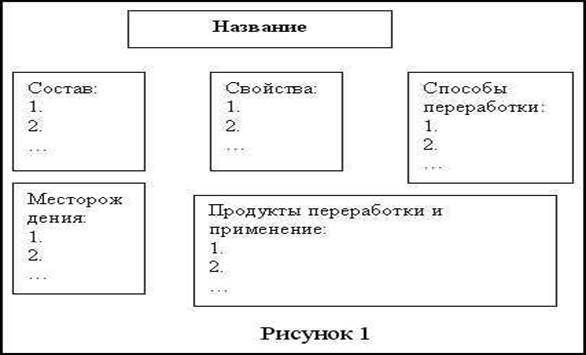
Состав.
Физические свойства.
Основные способы переработки.
Основные продукты переработки.
Области применения.
Материал по каждой теме должен быть оформлен в схемы, основа которой представлена на рис. 1. Схемы, составленные учащимися, проверяются заранее, вместе обсуждаются допущенные ошибки.
Пример схемы по попутному газу приведен на рис. 2.
Начинается урок с вступительного слова учителя. Мы подробно изучили состав, строение и свойства различных углеводородов. Сегодня на уроке мы познакомимся, где изученные нами вещества встречаются в природе и как они используются. Затем выступают учащиеся, приготовившие сообщения. Схемы демонстрируются либо с помощью кодоскопа либо проектора. Остальные ученики переписывают схемы в тетрадь.
После каждого выступления проводится краткое обсуждение по следующим вопросам:
Природный и попутный газы:
Какие химические свойства будут проявлять эти вещества? (Природный газ – в основном метан, значит свойства метана, попутный газ смесь более сложного состава- свойства тоже более разнообразны)
В чем преимущества природных газов как топлива? (высокая теплотворная способность (при сжигании 1 м3 природного газа выделяется до 54 400 кДж); дешевизна; экологическая чистота; легкая транспортировка по газопроводам).

Нефть:
Целесообразно ли использовать нефть в качестве топлива? Почему? (Нефть является смесью большого количества веществ, не только углеводородов, которые могут служить сырьем для производства большого количества важных продуктов).
Почему нефть в основном содержит алканы, циклоалканы и арены, но практически не содержит алкенов и алкинов? Привести уравнения реакций. (Алкены и алкины являются более химически активными, чем алканы и циклоалканы).
Какие продукты можно получить из нефти? (Различные виды топлив, сырье для органического синтеза)
В чем отличия бензинов, полученных термическим и каталитическим крекингом нефти? (Бензин, полученный термическим крекингом содержит много алкенов, углеводородов с неразветвленной цепью, поэтому малоустойчив, окисляется при хранении; бензин, полученный каталитическим крекингом содержит много углеводородов с разветвленной цепью, поэтому устойчив, не окисляется при хранении)
Каменный уголь:
Почему для коксохимического производства необходима высокая температура и отсутствие кислорода? (В присутствии кислорода будут протекать процессы горения и окисления)
Какие неорганические продукты получаются при коксовании угля? (аммиак, угарный газ, водород)
В конце урока учитель кратко подводит итоги и выставляет отметки, ученикам делавшим сообщения и участвовавшим в обсуждении [22].
3.5 Решение расчетных задач по теме «Углеводороды»
1) Рассчитайте массу тетрохлорида углерода, который можно получить при хлорировании метана объемом 11,2 л молекулярным хлором, объем которого в реакционной системе равен 56 л. Объемы газов приведены к нормальным условиям. Выход продукта составляет 70% от теоретически возможного.
Решение.
СН4 + 4Сl2 →CCl4 + 4HCl
Определяем количества исходных веществ:
n (СН4)= V(СН4)/Vm; n (СН4)=11,2/22,4=0,5 моль;
n (Сl2)=V(Сl2)/ Vm; n (Сl2)=56/22,4=2,5 моль;
n (СН4): n (Сl2)= 0,5:2,5=1:5.
следовательно, хлор взят в избытке.
Из уравнения реакции следует:
n (ССl4)= n (СН4); n (ССl4)=0,5 моль.
m (ССl4)= n (ССl4)* M (ССl4); m (ССl4)=77 г.
Учитывая, что выход продукта составляет 70% от теоретически возможного, находим массу полученного ССl4:
mр (ССl4)= m (ССl4)*η/ 100; mр (ССl4)=53,9 г.
2) Смесь метана и этилена объемом 400 мл (н.у.) обесцветила бромную воду массовой долей брома 3,2% массой т40 г. Определите объемную долю этилена в смеси.
Решение.
С2Н4 + Вr2 → С2Н4Вr2
m (Вr2)= m*ω (Вr2) ; m (Вr2)=1,28 г;
n (Вr2)= m (Вr2)/M (Вr2); n (Вr2)=0,008 моль.
Из уравнения реакции следует:
n (С2Н4)= n (Вr2); n (С2Н4)=0,008 моль.
V (С2Н4) = n (С2Н4)* Vm; V (С2Н4) =179,2 мл.
Определяем объемную долю этилена в смеси:
φ (С2Н4) = V (С2Н4) /V (смеси); φ (С2Н4) =0,448 или 44,8%.
3) При сжигании гомолога бензола массой 0,92 г в кислороде получили оксид углерода, который пропустили через избыток раствора гидроксида кальция. При этом образовался осадок массой 7 г. Определите формулу углеводорода и назовите его [23].
Решение.
Са(ОН)2 + СО2= СаСО3 + Н2О
n (СаСО3)=m (СаСО3)/ M (СаСО3); n (СаСО3)=0,07 моль.
n (СО2)= n (СаСО3); n (СО2)=0,07 моль.
n (С)= n (СО2); n (С)= 0,07 моль.
m (C)= n (C)*M (C) ; m (C)=0,84 г.
n (Н)=m (Н)/ M (Н); n (Н)=0,08 моль.
n (C)/ n (H)= 0,875.
Отсюда получаем: х=7, т.е. формула С7Н8.
3.6 Тесты с экологическим содержанием
1. Вещества, которые, поступая в окружающую среду, не сразу включается или вообще не включаются в естественную циркуляцию, называются:
a) пестицидами
b) загрязнителями
c) минеральными удобрениями
d) бытовыми отходами
2. ТЕРАТОГЕНЫ – это
a) вещества, воздействие которых на организм приводит к аномалиям его развития
b) процессы, приводящие к образованию антропогенных форм рельефа
c) процессы, воздействующие на развитие теориофауны данной области
3. В процессе индивидуального развития организма наиболее губительным фактором для материальных основ наследственности является
a) резкое температурное воздействие
b) избыток солнечного излучения
c) нарушение режима питания
d) систематическое употребление алкоголя
4. Процесс нарушения структуры одного из важнейших органических соединений клетки, происходящий под влиянием физических и химических факторов, - это
a) полимеризация глюкозы
b) удвоение ДНК
c) денатурация белка
d) окисление жира
5. Изучением взаимосвязи живого мира с физическими, химическими, биологическими факторами окружающей среды занимается
a) палеонтология
b) генетика
c) экология
d) цитология
6. Количество находящегося в окружающей среде вредного вещества, которое не оказывает отрицательного воздействия на здоровье человека при постоянном или временном контакте с ним, называют
a) предельно допустимым выбросом
b) предельно допустимой концентрацией
c) промышленным выбросом
d) залповым выбросом
7. Загрязнение воздуха, почвы, воды
a) вызывает у людей множество заболеваний
b) не влияет на здоровье людей
c) благоприятно сказывается на состоянии здоровья людей
d) не исследуется
8. Отходы производства нужно
a) использовать в качестве сырья для другого производства
b) выбрасывать в атмосферу, водоем, почву
c) сжигать
d) захоронить [24]
9. Основное промышленное сырье для получения синтез – газа и водорода:
a) СН4 ;
b) этан;
c) пропан;
d) бутан.
10.Синтез – газ – это:
a) смесь водорода и СО2 ;
b) смесь СО и Н2 ;
c) смесь метана и пропана;
d) СО2.
11. Метаболизм метанола в организме человека протекает по следующей схеме:
a) СН3ОН→НСНО→НСООН→НСОО-Н+→СО2 ;
b) НСНО→НСООН→НСОО-Н+→СО2 ;
c) СН3ОН→НСНО→НСОО-Н+→СО2 ;
d) СН3ОН→НСОО-Н+→СО2 .
12. К парниковым газам относят:
a) SO2 и N2O;
b) H2 и Cl2;
c) СО2 и СН4 ;
d) все перечисленные газы [25].
13. Кислотные дожди образуются в результате взаимодействия:
a) паров воды с оксидами серы;
b) углекислого газа и паров воды;
c) оксидов азота и серы;
d) оксидов серы и атомарного кислорода.
14. Озоновый слой атмосферы защищает поверхность Земли от:
a) избыточного освещения;
b) вредных ультрафиолетовых лучей;
c) радиации;
d) пыли.
15. Накопление в атмосфере углекислого газа в результате антропогенного воздействия может вызвать:
a) образование озоновых дыр;
b) климатические сдвиги, например, парниковый эффект;
c) усиление образования органических веществ фотосинтезирующими организмами;
d) образование ископаемых форм углерода: угля, нефти и природного газа.
16. К антропогенным факторам окружающей среды относятся:
a) соленость воды, минеральный состав почвы и газообразный состав атмосферы;
b) растительный опад, останки погибших животных и минеральный состав почвы;
c) гибель растений и животных от инфекций, вызванных микроорганизмами;
d) загрязнение почвы, воздуха и воды промышленными отходами.
17. Эвтрофикация – это:
a) повышение в воде содержания кислорода;
b) повышение в воде содержания неорганических веществ;
c) понижение в воде содержания кислорода и повышение в воде содержания органических веществ;
18. К мероприятиям по охране природы не относятся:
a) красные книги;
b) экологический мониторинг;
c) расходование природных ресурсов;
d) памятники природы.
19. Вещества, вызывающие разрушение озонового защитного слоя:
a) оксиды азота;
b) фреоны;
c) летучие органические соединения;
d) соединения серы.
20. Радиоактивное загрязнение связано:
a) с авариями на АЭС;
b) с авариями на ГЭС;
c) имеют природное происхождение;
d) с использованием пестицидов.
3.7 Обобщение полученных результатов и выводы
Эксперимент проводился в школе №6 г. Тырныауз в 10 «А» и 10 «Б» классах примерно с одинаковой успеваемостью (таблица 2).
Сравнительная характеристика учащихся 10 «А» и 10 «Б» классов до проведения эксперимента
| Класс | Количество учащихся | Успеваемость |
| 10 «А» | 22 | 2 - отличника; 14 – хорошистов; 4 – учатся удовлетворительно; 2 – не успевающих. |
| 10 «Б» | 18 | 3 - отличника; 10 – хорошистов; 3 – учатся удовлетворительно; 2 – не успевающих. |
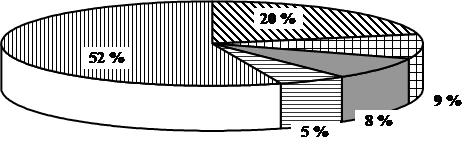
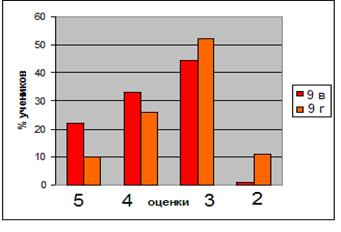
Выборочная совокупность 38 человек. Контрольная выборка - 10 «А» класс – 20 человек, экспериментальная выборка - 10 «Б» - 18. После проведения ряда уроков были организованы две контрольные работы: в виде тестов в 10 «Б» классе и традиционная форма контрольной работы в 10 «А» классе (см. приложение). По результатам данных составлена диаграмма сравнения успеваемости учащихся в параллельных классах (рисунок 1)
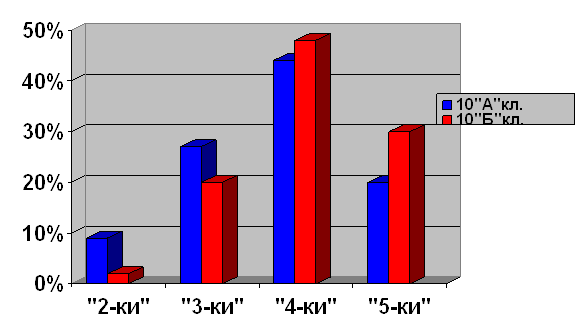
Рисунок 1. Сравнительная характеристика успеваемости учащихся в параллельных классах
Диаграмма показывает, что введение тестового контроля знаний в сочетании с устным опросом дает больше положительных результатов по сравнению с традиционной письменной формой проверки знаний учащихся.
Исходя из результатов проведенной работы перечислим основные достоинства и недостатка тестового контроля знаний.
Достоинства:
· большая объективность и, как следствие, большее позитивное стимулирующее воздействие на познавательную деятельность учащегося;
· исключается воздействие негативного влияния на результаты тестирования таких факторов как настроение, уровень квалификации и др. характеристики конкретного преподавателя [26];
· ориентированность на современные технические средства на использование в среде компьютерных (автоматизированных) обучающих систем;
· универсальность, охват всех стадий процесса обучения;
· тестированный опрос многофункционален. Он позволяет быстрее понять, как дальше работать с данным учеником.
Главное достоинство тестовой проверки в скорости, а традиционной проверки посредством дидактических материалов - в ее основательности.
Недостатки тестового метода контроля знаний учащихся:
· составление тестов - большая кропотливая работа;
· субъективизм в формировании содержания самих тестов, в отборе и формулировке тестовых вопросов;
· недостатком является то, что результаты своей работы учащийся представляет только номера ответа, тут учитель не видит характера хода решения – мыслительная деятельность учащегося и результат может быть только вероятностным.
· возможность угадывания. Если, например, тестовое задание содержит только два ответа, один из которых правильный, то половину ответов на такие тестовые задания можно угадать.
Но не смотря на указанные недостатки тестирования, как метода педагогического контроля, его положительные качества во многом говорят о целесообразности использования такой технологии в курсе изучения химии.
В итоге следует заметить, что использование с 10 класса тестирования учащихся поможет объективно провести аттестацию школы, которая проводится с целью установления соответствия содержания, уровня и качества подготовки учащихся требованиям государственных образовательных программ [27]. Систематическое проведение контрольных мероприятий с помощью составленных на высшем уровне инструментов контроля позволяет школам формировать подготовленных учеников в различных областях знаний, готовых применять накопленный багаж знаний в любую минуту. Именно в таких выпускниках и в настоящее время, и в будущем нуждается наша страна, чтобы с их помощью провести быстрое оздоровление экономики.
СПИСОК ИСПОЛЬЗОВАННОЙ ЛИТЕРАТУРЫ
1. Иванова Р.Г., Осокина Г.Н. Изучение химии в 9-10 классах. М.: Просвещение,1983.- 250 c.
2. Амирова А.Х. Обобщение знаний по курсу органической химии.// Химия в школе.-2007.-№4,с 19 – 22
3. Рудзитис Г.Е., Фельдман Р.Г. Химия: Органическая химия: Учебник для 10 класса общеобразовательных учреждений. М.: Просвещение,1995.- 160 с.
4. Кузнецова Н.Е., Титова И.М., Гара Н.Н. Химия: Учебник для учащихся 10 класса общеобразовательных учреждений. – М.: Вентана-Граф, 2007. – 384 с.
5. Аллахвердиева Д.Т. Опыт применения тестов для дидактической экспертизы обучения //Высшее образование в России. №2, 1993. с 102-104.
6. Кошелева Е.А. ЕГЭ и авторские тестовые задания.// Химия в школе.2007.-№8, с 19 - 25
7. Иванова Н.П. Тесты, тесты, тесты… //Приложение к газете «1 сентября».
Математика.1999, №2, с 21-23
8. Щапов А., Тихомирова Н., Ершиков С., Лобова Т. Тестовый контроль в системе рейтинга//Высшее образование в России. 1995. №3, c 100-102.
9. Хубаев Г.Н. О построении шкалы оценок в системах тестирования.// Высшее образование в России. 1996. №1, с 122 – 125
10. Хамитова А.И., Хабибуллина А.Б. ЕГЭ по химии как объективная реальность.// Химия в школе.2007.-№5, с 16 – 18
11. Котляров О.С. Контроль результатов обучения химии.// Химия: приложение к газете «1 сентября».2006.-№24, с 10 – 13
12. Крейнин Е.В., Евергетидова А.С. Глобальный климат: причинно – следственные связи, Киотский протокол и технические решения.// ЭКиП. 2007.май, с 43 – 45
13. Карасевич А.М., Крейнин Е.В. Эколого-энергетические проблемы газового топлива. М.: Страховое ревю, 2004. – 215 с.
14. Новиков Ю.В. Экология, окружающая среда и человек. М.: ФАИР-ПРЕСС, 2000. -320 с.
15. Никоноров А.М., Хоружая Г.А. Глобальная экология. М.: Издательство ПРИОР, 2000. – 284 с.
16. Демина Г.А. Экология, природопользование. Охрана окружающей среды. М.: Аспект – пресс, 1998. - 193 с.
17. Подольский И.И., Булкатов А.Н., Петровская Л.К. Метанол как источник энергии. Проблемы безопасности использования.// ЭКиП. 2007. ноябрь, с 28 – 29
18. Караваев М.М. Технология синтетического метанола. М.: Химия, 1984. -278 с
19. Росляков А.Д., Бурлий В.В. Анализ технологий очистки углеводородного сырья от сернистых соединений.// ЭКиП.2007. февраль, с 42 – 44
20. Горковенко М.Ю. Поурочные разработки по химии. – М.: ВАКО, 2008.-320с.
21. Давыдова Г.Е. К изучению экологических проблем в курсе органической химии.// Химия в школе.2007.-№1, с 15 – 19
22. Габрилиан О.С., Остроумов И.Г. Химия. 10 класс: Настольная книга учителя. М.: Дрофа, 2004. – 480 c.
23. Хомченко Г.П., Хомченко И.Г. Сборник задач по химии. М.: Новая волна, 2003. – 278 с.
24. Скворцов П.М., Никишов А.И., Рохлов В.С., Теремов А.В. Биология 6 – 11 классы. – М.: АСТ – ПРЕСС, 2000. – 535 с.
25. Горбунцова С.В. Тесты и ЕГЭ по основным разделам школьного курса. – М.: ВАКО, 2006. -160 с.
26. В.А. Попов. Размышление учителя над итогами тестирования //Математика в школе. 2000.- №3, с 45-47
27. Чернобельская Г.М. Методика обучения химии в средней школе. Учебник для студентов высших учебных заведений. М.: ВЛАДОС, 2000. – 156 с.
28. Сорокин В.В., Злотников Э.Г. Химия в тестах: Пособие для школьников и абитуриентов. СПб.: Химия, 1996. – 115 с.
29. Мамедов Н.М. Устойчивое развитие и экологизация школьного образования. М.: Просвещение, 2003. – 125 с.
30. Коверина А.А., Добротин Д.Ю. Учебно - тренировочные материалы для подготовки к единому государственному экзамену. Химия. М.: Интеллект – Центр, 2004. – 85 с.
Приложение
Контрольная работа
Вариант 1.
1) Охарактеризовать по приведенной ниже схеме непредельные углеводороды ряда этилена: сформулировать определение алкенов, дать общую формулу гомологического ряда, указать тип гибридизации, описать их физические и химические свойства.
2) Осуществить цепочку превращений:
циклогексан → бензол → нитробензол → анилин
↓
бромбензол
Указать тип химических реакций, условия их проведения.
3) Массовая доля углерода в алкане равна 83,72 %. Определите молекулярную формулу вещества, составьте структурную формулу изомера данного УВ, содержащего четвертичный атом углерода и назовите его по международной номенклатуре.
Вариант 2.
1) Охарактеризовать по приведенной ниже схеме непредельные углеводороды ряда ацетилена: сформулировать определение алкинов, дать общую формулу гомологического ряда, указать тип гибридизации, описать их физические и химические свойства.
2) Осуществить цепочку превращений:
Этан → этилен→этанол → бутадиен-1,3→ полибутадиен.
Указать тип химических реакций, условия их проведения.
3) Какой объем воздуха (н.у.) потребуется для полного сгорания 210 г пентена? Составить структурные формулы изомеров данного УВ с третичным атомом С и двойной связью при нем, дать название по систематической номенклатуре.
Вариант 3.
1) Охарактеризовать по приведенной ниже схеме арены: сформулировать определение ароматических углеводородов, дать общую формулу гомологического ряда, указать тип гибридизации, описать их физические и химические свойства.
2) Осуществите цепочку превращений:
СН4→ С2Н2→ СН2 = СНBr → СН3 – СН2Br → С4H10
Указать тип химических реакций, условия их проведения. Дать названия соединениям.
3) При сгорании углеводорода массой 4 г образовалось 6,72 л углекислого газа и 3,6 г воды. Определите структурную формулу УВ, если известно, что он взаимодействует с аммиачным раствором оксида серебра.
Ответы:
Вариант 1
№2. 1) С6Н12 → С6Н6 + 3Н2 (дегидрирование)
2) С6Н6 + НО – NO2→ С6Н5 NO2 + H2O(нитрование)
3) С6Н5 NO2 → С6Н5 NН2 +2H2O (восстоновление)
4) С6Н6 +Br2 → С6Н5 Br+ HBr(бромирование)
№3: С6Н14 (изомер – 2,2-диметилбутан)
Вариант 2
№2: 1) С2Н6 →СН2 = СН2 + Н2 (дегидрирование)
2) СН2 = СН2 + Н2О →СН3 - СН2 ОН (гидратация)
3) 2 СН3 - СН2 ОН→СН2 = СН -СН = СН2 + 2Н2О + Н2 (дегидрирование и дегидратация)
4) nСН2 = СН -СН = СН2 → ( - СН2 - СН =СН - СН2 -)n(полимеризация)
№3: 2 С5Н10 +15O2 →10СO2 + 10Н2О (изомеры – 2-метилбутен-2 и 2-метилбутен-1)
Вариант 3
№2: 1) 2СН4 →С2Н2 + 3Н2 (пиролиз метана)
2) НС ≡ СН + НBr→СН2 = СНBr (присоединение)
3) СН2 = СНBr + Н2 →СН3 – СН2 Br(гидрирование)
4)2 СН3 – СН2 Br +2 Na → С4Н10 + 2 NaBr(синтез Вюрца)
№3: Эмпирическая формула вещества – С3Н4
Тестовая контрольная работа.
Вариант 1
1. Алкадиены имеют общую формулу:
а) CnH2n+2 ;
б) CnH2n ;
в) CnH2n-2;
г) CnH2n-6.
2. Изомерами являются:
а) гексен и циклогексан
б) бутен и бутилен
в) метибензол и метилбутан
г) пентан и пентин
3. Гомологами являются:
а) 3-метилпентан и гексан
б) октен и октадиен
в) бутин и ацетилен
г) гептан и бромгептан
4. sp-гибридный атом углерода присутствует в молекуле
а) бутадиена-1,3
б) пропина
в) гексена
г) метана
5. Для алкинов характерна изомерия:
а) геометрическая
б) положения заместителя
в) углеродного скелета
г) положение функциональной групп
6. Формула алкана
а) СН4
б) С2Н4
в) С8Н10
г) С4Н6
7. В реакцию дегидрирования способен вступать
а) бензол
б) этин
в) бутан
г) циклогексан
8. Предельные УВ вступают в реакции
а) присоединения
б) гидратации
в) горения
г) замещения
Вариант 2
1. Циклоалканы имеют общую формулу:
а) CnH2n+2 ;
б) CnH2n ;
в) CnH2n-2 ;
г) CnH2n-6.
2. Изомерами являются:
а) орто-бромтолуол и пара-бромтолуол
б) циклооктан и этилбензол
в) бутин и бутадиен
г) метан и этан
3. Гомологами являются
а) гептен и этилен
б) толуол и ксилол
в) 2-метилбутен-1 и 2,2-диметилбутан
г) циклобутан и бутан
4. Тройная связь существует в молекулах
а) алкадиенов
б) аренов
в) алкинов
г) циклоалканов
5. Гексен-2 и гексен-3 являются примерами изомерии:
а) геометрической
б) положением заместителя
в) углеродного скелета
г) положения кратной связи
6. Формула алкадиена
а) С7Н12
б) С7Н14
в) С7Н16
г) С4Н10
7. Ацетилен можно получить из
а) бензола
б) метана
в) бутина
г) карбида кальция
8. Основную часть нефти составляют
а) алкины
б) алкены
в) алкадиены
г) алканы
Вариант 3
1. Арены имеют общую формулу
а) CnH2n+2 ;
б) CnH2n ;
в) CnH2n-2 ;
г) CnH2n-6.
2. Изомерами являются
а) 2-этилгексан и октан
б) пропин и пропен
в) ксилол и толуол
г) пентен и циклопентен
3. Гомологами являются
а) октан и циклоактан
б) гептен и циклогептен
в) бромэтан и бромэтен
г) ацетилен и гексин
4. Водный раствор перманганата калия обесцвечивает
а) метан
б) циклопентан
в) пентен
г) пентин
5. Цис- и транс-пентен-2 являются примерами изомерии
а) положение кратной связи
б) геометрической
в) углеродного скелета
г) положения функциональной группы
6. Четвертичный атом углерода находится в молекуле
а) 2,2-диметилбутана
б) 2-метилпропена
в) 2,3-диметилбутана
г) этилбензола
7. Основной источник промышленного получения бензола –
а) природный газ
б) каменный уголь
в) попутный нефтяной газ
г) нефть
8. По реакции Кучерова получают
а) спирт
б) альдегид
в) галогенпроизводные углеводородов
г) анилин. [20]
Похожие работы
... весь цилиндр. Это опыт демонстрирует одну из биологических функций железа. По химической природе, каталаза – геминовый фермент, содержащий железо. [3] 2. Разработка темы «Основания» в курсе неорганической и органической химии 2.1 Урок по теме «Основания» Цели урока: познакомить учащихся с новым классом химических соединений – основаниями, их свойствами (отношение к воде, действие на ...
... период многие страны приняли решение о полном или постепенном отказе от развития атомной энергетики. 1.3 Особенности альтернативной водородной энергетики Водородная энергетика включает следующие основные направления: Разработка эффективных методов и процессов крупномасштабного получения дешевого водорода из метана и сероводородсодержащего природного газа, а также на базе разложения воды; ...
... разовая) – 0,01%. 4 Содержание Введение......................................................................................................................4 Глава 1. Межпредметные связи в курсе школьного предмета химии на примере углерода и его соединений.......................................................................5 1.1 Использование межпредметных связей для формирования у учащихся ...
... и закрепление знаний учащихся; - умение наблюдать химические явления; - развитие интеллектуальных способностей и формирование абстрактного мышления. [4] 3. Дидактические подходы при изучении темы «Молекулярные перегруппировки» Дидактика – область педагогики, разрабатывающая общую теорию образования и обучения и занимающаяся содержанием образования, закономерностями процесса обучения, ...






0 комментариев