Навигация
Технічна термодинаміка та теплові процеси технології будівельних матеріалів
Міністерство освіти і науки України
Національний університет водного господарства і природокористування
В.Л. Шестаков
Задачі та вправи з технічної термодинаміки та теплових
процесів технології будівельних матеріалів
Навчальний посібник
Рекомендовано
Рівне - 2006
УДК 536.7: 621.036; 666.9.013
ББК 38.626.2 - 5873
Ш 52
Рекомендовано
Відповідальний редактор:
Рецензенти:
В.Л. Шестаков
Задачі та вправи з технічної термодинаміки та теплових процесів технології будівельних матеріалів. Навчальний посібник. - Рівне: НУВГП, 2006
ISBN 966-7447-99-5
Даний посібник призначений для студентів, які вивчають "Термодинаміка" та "Технологічне обладнання підприємств з виробництва будівельних матеріалів і виробів" за спеціальністю "" Технологія будівельних конструкцій, виробів і матеріалів. Посібник може бути використаний для теплотехнічних розрахунків в курсовому та дипломному проектуванні теплових агрегатів і технологічних ліній з виготовлення будівельних матеріалів, виробів і конструкцій.
Для студентів спеціальностей будівельного профілю, також хіміко-технологічних спеціальностей виробництва силікатних будівельних матеріалів.
ISBN 966-7447-99-5
УДК 536.7: 621.036; 666.9.013
ББК 38.626.2 - 5873
В.Л. Шестаков, 2006
НУВГП, 2006
Зміст
Зміст
Передмова
І. Термодинаміка
1.1 Параметри стану робочих тіл (газ, пара) визначаються температурою t, тиском Р, об’ємом V і питомим об’ємом W
1.2 Рівняння стану
1.3 Теплоємність газів. Змішування.
1.4 Аналітичний вираз І законуну термодинаміки має вигляд:
1.5 Процес підведення або відбирання теплоти
1.6 Ентропія згідно із ІІ законом термодинаміки для обернених процесів складає
1.7 Круговий процес або цикл
2. Теплопередача
2.1 Теплопровідність у стаціонарному режимі при сталій температурі
2.2 Нестаціонарномий режим
2.3 Конвективний теплообмін
2.4 Випромінювання газової фази
2.5 Фізичні властивості водяної пари
ІІ. Завдання до самостійної роботи
Задачі
Додатки - таблиці
Передмова
Посібник містить в кожному розділі теоретичні посилання, приклади розв’язання задач і вправ, також перелік задач, вправ і тестів для самостійної роботи студентів і самоконтролю знань з технічної термодинаміки і теплотехніки.
В розділі 1 розглядаються теоретичні і практичні питання з технічної термодинаміки, в розділі 2-3 теплопередачі; розділ 3 присвячений розрахункам горіння палива, розділ 4 - розрахункам газодинамічного тракту руху гріючих газів, розділ 5 - теплообміну в теплових апаратах (печі, сушили, установки тепловологісної обробки) виробництва будівельних матеріалів і виробів.
Посібник включає необхідні графічні матеріали, таблиці за текстом та значний табличний матеріал в додатках про необхідні теплофізичні характеристики основних газів, повітря, водяної пари, основних видів палива родовищ України, характеристики місцевих опорів руху повітря тощо.
Приклади розрахунків в значній мірі адаптовані до теплотехнічних апаратів промисловості будівельних матеріалів та теплових ситуацій, що в них виникають.
Задачі і вправи базуються на сучасних технологіях теплової обробки матеріалів з використанням галузевого досвіду з виготовлення цементу, будівельної кераміки, залізобетону та ін.
Посібник може бути використаним для проведення теплотехнічних розрахунків в курсовому і дипломному проектуванні теплових агрегатів, комплектуючих технологічні лінії з виготовлення будівельних матеріалів, виробів і конструкцій.
І. Термодинаміка
Основні теоретичні положення. Приклади розв'язання задач з термодинаміки.
1.1 Параметри стану робочих тіл (газ, пара) визначаються температурою t, тиском Р, об’ємом V і питомим об’ємом WАбсолютний тиск в котлах складає: Рабс = Рман+В, у вакуумних установках - Рабс = В - Рман, де Рабс, Рман - показники тиску за показанням манометра або вакуумметра, В - атмосферний (барометричний) тиск.
Приведений показник ртутного барометра (до 00С) складає: В0=В (1-0,000172t), (1.1)
В - дійсне показання барометра при температурі t0С, 0,000172 - коефіцієнт об'ємного розширення ртуті.
Приклад 1-1. Визначити абсолютний тиск пари в котлі, якщо манометр показує Р=0,13 МПа, а атмосферний тиск по ртутному барометру складає В=680мм рт. ст. (90660Па) при t=250С.
Рабс = РМАН+В.
Показання барометра, приведене до 00С, складає
В0 = В (1-0,000172t) = 99660 (1-0,000172∙25) = 90270 Па.
Тоді абсолютний тиск пари в котлі
Рабс = 0,13 + 0,09 = 0,22 МПа.
Приклад 1-2. Тиск у паровому котлі Р = 0,04 МПа при барометричному тиску Во1 = 96660 Па (725 мм рт. ст). Чому дорівнює надлишковий тиск в котлі, якщо показання барометра підвищаться до В02 = 104660 Па (785 мм рт. ст), а стан пари залишиться таким, як був. Барометричний тиск приведений до 00С.
Абсолютний тиск в котлі
Рабс = 40000 + 96660 = 136660 Па.
Надлишковий тиск
Рнад = 136660 - 104660 = 0,032 МПа.
1.2 Рівняння стануЯкщо температура газу є сталою (T-const), то згідно закону Бойля-Маріотта РV = const.
Якщо тиск газу є сталим (Р = const), згідно закону Гей-Люссана ![]() або
або ![]()
Для газів, які мають однакову температуру і тиск, на основі закону Авогардо ![]() (тут М - молекулярна маса газу), або MV = const.
(тут М - молекулярна маса газу), або MV = const.
Нормальні умови відповідають тиску Р = 101325 Па, Т = 273,15 К (760 мм рт. ст., 00С). Об’єм 1 кмоля ідеальних газів = 22,4136![]() . Звідси
. Звідси ![]() н = М/22,4, кг/м3, а
н = М/22,4, кг/м3, а ![]() = 22,4/М, м3/кг.
= 22,4/М, м3/кг.
Характеристичне рівняння ідеального газу:
![]() , або PV = MRT (1.2)
, або PV = MRT (1.2)
Де R - газова стала, V - об’єм, M - маса газу.
Газова стала відносно 1 кг газу складає: ![]() . Дж ⁄ (кг/∙K)
. Дж ⁄ (кг/∙K)
Виходячи із характеристичного рівняння дійсним є
![]()
Приклад 1-3. Тиск газу за показанням манометра складає 0,3 МПа при температурі 60 0С, об’єм газу 2,5 м3. Визначити об’єм газу для нормальних умов.
Виходячи із рівняння ![]() визначаємо V0:
визначаємо V0:
![]() ,
,
Р0 = 760 мм рт. ст. (0,101МПа). Рнад = 0,3 + 0,101 = 0,401 МПа.
![]() нм3
нм3
Іноді технічні розрахунки спрощують, якщо тиск газу мало відрізняється від атмосферного:
V0 = V![]() .
.
Приклад 1-4. Суміш газів має об'ємний склад (%): СО2 - 12, N2 - 74, H2O - 6, О2 - 7, СО - 1. Тиск суміші 0,1 МПа (750 мм рт. ст) Визначити молекулярну масу, газову сталу, густину суміші при температурі 10000С і парціальний тиск окремих газів.
1) 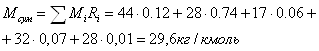
2) ![]()
3) із рівняння стану для 1 кг газу
Pv = RT, або ![]() звідси
звідси ![]()
![]()
![]()
4) Рі = Р∙аі (тут аі - об'ємна частка газу)
Р CO2 = 0.1∙0.12 = 0.012 МПа = 12 кПа,
Р N2 = 0.1∙0.74 = 0.074 МПа = 74 кПа,
Р Н2О = 0,1∙0,06 = 0,006 МПа = 6кПа,
Р О2 = 0,1∙0,07 = 0,007 МПа = 7кПа,
Р СО = 0,1∙0,01 = 0,001 МПа = 1 кПа.
Приклад 1-5. Балон із киснем ємністю 20 л перебуває під тиском 10 МПа при 150С. Після витрати частини кисню тиск знизився до 7,6 МПа, а температура впала до 100С. Визначити масу витраченого кисню.
Із характеристичного рівняння (1.2)
![]() . Перед витратами маса кисню була
. Перед витратами маса кисню була 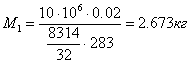 , а після витрат
, а після витрат ![]() .
.
Витрати кисню склали 2,673 - 2,067 = 0,606 кг.
Приклад 1-6. Посудина ємністю V = 10 м3 заповнена 25 кг СО2. Визначити абсолютний тиск в посудині, якщо t = 270C.
Із характеристичного рівняння
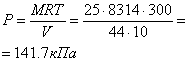
Приклад 1-7. Атмосферне повітря має наступний масовий склад: mo2 = 23.2%, mN2 = 76.8%. Визначити об'ємний склад повітря, його газову сталу уявну молекулярну масу, парціальний тиск О2 і N2, якщо тиск повітря (барометричний) В = 101325 Па.
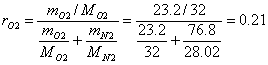
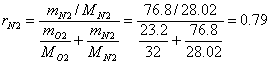
![]()
Уявна молекулярна маса
Мсум = rO2 MO2 + rN2MN2 = 0.21∙32 + 0.79∙28.02 = 28.9, або
![]() , звідки
, звідки ![]() .
.
Парціальний тиск РО2 = rО2∙Р = 0,21∙101325 = 21278 Па,
РN2 = rN2∙Р = 0,79∙101325 = 80047 Па.
1.3 Теплоємність газів. ЗмішуванняРозрізняють мольну теплоємність М∙С ![]() , масову теплоємність С
, масову теплоємність С ![]() , об'ємну теплоємність C'
, об'ємну теплоємність C' ![]() .
.
Масова теплоємність ![]() , об'ємна С' =
, об'ємна С' = ![]() .
.
С' = С![]() (
(![]() - густина газу в нормальних умовах)
- густина газу в нормальних умовах)
Середня теплоємність в межах t1... t2 дорівнює:
Ст = q/ (t2 - t1), а дійсна (істинна) теплоємність
![]() ,
,
тут q - кількість тепла, переданого до одиниці кількості газу.
Між мольною теплоємністю при Р = const і при V = const є зв’язок: МСР - МСV = МR = 8.314 кДж/ (кмоль*К), а СР /СV = К (для одноатомних газів К = 1,67; для двоатомних К = 1,4; для трьохатомних і багатоатомних К = 1,29). Залежність теплоємності від температури є нелінійною:
C = a + bt + dt2, (1.3)
де a, b, d - константи для кожного газу. В розрахунках часто нелінійну залежність заміняють близькою до неї лінійною:
C = a + bt,
а середня теплоємність при зміні температури від t1 до t2 складає:
![]()
В табл. .1.1 наведені формули для підрахунку середніх значень масової та об'ємної теплоємності газів за лінійним законом зміни температури.
Таблиця 1.1 Середня масова та об'ємна теплоємність газів (лінійна залежність)
| Газ | Теплоємність за масою, кДж/ (кг∙K) | Об'ємна теплоємність, кДж/ (кг∙K) |
| О2 | Сpm = 0.9203 + 0.0001065t CVm = 0.6603 + 0.0001065t | Сpm = 1.3188 + 0.00001577t CVm = 0.9429 + 0.0001577t |
| N2 | Сpm = 1.024 + 0.00008855t CVm = 0.7272 + 0.00008855t | Сpm = 1.2799 + 0.0001107t CVm = 0.9089 + 0.0001107t |
| Повіт-ря | Сpm = 0.9956 + 0.00009299t CVm = 0.7088 + 0.00008855t | Сpm = 1.2866 + 0.0001201t CVm = 0.9157 + 0.0001201t |
| Н2О | Сpm = 1.833 + 0.0003111t CVm = 1.3716 + 0.0003111t | Сpm = 1.4733 + 0.0002498t CVm = 1.1024 + 0.0002498t |
| СО2 | Сpm = 0.8654 + 0.0002443t CVm = 0.6764 + 0.0002443t | Сpm = 1.699 + 0.0004798t CVm = 1.3281 + 0.0004798t |
Приклад 1-8. Визначити середню теплоємність Сpm повітря при Р = const в межах 200...8000С, виходячи із нелінійної залежності теплоємності від температури.
Кількість теплоти, яка передається від t1 до t2 складає:
qp = Cpm2∙t2 - Cpm1∙t1, a
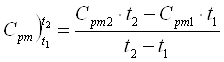
![]()
Табульовані значення теплоємності (табл. Д4, табл. ХІІ 4)
![]()
![]() , тоді
, тоді
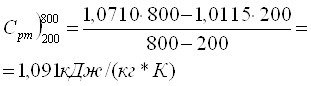
При змішуванні газів, які не реагують хімічно, мають різні температури та тиск, розрізняють 2 випадки:
1 - змішування при V = const (сумарний об’єм газів перед і після змішування). Параметри стану визначаються за формулами:
 (1.4)
(1.4)
![]() (1.5)
(1.5)
![]() (1.6)
(1.6)
Для газів із однаковими мольними теплоємностями (та однаковими значеннями К).
 ,
, 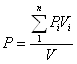 .
.
2 - змішування газових потоків (масові витрати Мі - ![]() , об'ємні витрати Vi - м3/год, тиск Рі, температура - Ті) при відношенні теплоємностей окремих газів К1, К2... Кn:
, об'ємні витрати Vi - м3/год, тиск Рі, температура - Ті) при відношенні теплоємностей окремих газів К1, К2... Кn:
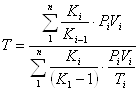 (1.7)
(1.7)
![]() (1.8)
(1.8)
при температурі Т, тиску Р.
Якщо гази перебувають під однаковим тиском, то
 ,
, ![]() .
.
Приклад 1-9. У двох посудинах утримуються гази: посудина А - 50 л азоту, при Р1 = 2МПа, t1 = 2000С; посудина В - 200 л диоксиду вуглецю при Р2 = 0,5МПа, t2 = 6000С. Визначити тиск і температуру, які будуть встановлені після приєднання посудин.
Значення ![]() ;
;
![]() ;
;
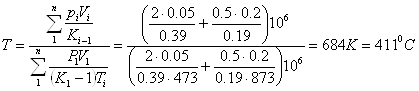
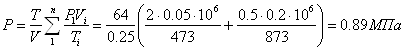 .
.
dQ = dU + dL,
де dQ - кількість теплоти, яку робоче тіло отримало зовні,
dU - зміна внутрішньої енергії робочого тіла,
dL - робота, яку здійснило робоче тіло ("зовнішня робота розширення").
Для нескінчено малої зміни стану робочого тіла
dq = du + pdu =
= d (u+ pu) - udp.
I = u + pu є параметром стану, має назву ентальпії.
Для ідеального газу
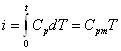 (1.9)
(1.9)
де Сpm - середня масова теплоємність при р = const в межах 0...Т.
Для теплотехнічних розрахунків необхідно знати зміну ентальпії, а не її абсолютне значення. При р = const кількість теплоти qp = i2 - i1, тобто різниця ентальпій кінцевого і вихідного стану.
Приклад 1-10. В котельній електростанції за 20 год. спалено 62т кам’яного вугілля, яке має теплоту згорання 28900 кДж/кг. Визначити середню потужність станції, якщо в електричну енергію перетворено 18% теплоти, отриманої від спалення вугілля.
Кількість теплоти, яка перетворена в електричну енергію, складає:
Q = 62*1000*28900*0,18кДж.
Еквівалентна електрична енергія або робота
![]()
Середня електрична потужність станції
![]()
Процес може бути ізохорним (V = const), ізобарним (р = const), ізотермічним (t = const), адіабатним (dq = 0), політропним (PVm = const, де m - стала величина, показник політропи).
При V = const залежність між параметрами початкового і кінцевого стану має вигляд:
![]() , а (1.10)
, а (1.10)
Зміна внутрішньої енергії
![]() (1.11). При р = const:
(1.11). При р = const: ![]() , а (1.12)
, а (1.12)
Похожие работы
... іонування у французькій мові науково-технічного, і, зокрема, науково-популярного стилю, до якого ми відносимо тексти на тему АВЕ. Ці тексти є, по суті, матеріалом, на якому ми з практичної точки зору будуємо своє дослідження лексичних особливостей перекладу французької науково-технічної літератури на українську мову [31, c.53-54]. 1.3 Науково-технічна термінологія як система 1.3.1 Термін як ...
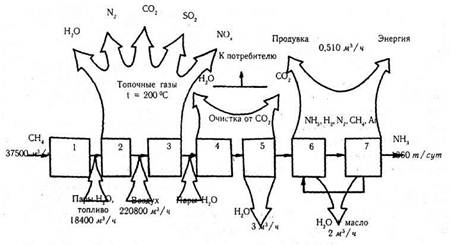
... створення маловідхідних, а потім і безвідхідних виробництв на діючих підприємствах насамперед ґрунтуються на специфіці цих виробництв. Для знову споруджуваних підприємств організація безвідхідних технологічних процесів повинна бути закладена на пошуковій і передпроектної стадії, потім конкретизована при проектуванні і реалізована в ході будівельно-монтажних робіт. Принципова технологічна схема ...
... . Варять не більше 20 хв. М'ясний порошок — однорідна маса, отримана подрібненням сухого м'яса, колір світло-коричневий. Варять не більше 5 хв. Волога в порошку не більше 10%, упаковка герметична. ЛЕКЦІЯ ПО ТОВАРОЗНАВСТВУ РИБИ 1.Характеристика сімейств риб Промислові риби класифікують по декількох ознаках. По способу і місцю життя риби ділять на морських, прісноводих, напівпрохідні і прох ...
... істю завантажувати млинове обладнання. К недолікам системи слід віднести збільшення витрат на обладнання. 1.4 Вибір типу шлаковидалення Вибір типу шлаковидалення один з важливих моментів проектування топково–пальникового пристрою котла. Економічно вигідно застосовувати топки з рідким шлаковидаленням при спалюванні низькореакційних палив (антрацит, напівантрацит, худі кам'яні вугілля), а ...
0 комментариев