Навигация
Типы кристаллических решеток
1.2. Типы кристаллических решеток
В основе кристаллической решетки лежит элементарная кристаллографическая ячейка, представляющая собой параллелепипед с характерным для данной решетки расположением атомов.
Важнейшим геометрическим свойством кристаллов, кристаллических решеток и их элементарных ячеек является, как мы уже обсуждали в предыдущем параграфе, симметрия по отношению к определенным направлениям (осям) и плоскостям. Число возможных видов симметрии ограничено. Французский кристаллограф О. Браве в 1848 г. положил начало геометрической теории структуры кристаллов и показал, что в зависимости от соотношения величин и взаимной ориентации ребер элементарной кристаллической ячейки может существовать 14 типов кристаллических решеток, которые получили название решеток Браве.
Различают примитивные (простые), базоцентрированные, объемноцентрированные и гранецентрированные решетки Браве. Если узлы кристаллической решетки расположены только в вершинах параллелепипеда, представляющего собой элементарную ячейку, то такая решетка называется примитивной или простой. Если же, кроме того, имеются узлы в центре основания параллелепипеда, то решетка называется базоцентрированной, если есть узел в месте пересечения пространственных диагоналей — решетка называется объемноцентрированной, а если имеются узлы в центре всех боковых граней — гранецентрированной.
Почти половина всех элементов образует кристаллы кубической или гексагональной симметрии, которые мы рассмотрим подробно. В кристаллах кубической системы возможны три решетки: простая, объемноцентрированная и гранецентрированная. В кубической системе все углы элементарной ячейки прямые и все ребра ее равны между собой. Элементарная ячейка гексагональной системы представляет собой прямую призму, в основании которой лежит ромб с углами 60 и 120°. Два угла между осями ячейки прямые, а один равен 120°.
Во многих случаях можно считать, что кристалл представляет собой систему из соприкасающихся твердых шаров. Минимуму энергии будет соответствовать такая структура, в которой шары наиболее плотно упакованы. Плотность упаковки или коэффициент компактности определяется отношением объема частиц к объему элементарной ячейки, Уа. В случае частиц одного сорта кратчайший период а и соотношение между радиусом шаров R и а определяет контакт между соседними шарами.
Сравним между собой в такой модели три возможных кубических структуры.
1. Простая кубическая ячейка, когда атомы находятся лишь в узлах куба: в этом случае на одну примитивную ячейку приходится один атом.
2. Гранецентрированная кубическая решетка {г. ц. к.): атомы находятся не только в узлах, но и посредине шести граней; такую структуру имеет, например, хлористый натрий.
3. Объемноцентрированная кубическая решетка (о, ц. к.): атомы находятся в узлах куба, и, кроме того, один в его центре.
Наиболее «рыхлой» оказывается структура простого куба, и химические элементы «предпочитают» не кристаллизоваться в такие структуры, хотя многие вещества в кристаллическом состоянии обладают структурой простого куба — например, CsCl, CuPd, BeCu, LiHg. Наибольшей компактностью обладает г. ц. к. структура, поэтому ее называют также кубической структурой с плотной упаковкой. Однако расположить одинаковые твердые шары в пространстве так, чтобы остающийся между ними объем был минимален, можно и другим способом — образуя гексагональную плотную упаковку (г. п. у.), причем в этой структуре плотность упаковки оказывается равной 0,74, как и в г. ц. к.
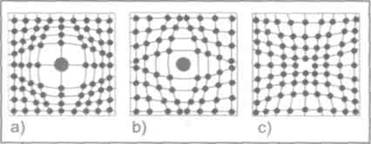
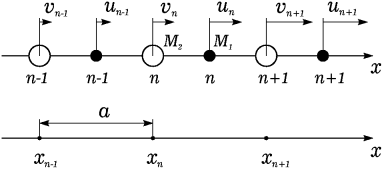
7.3. 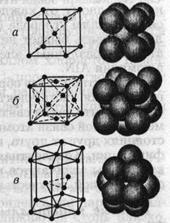 Поэтому многие металлы при определенных температурах довольно легко изменяют свою структуру с гранецентрированной кубической на структуру с гексагональной плотной упаковкой и наоборот. Каркас такой ячейки имеет гексагональное основание, соответствующее плотной упаковке твердых шаров (как мячей на столе). Следующая атомная плоскость упакована аналогично, но сдвинута так, что ее атомы располагаются между атомами первой плоскости; третья плоскость упакована так же, и ее атомы лежат в точности над атомами первой плоскости; четвертая плоскость расположена аналогично второй и т. д. На рис. 1.1.8, показаны три простейшие кристаллические решетки — объемноцентрированный куб {о. ц. к.), гранецентрированный куб {г. ц. к.), гексагональная структура плотной упаковки (г. п. у.) и их схематические представления. Рис. 1.1.8
Поэтому многие металлы при определенных температурах довольно легко изменяют свою структуру с гранецентрированной кубической на структуру с гексагональной плотной упаковкой и наоборот. Каркас такой ячейки имеет гексагональное основание, соответствующее плотной упаковке твердых шаров (как мячей на столе). Следующая атомная плоскость упакована аналогично, но сдвинута так, что ее атомы располагаются между атомами первой плоскости; третья плоскость упакована так же, и ее атомы лежат в точности над атомами первой плоскости; четвертая плоскость расположена аналогично второй и т. д. На рис. 1.1.8, показаны три простейшие кристаллические решетки — объемноцентрированный куб {о. ц. к.), гранецентрированный куб {г. ц. к.), гексагональная структура плотной упаковки (г. п. у.) и их схематические представления. Рис. 1.1.8
Типы связей в кристаллах
Классификация кристаллов по кристаллическим системам дает представление о геометрических характеристиках кристалла, но не затрагивает вопроса о природе сил, удерживающих атомы (молекулы или ионы) в определенных местах друг относительно друга — в узлах кристаллической ![]() решетки. Классификацию кристаллов можно провести по другому принципу — в зависимости от физической природы сил, действующих между частицами кристалла. В таком случае мы получаем четыре типа кристаллов (и кристаллических решеток): ионные, атомные, металлические и молекулярные. Фактически, рассматривая кристаллы с этой точки зрения, мы ищем структуру основного состояния.
решетки. Классификацию кристаллов можно провести по другому принципу — в зависимости от физической природы сил, действующих между частицами кристалла. В таком случае мы получаем четыре типа кристаллов (и кристаллических решеток): ионные, атомные, металлические и молекулярные. Фактически, рассматривая кристаллы с этой точки зрения, мы ищем структуру основного состояния.
Атомные кристаллы. В узлах кристаллической решетки атомных кристаллов находятся атомы того или другого вещества. Атомные или го-меополярные кристаллы образуются при наличии так называемой гомеопо-лярной или ковалентной связи. Такая связь есть результат квантовомеха-нического обменного взаимодействия, которое подробно разбиралось раньше на примере молекулы водорода. Ковалентная химическая связь возникав!' между двумя атомами за счет образования общей пары валентных электронов по одному от каждого атома. За счет ковалентных связей образуются кристаллы углерода (алмаз), кремния, германия, серого олова. Гомеопо-лярная связь бывает не только между одинаковыми атомами, но и между атомами различных элементов — например, карбид кремния SiC, нитрид алюминия A1N
Ковалентная связь образуется в том направлении, в котором расположена наибольшая часть электронного облака обобществленных электронов. Это означает, что такая связь имеет направленный характер и под влиянием го-меополярной связи атомы не только устанавливаются на определенных расстояниях друг от друга, но и образуют определенные пространственные конфигурации. Ковалентная химическая связь очень прочна, поэтому атомные кристаллы отличаются высокой температурой плавления, большой твердостью и малой летучестью.
Ионные кристаллы. В узлах кристаллической решетки ионных кристаллов находятся ионы. Ионы располагаются так, что силы кулоновского притяжения между ионами противоположного знака больше, чем силы отталкивания между ионами одного знака. Таким образом, ионная связь (она также называется полярной, гетерополярной) обусловлена преимущественно электростатическим взаимодействием противоположно заряженных ионов. Ионная связь является типичной для неорганических соединений. Силы электростатического притяжения и отталкивания между ионами обладают сферической симметрией, и поэтому ионы разных знаков ведут себя подобно твердым шарам, притягивающимся друг к другу.
Возникает естественный вопрос: почему многие атомы легко присоединяют электрон и становятся электроотрицательными ионами (как, например, хлор)? Казалось бы, у нейтрального атома нет сил кулоновского взаимодействия с электроном. На самом деле, действительно, взаимодействие нейтрального атома с электроном не является следствием статического притяжения. Электрон наводит в атоме электрический днпольный момент, в результате чего возникает потенциал притяжения, пропорциональный 1/г* и действующий на больших расстояниях. Во многих случаях этот поляризационный потенциал притяжения достаточно велик для того, чтобы свободный атом смог присоединить добавочный электрон.
Число ионов противоположного знака, которое составляет ближайшее окружение данного иона в кристалле, называется координационным числом К. Значение координационного числа определяется величиной отношения радиусов ионов противоположного знака гл/гд. Чем ближе это отношение к единице, тем больше К. Так, например, при равенстве ионных радиусов (гл = гд) К = 12, при гд/гв < 0,22 координационное число К — 2.
Достаточно хорошей моделью ионных кристаллов является модель твердых шаров. Это связано с тем, что степень ионизации атомов, составляющих ионный кристалл, часто такова, что электронные оболочки всех ионов соответствуют электронным оболочкам, характерным для атомов инертных газов. Так, например, электронная оболочка иона Na+ подобна Ne, иона С1~ — Аг, и тем самым ионный кристалл состоит как бы из сферических заряженных атомов. Поэтому тип решетки ионных кристаллов практически определяется соотношением ионных радиусов. Например, кристаллы хлористого натрия имеют структуру граненентрированной кубической решетки вследствие того, что размер иона хлора (1,81 А) почти вдвое превышает размер иона натрия (0,98 А); при таком соотношении ионных радиусов в центре кубической ячейки хлористого натрия свободное пространство оказывается недостаточным для размещения еще одного иона и образования объсмноцен-трированной ячейки. Иначе обстоит дело с кристаллом хлористого цезия. Размеры ионов хлора и цезия близки (1,81 и 1,65 А), пространство и центре элементарного куба оказывается достаточным для размещения еще одного иона, и энергетически выгоднее оказывается более плотно упакованная структура — объемноцептрированный куб.
Металлические кристаллы. Как и в ковалептных кристаллах, в узлах пространственной решетки металлических кристаллов размещаются совершенно одинаковые частицы (для простоты рассуждений мы будем рассматривать чистые металлы, а не сплавы). При конденсации паров металла в жидкое или твердое состояние его атомы сближаются столь близко, что волновые функции валентных электронов существенно перекрываются и становятся «общими» для всего объема металла. Поэтому валентные электроны п металлах принято называть обобществленными или коллективизированными. Можно говорить в таком случае, что внутри металлического кристалла имеется свободный электронный газ. Электроны связывают положительные ионы металла в прочную систему.
Если исходить из модели плотной упаковки шаров, то можно определить атомный радиус элемента как половину расстояния между соседними атомами. Атомный радиус металла значительно больше его ионного радиуса в каком-либо соединении. Например, радиус иона натрия в кристаллах поваренной соли равен 0,98 А, а его атомный радиус в кристалле металлического натрия — 1,89 А. Это говорит о том, что одноименно заряженные ионы металла в металлическом кристалле не могут сближаться так же тесно, как разноименные ионы в ионных соединениях.
Если предположить, что ионы металла имеют сферическую форму, то можно полагать, что структура таких кристаллов должна соответствовать плотной упаковке шаров одинакового размера — гранецентрированному или объемно центрированному кубу, либо гексагональной решетке. Ближе всего к идеальной плотноупаковашюй гексагональной решетке подходит решетка магния. Молекулярные кристаллы. В узлах кристаллической решетки таких кристаллов находятся устойчивые молекулы, которые сохраняют индивидуальность не только в газообразной, но и в жидкой и твердой фазах (На, N2, Cfo, Bra, CH, CC>2, H2O}. Молекулы удерживаются в узлах решетки довольно слабыми вандерваальсовскими силами, природа которых сводится к взаимодействию между молекулярными диполями.
Различают три вида взаимодействия молекул, связанных силами Ван-дер-Ваал ьса.
1. Если молекулы данного вещества являются электрическими диполями, то силы электростатического взаимодействия между ними будут стремиться расположить молекулы в определенном порядке, которому соответствует минимум потенциальной энергии. Такой тип взаимодействия полярных молекул, зависящий от их ориентации, называется ориентационным.
2. Неполярные молекулы некоторых веществ обладают высокой поляризуемостью, поэтому под влиянием внешнего электрического поля (например, при приближении полярной молекулы) у таких молекул возникает наведенный (индуцированный) электрический момент. При сближении такие индуцированные диполи будут взаимодействовать друг с другом аналогично взаимодействию жестких диполей. Такое взаимодействие называют индукционным или поляризационным.
3. Возможен и так называемый дисперсионный вид взаимодействия. Это динамическое по своей природе взаимодействие является результатом того, что атом (молекула) обладает вследствие движения электронов переменным по величине и направлению дипольным моментом, равным произведению заряда электрона на радиус его орбиты. Энергетически оказывается более выгодной такая конфигурация соседних атомов, когда мгновенные значения дипольных моментов соседних атомов совпадают по направлению, что приводит к возникновению притяжения между ними.
Силы Ван-дер-Ваальса являются более короткодействующими, чем ку-лоновские силы. Кулоновские силы пропорциональны г , а вандервааль-ские — ~ г~6. Эта зависимость легко получается из рассмотрения поляризационного взаимодействия, когда статический диполь с моментом р] наводит дипольный момент р2 = 2ар|/т-3. Так как pi || р2, то потенциальная энергия равна
U(г) = -2Р1р2/г3 - 4ар?/г6. (7.2)
Силы Ван-дер-Ваальса всегда слабы, поэтому молекулярные связи четко проявляются лишь в тех случаях, когда они возникают между нейтральными атомами или молекулами. Многие органические соединения (парафиновые цепи и жирные кислоты) образуют молекулярные кристаллы.
Одним из видов межмолекулярного взаимодействия является и водородная связь. Водородная связь между молекулами осуществляется атомом водорода, который, будучи химически связан с одной молекулой (например, через гидроксил), одновременно взаимодействует с атомом кислорода другой молекулы. Соединения с водородной связью обладают тенденцией к полимеризации. Существенную роль водородная связь играет во взаимодействии молекул воды, побуждая их ассоциироваться в группы из двух, четырех или восьми молекул, что обусловливает аномальные физические Конечно, классификация кристаллов по типам связи достаточно условна, ибо в ряде случаев трудно отнести с определенностью кристаллы лишь к тому или иному классу. Но, тем не менее, приближенная классификация оказывается во многих случаях очень полезна, так как она позволяет выявить физическую природу сил, а значит и свойства образующихся структур.
Похожие работы
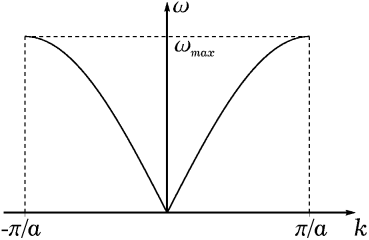
... энергий и претерпевает разрывы на границах зон Бриллюэна. Энергетические зоны являются следствием периодической структуры кристалла и представляют собою фундаментальные характеристики электронной структуры твердого тела. – граница зоны, это вектор обратной решетки. Области значений , при которых энергия электронов изменяется непрерывно, а на границах претерпевает разрыв, называются зонами ...
... при изучении синтеза новых материалов и процессов ионного транспорта в них. В чистом виде такие закономерности наиболее четко прослеживаются при исследовании монокристаллических твердых электролитов. В то же время при использовании твердых электролитов в качестве рабочих сред функциональных элементов необходимо учитывать, что нужны материалы заданного вида и формы, например в виде плотной керамики ...
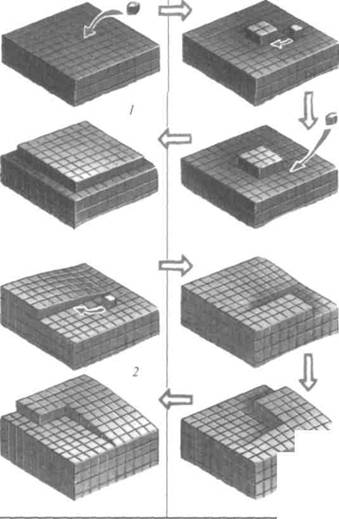
... интерес представляют вопросы прочности кристаллических тел. Как выяснилось, реальная прочность кристаллов во много раз меньше расчетной из-за наличия внутренних и поверхностных дефектов в кристаллической решетке. О механических свойствах твердых тел подробнее можно прочесть в главе, посвященной механике твердого тела Точечные дефекты возникают при замещении собственного атома чужеродным, ...
... кристаллическая решетка при тепловых колебаниях соответствует на этом рисунке переходу с одного энергетического уровня на другой равна и называется фононом. Таким образом между светом и тепловыми колебаниями кристаллической решетки можно провести аналогию – упругие волны рассматриваются как распространение неких квазиупругих частиц – фононов. Р. Паерлс в 1929 году ввел в теорию Дебая ...






0 комментариев