Навигация
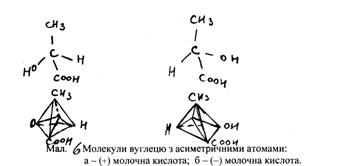
Симетрія молекул
Уявлення про симетрію дуже важливі у зв’язку, як з теоретичним, так і експериментальним вченням про будову молекул. Основні принципи симетрії використовуються у квантовій механіці, молекулярній спектроскопії та для визначення структури за допомогою дифракції нейтронів, електронів і рентгенівського випромінювання. Симетричними називаються предмети, які при дії на них операцій симетрії здатні до самосуміщення. Встановлення симетрії молекул здійснюється за допомогою елементів симетрії. Елементи симетрії – це уявні геометричні образи, за допомогою яких встановлюється симетрія молекул. Для опису симетрії молекул використовують п’ять типів елементів симетрії:
1) центр симетрії;
2) вісь власного обертання;
3) зеркальна площина;
4) інверсійні осі, або зеркально-поворотні осі;
5) елемент тотожності.
Кожен з цих елементів має зв’язану з ним операцію симетрії. Операція симетрії – це дія над молекулою із метою встановлення її симетрії. Елементи і операції симетрії зв’язані між собою. Цей зв’язок приведений в табл. 1.
Таблиця 1. Елементи симетрії і зв’язані з ними операції
| Символ | Елемент | Операція |
| i( | Центр симетрії | Проекція через центр симетрії на рівну віддаль на другий бік від центру |
| Cn(n) Lh | Вісь власного обертання | Поворот за годинниковою стрілкою навколо осі на кут 2π/n (або 360/n) |
| σh(n) p | Горизонтальна зеркальна площина, перпендикуляр на головній осі Сn | Відбиття в площині симетрії |
|
| Інверсійна вісь | Поворот за годинниковою стрілкою навколо осі Сn – на кут 360/n з наступним відбиттям в центрі симетрії перпендикулярній цій осі (тобто комбінована операція Сn-обертання з наступним відбиттям в зеркальній площині σn |
| Sn | Зеркально-поворотна вісь | Поворот за годинниковою стрілкою навколо осі на кут 360/n з наступним від- биттям у перпендикулярній площині |
| Еi(L1)1 | Елемент тотожності | Відповідає повороту на 360° |
Центр симетрії і операції інверсії. Молекула має центр симетрії (i), якщо пряма лінія, проведена від будь-якого атома через центр молекули, перетне еквівалентний атом, розміщений на рівній віддалі від центра. Центр симетрії є елементом симетрії, а відповідна операція – інверсія через центр, при якій половина молекули може бути одержана з іншої половини. Дія операції інверсії полягає в перетворенні координат точки (x, y, z) в координати (–x, – y, – z). Операції інверсії можна представити:
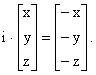
Якщо операцію інверсії провести два рази, то одержується початкова конфігурація:
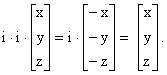
Таким чином, послідовне проведення операції (i) парну кількість раз дає операцію Е (тотожність).
Приклади центросиметричних молекул: С6Н6, SF6, CO2, C2H4.
Вісь симетрії і операція обертання. Вісь симетрії – це лінія, поворот навколо якої на кут 360/n дає структуру, що самосуміщається з вихідною. Операцію обертання позначають символом Cn (Ln) або n, де n – порядок обертання. Обертання за годинниковою стрілкою вважається додатнім. Якщо вісь z є вісь обертання С2, то дія операції обертання полягає в перетворенні координат (x, y, z) в координати (–x, – y, – z). Операцію обертання С2 можна представити так:
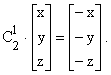
Будь-яка лінійна молекула має С¥, так як форма молекули не зміниться при повороті на будь-який кут навколо осі, що співпадає з міжядерною віссю:
¯
НС¥Cl
| |.
Сl Cl
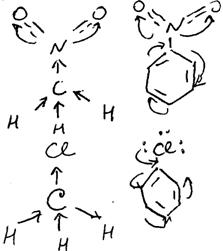
Молекула Н2О має вісь С2, яка проходить через атом О і ділить кут між зв’язками НО пополам (мал.).
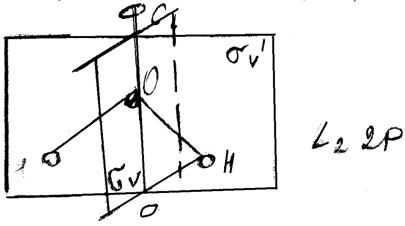
Рис. Елементи симетрії молекули Н2О.
Молекула NH3 має вісь С3, що проходить через атом азоту. Молекула С6Н6 має вісь С6 перпендикулярну площині бензольного кільця.
Наявність осі симетрії може викликати декілька операцій симетрії. Операцію симетрії, що включає поворот за годинниковою стрілкою на кут 360/n і проведену послідовно k раз, позначають Сnk.
Операції зв’язані з віссю С2: С21, С22 = Е. Перша операція – поворот на 180°, а друга – поворот на 360°, який відповідає операції тотожності Е. Тоді С2 відповідає тільки одна операція С21: С23 = С21 і С24 = Е, тобто при операції обертання (Сn) для деяких k > n нових операцій не виникає.
Операції симетрії для осей С3, С4 та С6:
С3 ¸ С31 С32; С33 = Е.
С4 ¸ С41 С42 = С21; С43; С44 = Е.
С6 ¸ С61 С62 = С31; С63 = С21; С64 = С32; С65; С66 = Е.
Для С6 є дві операції, які не можуть бути одержані іншим методом.
При обговоренні симетрії молекули зручно визначати положення молекул в прямокутниї декартових координатах. Центр ваги молекули фіксується в початку декартових координат, а її головна вісь співпадає з віссю z. Головна вісь визначається як вісь Сn вищого порядку. Якщо у молекулі є декілька осей обертання однакового вищого порядку, то за вісь z береться вісь, яка проходить через найбільше число атомів.
Площина симетрії і операція відбиття. Площина симетрії – це площина, яка ділить молекулу на дві рівні частини таким чином, що частина молекули по один бік від неї є зеркальним відображенням другої частини. Символ σ – позначає як елемент, так і операцію відбиття. σk = σ, якщо k – непарне і σk = Е, коли k – парне.
Якщо площина xz – зеркальна площина (на ^ до осі у), то операція відбиття σ може бути зображена слідуючим чином:
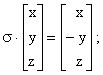
Зеркальна площина перпендикулярна Сn називається горизонтальною зеркальною площиною і позначається σh. Зеркальні площини, що проходять через головну вісь Сn, називаються вертикальними зеркальними площинами і їх позначають σv.
Діагональні вертикальні площини, які ділять кути, утворені парою горизонтальних осей С2 на дві рівні частини позначають σd.
Молекула Н2О має дві вертикальні взаємноперпендикулярні діагональні зеркальні площини σv і σv1. Одна з них співпадає з площиною молекули, а друга перпендикулярна до неї. Вісь С2 лежить на перетині двох зеркальних площин (мал.).
Лінійна молекула HCl має нескінченне число вертикальних зеркальних площин σv і всі вони включають С¥.
Зеркально-поворотна вісь – складний елемент, що складається з осі симетрії і перпендикулярної площини σh. Операція симетрії, що відповідає цьому елементу симетрії, складається з повороту на певний кут, за яким слідує відбиття в площині перпендикулярній до осі. Позначається цей елемент Sn і є добутком двох операцій: Sn = σh · Cn.
S1 еквівалентна σ – поворот на 360° з послідовним відбиттям в площину, перпендикулярно осі обертання і може бути представлене, як відбиття в зеркальній площині.
S2 – еквівалентна (i) – центру симетрії, оскільки операція S2 складається з повороту за годинниковою стрілкою на 180° з послідовним відбиття у зеркальній площині перпендикулярно осі дає ту ж конфігурацію, що і інверсія в центрі (точці), що знаходяться на перетині осі обертання і площини відбиття.
Теореми взаємодії елементів симетрії. Точкові групи.
1. Якщо до осі симетрії n-го порядку єперпендикулярна вісь другого порядку, то через точку їх перетину проходить n таких осей з кутом між ними b = 360/n (Ln + ^ L2 ® LnnL2). Звідси: наявність двох осей другого порядку, що перетинаються під кутами 90, 60, 45, 30° спричиняє обов’язкове існування осей 2, 3, 4 і 6 перпендикулярних до вихідних.
2. Якщо вісь n-го порядку лежить у площині симетрії, то вздовж цієї осі перетинається n таких площин під кутом b = 360/n (Ln + || Р ® LnnР).
3. Якщо вісь симетрії першого порядку (2, 4, 6) перпендикулярна до площини симетрії, то точкою їх перетину буде центр симетрії (L2n + ^ Р ® L2nРС).
4. Якщо площина симетрії і вісь другого порядку перетинаються під кутом 45°, то через точку їх перетину в цій площині проходить інверсійна вісь четвертого порядку Li4 + ^ L2(|| P) = Li4 2L22P).
Повна сукупність елементів симетрії молекули називається точковою групою або видом симетрії. Для визначення точкової групи молекули можна скористатися схемою:
1. Визначають чи має молекула декілька осей Сn, де n > 2, що перетинаються. Якщо є такі осі, то молекула відноситься до точкової групи вищої симетрії.
2. Якщо осей вказаних в пукті 1 немає, то шукають присутність одної осі вищого порядку (середня категорія) Сn, потім починають визначати площини симетрії та центр симетрії.
3. Якщо осей вище 2-го порядку немає, то молекула належить до низької симетрії.
Для позначення точкових груп користуються різною номенклатурою: міжнародною, формулами симетрії Браве або символами Шенфліса. В табл. 2 приведені символи точкових груп та наявні елементи симетрії в молекулах.
Таблиця 2. Типові групи по Шенфлісу і наявні елементи симетрії
| Символ | Елементи симетрії | Символ | Елементи симетрії |
| С1 | E | D3h | E, С3 (S3), 3С2, σh, 3σv |
| Сs | E, σ | D4h | E, С4 (С2, S4) 4С2, σh, 2σv, σd, i |
| Сi | E, i | D5h | E, С5 (S5), 5С2, σh, 5σv |
| С2 | E, C2 | D6h | E, С6 (С3, С2, S6, S3) 6С2, σh, 3σv, 3σd, i |
| С2v | E, С2, 2σv | D¥h | E, С¥ (S¥), ¥С2, σh ¥σv, I (C2H2) |
| С3v | E, С3, 3σv | D2d | E, С2 (S4), 2С2, 2σd |
| С4v | E, С4, 4σv | D3d | E, С3 (S6), 3С2, 3σd, i |
| С¥v | E, С¥, ¥σv | D4d | E, С4 (S8, С2), 4С2, 4σd, i |
| С2n | E, С2, σh, i | D5d | E, С5 (S10), 5S3, 5σd, i |
| С3h | E, С3, (S3) σh | Td | E, 3С2 (3S2), 4C3, 6σd |
| D2h | E, С2, 2С2, σh, 2σv, i | On | E, 3С4 (3С2, 3S4), 4С2, (4S6) 3σh, 6C2, 6σd, i |
Для молекул існує будь-яка кількість точкових груп, для кристалів – 32 точкові групи.
Будь-яку молекулу можна віднести до якогось виду симетрії, які ділять на три категорії. Нижча категорія характеризує молекули без осей вищого порядку. Середня – з одною віссю вищого порядку. Вища – з кількома осями вищого порядку. Види симетрії за характерними ознаками розподіляють на сім сингоній. Сингонією називається група видів симетрії, що має один або декілька подібних елементів симетрії при одинаковій кількості одиничних напрямків. Нижча категорія включає три сингонії – триклінну, моноклінну та ромбічну. Середня категорія – тригональну, тетрагональну і гексагональну. Вища категорія – кубічну сингонію.
Основи теорії груп. Зображення. Характер. З точки зору теоретико-групового аналізу група – це множина G елементів, що задовільняє певним вимогам. Набір операцій симетрії, яким володіє будь-який об’єкт, теж утворює групу. Така група повинна задовільняти наступним вимогам:
1. Якщо А і В є операціями симетрії даної групи, то їх добуток дає третю операцію симетрії F, що також є операцією даної групи (добуток двох елементів множини є також її елементом). Якщо добуток А ´ В = В ´ А, то множення називається комутативним, тобто порядок виконання операцій не впливає на результат.
Похожие работы
... в основному легкий. Наприклад, у зв’язку С–Н маса атома С у 12 раз більше маси атома Н, тому атом С залишається практично у спокої, а коливається Н. Електронні спектри молекул До основних характеристик кожного електронного стану молекули відносяться енергія, хвильова функція, степінь виродження, мультиплетність і час життя. Енергія молекули в заданому стані є функцією ядерної конфігурації, ...
... · NA, де r – питома вага речовини; М – молярна маса речовини = . Якщо врахувати орієнтаційний дипольний момент молекул у зовнішньому електричному полі, то рівняння Клаузиуса-Масотті набуває вигляду = . Це рівняння називають рівнянням Дебая. Поведінка речовин у змінному електричному полі. Рефракція. При дії на молекули діелектрика змінного поля поляризація залежить від зміни поля. ...
... з атомів одного елемента. Хімічною сполукою (складною речовиною) називають індивідуальну речовину, молекули якої складаються з двох або більше елементів. Таким чином, елементарною часткою в класичній теорії будови речовини є атом. А атоми в свою чергу формують хімічні частки – молекули. Тому важливим питанням у класичній теорії будови речовини є питання про будову молекул. На час створення ...
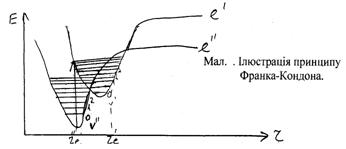
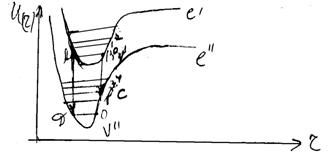
... в інший. Як уже вказувалося, при електронному збудженні молекули Еел збільшується; це приводить до збільшення моменту інерції і до зменшення обертової постійної. Тому В¢ < В². При електронних переходах в загальному випадку для обертового квантового числа у має місце звичайне правило відбору для моментів кількості руху: Dу = 0; ±1. Для зміни обертової енергії при електронно-коливних ...


0 комментариев