Навигация
Северный Государственный Медицинский Университет
Кафедра семейной медицины
Реферат на тему: «ПЦР – диагностика»
Зав.каф.: профессор В.В. Попов
Зав.курсом клинической
лабораторной диагностики:
профессор Н.А. Воробьева
Выполнила: врач-интерн
МУЗ «Городская больница№1»
г. Северодвинска
Н.Ю. Шульгина
Архангельск 2009
Содержание
Введение
Изучение ДНК: строение, структура ДНК
Основной принцип ПЦР
Осуществление рутинных методик ПЦР
Типовые ошибки при диагностике методом ПЦР
Преимущества метода ПЦР как метода диагностики инфекционных заболеваний
Ограничения метода ПЦР
Основные принципы организации ПЦР - диагностических лабораторий и
требования к проведению ПЦР - анализа
Заключение
Список использованной литературы
Введение
ДНК-диагностика - это один из наиболее современных высокотехнологичных методов исследования. ДНК-анализы широко применяются в диагностике инфекционных заболеваний, позволяя обнаруживать даже единичные микроорганизмы в организме человека.
ДНК-диагностика объединяет несколько методов исследования, самый распространенный из них - метод ПЦР (полимеразной цепной реакции, Polymerase chain reaction, PCR diagnostics) .
На сегодняшний день ПЦР -анализ является одной из наиболее распространенных и динамично развивающихся технологий лабораторной диагностики. Ежегодно на рынке появляется все больше тест-систем, предназначенных для выявления как возбудителей различных заболеваний, так и мутаций генов человека, животных и растений. Количество ПЦР-лабораторий неуклонно увеличивается, а ПЦР-анализ становится все более востребованным среди специалистов и пациентов.
Первоначально сам принцип метода полимеразной цепной реакции (ПЦР) был разработан Кэри Мюллисом в 1983г. Открытие ПЦР стало одним из наиболее выдающихся событий в области молекулярной биологии за последние 20 лет, и за разработку ПЦР-анализа Кэрри Мюллис уже в 1993 г. был удостоен Нобелевской премии в области химии.
Появлению метода проведения полимеразной цепной реакции предшествовали определенные достижения молекулярной генетики: к тому времени уже были расшифрованы нуклеотидной последовательности геномов ряда микроорганизмов и выделены специфические.
Также появлению ПЦР много способствовало открытие уникального фермента ДНК-полимеразы (или taq-полимеразы). Именно этот фермент катализирует и "контролирует" все процессы во время проведения анализа методом ПЦР. Особенность этого фермента - он термостабилен, исключительно термостоек: он выдерживает нагревание до температуры кипения без потери активности, а "любимый" его температурный режим во время работы - 72°С. Многие реакции при проведении ПЦР идут почти исключительно при повышенной температуре.
Официальное становление метода ПЦР в России связано с выходом в 1995 г. двух методических рекомендаций:
-"Диагностика хламидийной, микоплазменной и герпесвирусной инфекций методом цепной полимеразной реакции"(№95-106,утверждены МЗ РФ 08.08.95), в них ПЦР впервые рекомендована к применению в практическом здравоохранении;
-"Методические рекомендации по проведению работ в диагностических лабо- раториях, использующих метод полимеразной цепной реакции" (утверждены 22.06.95 Государственным комитетом санитарно-эпидемиологического надзора РФ), связаны с организацией работы в ПЦР-лаборатории.
В 1995 г. была впервые подготовлена техническая документация (инструкции, технические условии и др.) и зарегистрирован в Минздраве России отечественной набор реагентов для ПЦР-диагностики Chlamydia trachomatis.
За прошедшие годы появилось большое количество модификаций ПЦР, позволивших значительно увеличить потенциальные возможности первоначально предложенного метода: мультипраймерная ПЦР, гнездовая ПЦР, ПЦР in situ, ПЦР в режиме реального времени и др. При использовании метода ПЦР для идентификации РНК, а не ДНК применяется модифицированный ОТ-ПЦР метод. Одним из существенных преимуществ метода ПЦР является высокая чувствительность и специфичность. Чувствительность определяется сочетанием следующих трех факторов: эффективностью выделения ДНК возбудителя, чувствительностью собственно ПЦР и выбранного метода детекции.
Изучение ДНК: строение, структура ДНК
Дезоксирибонуклеиновая кислота (ДНК) - универсальный носитель генетической информации и наследственных признаков у всех существующих на Земле организмов. Исключение составляют только некоторые микроорганизмы, например, вирусы - универсальным носителем генетической информации у них является РНК - одноцепочечная рибонуклеиновая кислота.
Строение ДНК-молекулы
Открытие ДНК молекулы произошло в 1953 году. Френсис Крик и Джеймс Уотсон открыли структуру двойной спирали ДНК, их работа впоследствии была отмечена Нобелевской премией.
ДНК представляет собой двойную нить, скрученную в спираль. Каждая нить состоит из из последовательно соединенных нуклеотидов. Каждый нуклеотид ДНК содержит одно из четырёх азотистых оснований - гуанин (G), аденин (A) (пурины), тимин (T) и цитозин (C) (пиримидины), связанное с дезоксирибозой, к последней, в свою очередь, присоединена фосфатная группа. Между собой соседние нуклеотиды соединены в цепи фосфодиэфирной связью, образованной 3'-гидроксильной (3'-ОН) и 5'-фосфатной группами (5'-РО3). Это свойство обуславливает наличие полярности в ДНК, т.е. противоположной направленности, а именно 5'- и 3'-концов: 5'-концу одной нити соответствует 3'-конец второй нити
Структура ДНК
Первичная структура ДНК - это линейная последовательность нуклеотидов ДНК в цепи. Последовательность нуклеотидов в цепи ДНК записывают в виде буквенной формулы ДНК: например - AGTCATGCCAG, запись ведется с 5'- на 3'-конец цепи ДНК.
Вторичная структура ДНК образуется за счет взаимодействий нуклеотидов (в большей степени азотистых оснований) между собой, водородных связей. Классический пример вторичной структуры ДНК - двойная спираль ДНК. Двойная спираль ДНК - самая распространенная в природе форма ДНК, состоящая из двух полинуклеотидных цепей ДНК. Построение каждой новой цепи ДНК осуществляется по принципу комплементарности, т.е. каждому азотистому основанию одной цепи ДНК соответствует строго определенное основание другой цепи: в комплементарной паре напротив A стоит T, а напротив G располагается C и т.д.
Синтез ДНК. Репликация
Уникальным свойством ДНК является ее способность удваиваться (реплицироваться). В природе репликация ДНК происходит следующим образом: с помощью специальных ферментов (гираз), которые служат катализатором (веществами, ускоряющими реакцию), в клетке происходит расплетение спирали в том ее участке, где должна происходить репликация (удвоение ДНК). Далее водородные связи, которые связывают нити, разрываются и нити расходятся.
В построении новой цепи активным "строителем" выступает специальный фермент - ДНК-полимераза. Для удвоения ДНК необходим также стратовый блок или "фундамент", в качестве которого выступает небольшой двухцепочечный фрагмент ДНК. Этот стартовый блок, а точнее - комплементарный участок цепи родительской ДНК - взаимодействует с праймером - одноцепочечным фрагментом из 20-30 нуклеотидов. Происходит репликация или клонирование ДНК одновременно на обеих нитях. Из одной молекулы ДНК образуются две молекулы ДНК, в которых одна нить от материнской молекулы ДНК, а вторая, дочерняя, вновь синтезированная.
Таким образом, процесс репликации ДНК (удваивания) включает в себя три основных этапа:
-Расплетение спирали ДНК и расхождение нитей
-Присоединение праймеров
-Образование новой цепи ДНК дочерней нити
В основе анализа методом ПЦР лежит принцип репликации ДНК - синтеза ДНК, который современным ученым удалось воссоздать искусственно: в лаборатории врачи вызывают удвоение ДНК, но только не всей цепи ДНК, а ее небольшого фрагмента.
Основной принцип ПЦР
Любой метод ДНК-диагностики основан на специфической гибридизации двух нитей ДНК, комплементарных (структурно дополняющих) одна другой. Примерной (хотя и весьма приблизительной) аналогией может служить серологическая реакция, основанная на специфической реакции белка-антитела с соответствующим антигеном. Специфичность связывания нитей в спирали ДНК основана на связях А-Т и Г-Ц. Праймеры комплементарны искомым участкам ДНК, и поэтому они способны связываться с конкретными участками гена. Достройка нитей ДНК, начиная с добавленных праймеров, требует наличия в реакционной смеси пурин-и пиримидинтрифосфатов (АТФ, ТТФ, ГТФ и ЦТФ), а также присутствия ДНК-полимеразы, которая соединяет их в цепочку согласно последовательности второй нити ДНК.
Осуществление рутинных методик ПЦР
Исследуемым материалом для ПЦР могут служить соскобы эпителиальных клеток, кровь, плазма, сыворотка, плевральная и спинномозговая жидкости, околоплодная, суставная жидкость, бронхоальвеолярный лаваж, сок простаты, слюна, моча, мокрота, слизь и другие биологические выделения, биоптаты.
Забор материала производится в условиях процедурного кабинета соответствующего профиля. После забора пробы как можно скорее должны быть доставлены в ПЦР-диагностическую лабораторию.
Забор образцов необходимо производить при помощи стерильного, желательно одноразового, инструментария только в одноразовые стерильные пластиковые пробирки или в стеклянные пробирки, предварительно обработанные в течение часа хромовой смесью, тщательно промытые дистиллированной водой и прокаленные в сушильном шкафу при температуре 150 °С в течение 1 часа.
1. Выделение ДНК из клинического образца производится любым способом. Основное требование - достаточно стандартный выход продукта и интактность, сохранение двухнитевой структуры.
Проведению ПЦР предшествует стадия выделения и преципитации ДНК из исследуемого материала. Это обеспечивает концентрирование обнаруживаемой ДНК инфекционного агента в минимальном объеме жидкости, используемой в ПЦР. В случаях, когда не требуется достижения высокой чувствительности анализа, например, при идентификации МБТ после первичного культивирования, достаточна их обработка, позволяющая лишь разрушить микробную стенку: нагревание в лизирующем буфере, ультразвуковая обработка или использование ферментов (лизоцим) без последующего выделения ДНК.
При отсутствии в пробе ингибиторов Taq-полимеразы (гемоглобина или других) и наличия десятка копий ДНК-матрицы в объеме, вносимом в пробирку со смесью всех реагентов ПЦР, подготовка пробы может быть полностью исключена. Например, вирус гепатита В в сыворотке крови и многие возбудители инфекционных менингитов в спинномозговой жидкости можно детектировать методом ПЦР без всякой подготовки, без предварительного выделения из них ДНК. В большинстве случаев из исследуемой пробы крови, сыворотки, лейкоцитов, биоптатов, мочи, мокроты для исключения ложноотрицательного результата следует выделить ДНК тем или иным способом. Благодаря этому происходит концентрирование исследуемой ДНК-матрицы в малом объеме и удаление ингибиторов Taq-полимеразы.
В настоящее время используется несколько способов подготовки образца для проведения ПЦР. Процедура подготовки пробы включает лизис микроорганизма и экстракцию нуклеиновой кислоты. С целью разрушения клетки используют простое кипячение, замораживание-оттаивание в присутствии лизоцима, а также специальные лизирующие буферы, содержащие детергенты и протеиназу. Выбор метода диктуется природой микроорганизма, а точнее - природой его клеточной стенки.
Для экстракции ДНК используют два основных метода. Во-первых, применяют классическую процедуру фенольно-хлороформной экстракции. При этом достигается хорошая очистка ДНК и, в первую очередь, от ингибиторов Taq-полимеразы, но неизбежны большие потери нуклеиновой кислоты, особенно заметные при работе с образцами небольшого объема с низкой концентрацией инфекционного агента. Другой способ, применяемый для очистки нуклеиновой кислоты, основан на использовании сорбентов. Подготовка материала с его использованием занимает меньше времени и более проста в исполнении, хотя не всегда может быть применена, так как не гарантирует удаление возможных ингибиторов.
2. Амплификация. Полимеразная цепная реакция ДНК проводится в специальном приборе (термоциклере или амплификаторе), который, согласно введенной программе, изменяет температуру в рабочих ячейках, держит ее в течение заданного времени и переходит к следующему этапу.
Каждый цикл ПЦР обычно состоит из трех температурных режимов.
а) Нагрев до 95 °С в течение 30-40 сек. При этом выделенные молекулы ДНК подвергаются денатурации, т. е. происходит разделение ДНК на две нити.
б) Охлаждение до оптимальной температуры (обычно 48-66 °С). При этом разделенные нити ДНК могут обратно воссоединиться по комплементарным участкам. Однако, при наличии в образце целевых участков ДНК, синтетические ДНК-зонды (праймеры, длиной 15-30 п.н.) специфически связываются (гибридизуются) с комплементарными участками ДНК, например хламидии или герпесвируса. Тем самым ограничиваются искомые участки генов, определяя точки начала и окончания предполагаемого продукта ПЦР. Время отжига 20-60 сек.
в) После завершения гибридизации праймеров с искомыми участками ДНК, температуру смеси повышают до 72 °С. Эта температура оптимальна для фермента Таq ДНК-полимеразы, которая начинает быстро достраивать одну и другую цепочку ПЦР-продукта, начиная с места фиксации, соответственно, одного и второго ДНК-зонда. Этот процесс называется элонгацией (т. е. удлинением) ПЦР-продукта, сами же продукты ПЦР именуют ампликонами. Время протекания синтеза - 20-40 сек.
При первом цикле ПЦР получается некоторое число ампликонов различной длины, которые служат субстратом во втором цикле реакции, где количество специфических продуктов удваивается еще раз. В каждом из последующих циклов (всего до 35-40) происходит двукратное возрастание числа целевых продуктов ПЦР-ампликонов.
Специфичность ПЦР и количество амплифицируемой ДНК, которое определяет чувствительность, могут значительно варьировать в зависимости от концентрации и качества 5 основных компонентов реакционной смеси (ДНК-матрицы, Taq-полимеразы, праймеров, дезоксинуклеозидтрифосфатов (dNTP) и ионов Mg) и температурного режима ПЦР.
Даже при оптимальных концентрациях фермента, ионов Mg, праймеров и dNTP специфичность и чувствительность ПЦР очень сильно зависит от температуры отжига праймеров (2-я стадия цикла ПЦР): неспецифичность ПЦР-амплификации повышается при снижении температуры отжига ниже оптимальной и при повышении концентраций праймеров и dNTP выше оптимальных, а при повышении температуры отжига выше оптимальной снижается выход специфической амплифицируемой ДНК вплоть до ее полного исчезновения.
Похожие работы
... экономично использовать тесты; -пригоден для использования на автоматических открытых системах для ИФА. ЗАО "Вектор-Бест" (Новосибирск) производит следующие тест-системы для диагностики хламидиоза методом ИФА: - ХламиБест-Ig G-стрип для выявления иммуноглобулинов классов G к С. trachomatis и С. psittacci в сыворотке крови ; - ХламиБест-Trachomatis Ig G-стрип. Тест-система ...
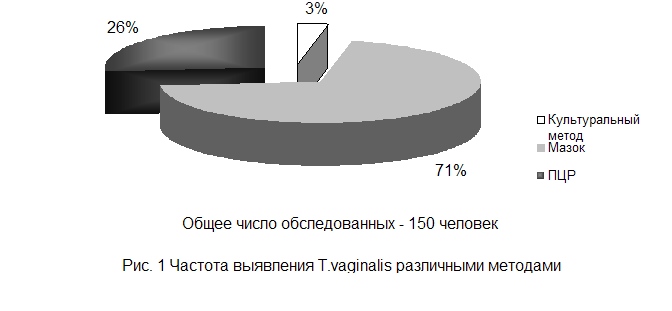
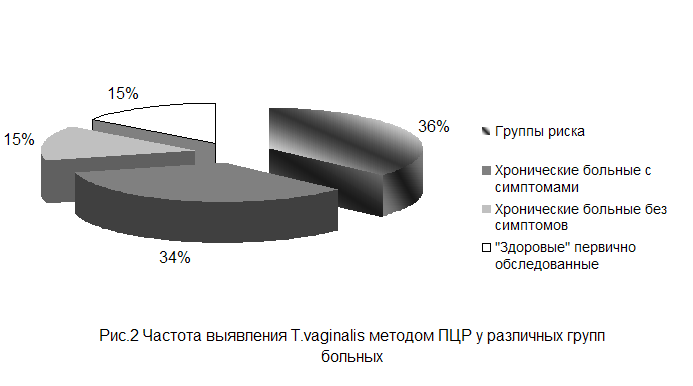
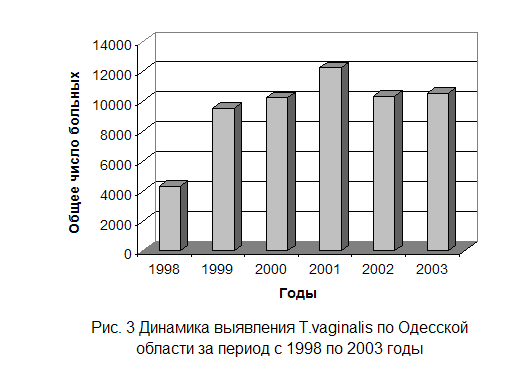
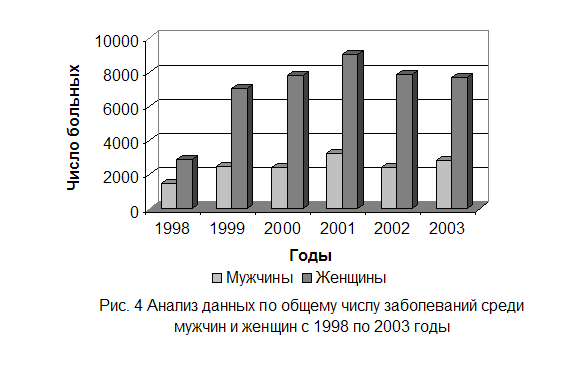
... простатитом, тогда как при острых уретритах обнаруживают мало паразитов - в основном атипичные амебоидные формы[7,10,14,15,19]. 1.4.2 Культуральное исследование Служит важным звеном лабораторной диагностики трихомоноза у мужчин и женщин, особенно при распознавании атипичных форм паразитов и выявлении их у лиц, получавших противотрихомонадные препараты при трихомонадоносительстве. ...
... допускаются в коллективы. При длительном носительстве (свыше 1 месяца) и отсутствии воспалительных изменений в носоглотке носитель допускается в коллектив, где он был выявлен. Микробиологическая диагностика гнойных бактериальных менингитов В связи с тем, что наряду с менингококками, наиболее частыми этиологическими факторами гнойных бактериальных менингитов (ГБМ) могут быть пневмококки, а ...
... в крови активность ангиотензин-конвертирующего фермента. Вследствие уменьшения альвеолярной вентиляции развивается респираторный ацидоз (снижение рН и повышение РС02) . Пути оптимизации лабораторной диагностики туберкулеза Проводимая в последние годы большая организационная работа по осуществлению противотуберкулезных мероприятий позволяет ожидать снижения эпидемиологических показателей, но ...
0 комментариев