Навигация
Пигменты хлоропластов
4 Пигменты хлоропластов
Пигменты — важнейший компонент аппарата фотосинтеза. Изучение растительных пигментов резко ускорилось благодаря работам русского физиолога растений М. С. Цвета. Пытаясь найти способ разделения пигментов на индивидуальные вещества, Цвет в 1901 — 1903 гг. открыл принципиально новый метод, который он назвал адсорбционной хроматографией. Через колонку с сорбентом пропускается растворитель с растворенными веществами. Так как вещества различаются по степени адсорбции, они перемещаются по колонке с разной скоростью. В результате происходит разделение веществ. Этот прием широко используется в современной биохимии, химии и в некоторых отраслях промышленности. С помощью хроматографического метода Цвет обнаружил два хлорофилла — а и b и разделил желтые пигменты листа на три фракции.
Пигменты пластид относятся к трем классам веществ: хлорофиллам, фикобилинам и каротиноидам.
4.1 Хлорофиллы: состав, структура, биосинтез, оптические и химические свойства, значение
Впервые хлорофилл в кристаллическом виде был описан русским физиологом и ботаником И. П. Бородиным в 1883 г. В дальнейшем оказалось, что это не сам хлорофилл, а несколько видоизмененная его форма — этилхлорофиллид.
Польские биохимики М. Ненцкий и Л. Мархлевский (1897) обнаружили, что основу молекулы хлорофилла, как и гема гемоглобина, составляет порфириновое кольцо. Таким образом было показано принципиальное структурное сходство этих пигментов у растений и животных.
Немецкий химик Р. Вильштеттер в 1906—1914 гг. установил элементарный состав хлорофилла а — C55H72O5N4Mg и хлорофилла b — C55H70O6N4Mg, а немецкий биохимик Г. Фишер в 1930—1940 гг. полностью расшифровал структурную формулу хлорофилла. В 1960 г. химики-органики Р.Б. Вудворд (США) и М. Штрель (ФРГ) осуществили искусственный синтез хлорофилла. Хлорофилл — сложный эфир дикарбоновой кислоты хлорофиллина, у которой одна карбоксильная группа этерифицирована остатком метилового спирта, а другая остатком одноатомного непредельного спирта фитола. Структурная формула хлорофилла а представлена на рисунке:
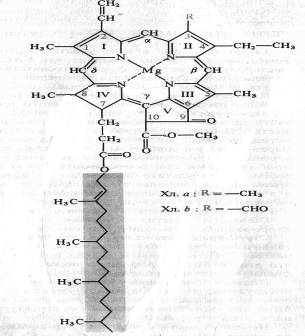
Четыре пиррольных кольца (I — IV) соединены между собой метановыми мостиками, образуя порфириновое ядро. Наружные атомы углерода в тетрапиррольном цикле обозначены цифрами 1 — 10. Атомы азота пиррольных колец четырьмя координационными связями взаимодействуют с атомом магния. В структуре порфиринового ядра есть также циклопентановое кольцо (V), образованное остатком кетопропионовой кислоты и содержащее химически активную карбонильную группу у С9 и метилированную карбоксильную группу у С10. Структура, состоящая из тетрапиррольного и циклопентанового колец, получила название форбина. Боковая цепь IV пиррольного кольца включает в себя пропионовую кислоту, связанную сложноэфирной связью с полиизопреновым непредельным спиртом фитолом (С20Н39ОН). У 1, 3, 5 и 8-го углеродов пиррольных колец имеются метальные группы, у 2-го — винильная, у 4-го — этильная группа. Порфириновое кольцо представляет собой систему из девяти пар конъюгированных (сопряженных) чередующихся двойных и одинарных связей с 18 делокализованными p-электронами. Хлорофилл b отличается от хлорофилла а тем, что у 3-го углерода вместо метильной находится формильная (—СНО) группа. Структура хлорофилла, лишенная фитола, называется хлорофиллидом. При замещении атома магния протонами в молекуле хлорофиллов образуются соответствующие феофетины.
У высших растений и водорослей обнаружены хлорофиллы а, b, с, d. Все фотосинтезирующие растения, включая все группы водорослей, а также цианобактерии, содержат хлорофиллы группы а. Хлорофилл b представлен у высших растений, у зеленых водорослей и эвгленовых. У бурых и диатомовых водорослей вместо хлорофилла b присутствует хлорофилл c, а у многих красных водорослей — хлорофилл d. В фотосинтезирующих бактериях, осуществляющих фоторедукцию, найдены различные бактериохлорофиллы.
Биосинтез хлорофиллов. Первый этап биосинтеза хлорофиллов у растений — образование 5-аминолевулиновой кислоты (А Л К) из С5-дикарбоновых кислот. Показано, что глутаминовая кислота через 2-гидроксиглутаровую превращается в 4,5-диоксовалериановую, которая затем аминируется за счет аланина или других аминокислот (рис. 5.2). Реакция переаминирования катализируется АЛК-трансаминазой с участием пиридоксальфосфата в качестве кофермента. Для синтеза АЛК может использоваться и оскетоглутаровая (2-оксоглутаровая) кислота. Циклизация двух молекул АЛК приводит к образованию пиррольного соединения — порфобилиногена. Из четырех пиррольных колец формируется уропорфириноген, который превращается в протопорфирин IX. Дальнейший путь превращений протопорфирина может быть различным. С участием железа формируется гем, входящий в состав цитохромов, каталазы, пероксидазы и гемоглобина. Если молекулу протопорфирина включается магний, затем карбоксильная группа у С10 этерифицируется метильной группой 6-аденозил-b-метионина и замыкается циклопентановое кольцо (К), то образуется протохлорофиллид. Под действием света в течение нескольких секунд протохлорофиллид превращается в хлорофиллид а в результате гидрирования двойной связи у С7 — С8 в IV пиррольном ядре. У низших растений и некоторых голосеменных (у хвойных) хлорофиллид может образовываться в темноте. Хлорофиллид обладает теми же спектральными свойствами, что и хлорофилл. Последний этап в формировании молекулы хлорофилла а — этерификация фитолом, который, как и все полиизопреновые соединения, синтезируется из ацетил-KоА через мевалоновую кислоту. По данным А. А. Шлыка (1965), хлорофилл b может образовываться из вновь синтезированных молекул хлорофилла а. Все описанные процессы, начиная с образования АЛК, осуществляются в хлоропластах. Первые признаки зеленения, выращенных в темноте этиолированных покрытосеменных растений, наблюдаются через 2 — 4 ч после начала освещения.
Физико-химические свойства хлорофиллов.
В твердом виде хлорофилл а представляет собой аморфное вещество сине-черного цвета. Температура плавления хлорофилла а 117 — 120 °С. Хлорофиллы хорошо растворимы в этиловом эфире, бензоле, хлороформе, ацетоне, этиловом спирте, плохо растворимы в петролейном эфире и нерастворимы в воде. Раствор хлорофилла а в этиловом эфире имеет сине-зеленый цвет, хлорофилла b — желто-зеленый. Резко выраженные максимумы поглощения хлорофиллов лежат в красной и синей частях спектра.
В этиловом эфире максимумы поглощения хлорофиллов группы а в красной части спектра — в пределах 660 — 663 нм, в синей — 428 — 430 нм, хлорофилла b — соответственно в пределах 642 — 644 и 452 — 455 нм. Хлорофиллы очень слабо поглощают оранжевый и желтый свет и совсем не поглощают зеленые и инфракрасные лучи. Поглощение в сине-фиолетовой части спектра обусловлено системой конъюгированных одинарных и двойных связей порфиринового кольца молекулы хлорофилла. Интенсивная полоса поглощения в красной области связана с гидрированием двойной связи у С7 — С8 в IV пиррольном ядре (при переходе от протохлорофиллида к хлорофиллиду) и присутствием магния в порфириновом кольце. Эти же условия способствуют снижению поглощения в желтой и зеленой частях спектра. Замещение магния протонами при обработке хлорофилла кислотой приводит к образованию феофетина, имеющего буро-зеленый цвет и ослабленный красный максимум поглощения. Удаление остатков фитола и метилового спирта путем щелочного гидролиза мало сказывается на спектре поглощения хлорофилла. У хлорофиллина те же спектральные свойства, что и у хлорофилла: он зеленый, имеет красный и синий максимумы поглощения.
На положение максимумов спектра поглощения оказывают влияние природа растворителя и взаимодействие молекул хлорофилла друг с другом, а также с другими пигментами, липидами и белками. У агрегированных молекул хлорофилла (например, в твердых пленках и у хлорофилла, находящегося в хлоропластах) красный максимум поглощения сдвинут в более длинноволновую область (до 680 нм).
Растворы хлорофиллов в полярных растворителях обладают яркой флуоресценцией (люминесценцией). В этиловом эфире у хлорофилла а наблюдается рубиново-красная флуоресценция с максимумом 668 нм, у хлорофилла b — 648 нм т. е. максимумы флуоресценции в соответствии с правилом Стокса несколько сдвинуты в более длинноволновую часть спектра по отношению к максимумам поглощения. Агрегированный хлорофилл и хлорофилл в нативном состоянии (в живом листе) флуоресцируют слабо. Растворы хлорофиллов способны также к фосфоресценции (т. е. длительному послесвечению), максимум которого лежит в инфракрасной области.
Механизмы флуоресценции и фосфоресценции, в том числе молекул хлорофилла, достаточно хорошо изучены. Наиболее устойчивы те состояния атомов и молекул, в которых валентные электроны занимают самые низкие энергетические уровни и распределены по ним согласно принципу Паули (не более двух электронов с антипараллельными спинами на каждой орбитали). Такое состояние молекулы называют основным синглетным (S0) энергетическим состоянием. Суммарный спин (вектор магнитных моментов) всех электронов молекулы в этом случае равен нулю. Когда молекула поглощает квант света, то за счет этой энергии электрон переходит на более высокие вакантные орбитали. Если у возбужденного электрона сохраняется то же направление спина, то молекула находится в синглетном возбужденном состоянии (S*). Если при переходе на более высокую орбиталь спин электрона обращается, то такое возбуждение называется триплетным (T*). Прямой переход из основного состояния в триплетное — маловероятное событие, так как для этого необходимо обращение ориентации спина. Переходу молекулы из основного состояния в возбужденное, происходящему при поглощении кванта света, соответствует полоса в спектре поглощения.
Поглощение молекулой хлорофилла кванта красного света приводит к синглетному электронвозбужденному состоянию — S*1.
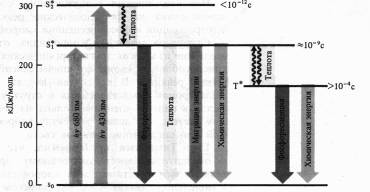
При поглощении кванта синего света с более высоким уровнем энергии электрон переходит на более высокую орбиту (S*2). Возбужденная молекула хлорофилла возвращается в основное состояние различными путями. Отдав часть энергии в виде теплоты (особенно с уровня S*1), молекула может излучить квант света с большей длиной волны (правило Стокса), что проявляется в виде флуоресценции. Как уже отмечалось, хлорофилл а поглощает свет в красной и синей областях спектра, но флуоресцирует лишь в красной. Время жизни синглетного возбужденного состояния 10-13 — 10-9 с.
Другой путь потери энергии состоит в переходе молекулы из синглетного возбужденного состояния в метастабильное триплетное (с обращением спина). Этот переход безизлуча-тельный, т. е. энергия теряется в виде теплоты. Триплетное возбужденное состояние имеет гораздо большее время жизни (>10-4 с). Из триплетного состояния молекула может вернуться в основное, излучив еще более длинноволновый (чём в случае флуоресценции) квант света. Это обычно более слабое свечение и есть фосфоресценция.
Наконец, энергия возбужденного состояния может быть использована на фотохимические реакции. В этом случае флуоресценции и фосфоресценции хлорофилла не наблюдается.
Структура молекулы хлорофилла, отобранная в процессе эволюции из многих других органических пигментов, прекрасно приспособлена к своим функциям сенсибилизатора фотохимических реакций. В ее состав входят 18 делокализованных π-электронов (представленных в структурной формуле хлорофилла в виде 18-членного кольца из конъюгированных двойных связей), что делает молекулу хлорофилла легко возбудимой при поглощении квантов света.
Еще Тимирязев предположил, что хлорофилл способен к окислительно-восстановительному превращению. Впервые реакция фотовосстановления хлорофилла была осуществлена в модельных опытах А. А. Красновским в 1948 г. Хлорофилл, растворенный в пиридине, в анаэробных условиях под действием света восстанавливается аскорбиновой кислотой или другими донорами электронов. При этом образуется восстановленная («красная») форма хлорофилла с максимумом поглощения при 525 нм:
![]()
После выключения света реакция идет в обратном направлении. Фотовосстановленный хлорофилл в свою очередь может восстанавливать различные акцепторы электронов. В той же модельной системе, но с добавлением акцептора электронов хлорофилл при освещении действует как сенсибилизатор:
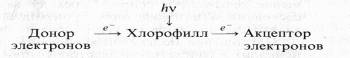
В этих условиях происходит восстановление NAD+, рибофлавина, хинона, Fe3+ , кислорода. Эти реакции получили название «реакций Красновского». Таким образом, молекула хлорофилла может выступать не только в роли первичного акцептора электрона, но и в роли его первичного донора.
Из всего сказанного следует, что молекула хлорофилла благодаря структурным и физико-химическим особенностям способна выполнять три важнейшие функции: 1) избирательно поглощать энергию света, 2) запасать ее в виде энергии электронного возбуждения, 3) фотохимически преобразовывать энергию возбужденного состояния в химическую энергию первичных фотовосстановленных и фотоокисленных соединений.
Для функционирования молекулы хлорофилла в процессах фотосинтеза существенное значение имеет ее пространственная организация. Магний-порфириновое кольцо молекулы представляет собой почти плоскую пластинку толщиной 0,42 нм и площадью 1 нм2. Это гидрофильная часть молекулы хлорофилла. Длинный алифатический остаток фитола (2 нм), образующий угол с порфириновым кольцом — ее гидрофобный полюс , необходимый для взаимодействия молекулы хлорофилла с гидрофобными участками мембранных белков и липидов.
Похожие работы
... в трофических цепях. Именно в круговоротах биогенных химических элементов, по мнению В.И. Вернадского, заключается геологическая роль живого вещества планеты. Живые организмы формируют не только биологический, но и геологический лик планеты. Важной идеей В.И. Вернадского была мысль о космической роли живого вещества, которая заключается в аккумулировании солнечной энергии и преобразовании ее в ...
... период многие страны приняли решение о полном или постепенном отказе от развития атомной энергетики. 1.3 Особенности альтернативной водородной энергетики Водородная энергетика включает следующие основные направления: Разработка эффективных методов и процессов крупномасштабного получения дешевого водорода из метана и сероводородсодержащего природного газа, а также на базе разложения воды; ...
... взаимодействия – зависимость организма от среды – была полно раскрыта от Ламарка до Мичурина. Но обратное явление – отражение жизни на среде – почти не привлекало внимание до В.И.Вернадского. Указывая, что связь живого и неживого в биосфере является взаимной, ученый писал: «Организм имеет дело со средой, к которой он не только приспособлен, но которая приспособлена и к нему». Конечно, здесь ...
... голоса, слушают пение птиц, плеск волн и шум ветра, дышат свежим воздухом. Воспользоваться таким транспортом захочет каждый, кто любит совершать водные путешествия. 6. РОССИЯ, УКРАИНА И СОЛНЕЧНАЯ ЭНЕРГЕТИКА В России в настоящее время имеется восемь предприятий, имеющих технологии и производственные мощности для изготовления 2 МВт солнечных элементов и модулей в год. В 1992 году на ...
0 комментариев