Навигация
ПАТОГЕНЕТИЧЕСКИЕ МЕХАНИЗМЫ ВЗАИМОДЕЙСТВИЯ ЛАЗЕРНОГО ИЗЛУЧЕНИЯ С БИОЛОГИЧЕСКИМИ ТКАНЯМИ
6 ПАТОГЕНЕТИЧЕСКИЕ МЕХАНИЗМЫ ВЗАИМОДЕЙСТВИЯ ЛАЗЕРНОГО ИЗЛУЧЕНИЯ С БИОЛОГИЧЕСКИМИ ТКАНЯМИ
Монохроматичность, строгая направленность, когерентность и свойство концентрировать большое количество энергии на малых площадях дают возможность избирательно коагулировать, испарять и резать биологические ткани бесконтактно, с хорошим гемостазом, стерильностью и абластичностью.
При взаимодействии лазерного излучения с биологическими тканями наблюдается целый ряд эффектов: термический, обусловленный селективным поглощением квантов света, возникновение волн сдавления и упругого удара в среде, действие мощных электромагнитных полей, сопровождающих в ряде случаев лазерное излучение, а также ряд других эффектов, обусловленных оптическими свойствами самой среды.
Высокое содержание воды в большинстве биологических тканей в значительной степени объясняет тот факт, что именно термический эффект имеет существенное значение в характеристике их повреждения, особенно при действии излучения в красной и инфракрасной областях спектра, так как поглощение в этой части спектра обусловлено практически полностью водой.
При воздействии лазерного излучения на ткани важное значение имеет степень его фокусировки . Во время прохождения сфокусированного луча лазера через живые ткани интенсивность излучения быстро падает и для мышечной ткани на глубине 4 см составляет лишь 1—2% начальной энергии. Степень и результат биологического действия лазерного излучения на разные клетки, ткани и органы зависят не только от особенностей излучения (тип лазера, длительность и плотность мощности излучения, частота импульсов и др.), но и от физико-химических и биологических особенностей облучаемых тканей или органов/(интенсивность кровотока, гетерогенность, теплопроводность, коэффициент поглощения и отражения различных промежуточных поверхностей внутри среды и др.). Наиболее чувствительными и легко разрушающимися под воздействием лазерного излучения структурами оказались внутриклеточные компоненты клетки .
Возможность концентрации лазерного излучения в узкий пучок привела к созданию лазерного скальпеля, позволяющего производить практически бескровные разрезы различных тканей. В настоящее время уже накоплен большой опыт использования лазерного излучения в экспериментальной и клинической медицине.
Гемостатические свойства лазерного излучения можно повысить, применяя специальные компрессионные зажимы и лазерные хирургические инструменты, обеспечивающие кратковременное сдавливание и обескровливание тканей по линии предполагаемого разреза. Принцип дозированной компрессии позволяет также значительно уменьшить объем термического некроза тканей, так как в условиях компрессии значительно повышается теплопроводность тканей. В связи с этим одна и та же плотность энергии сфокусированного луча лазера дает возможность более быстро осуществить рассечение тканей при компрессии, обеспечивающей локальную ишемию тканей.
Использование лазера в комплексе со специальными инструментами обеспечивает не только рассечение тканей, но и так называемую биологическую сварку их. Эффект сварки клеточных и тканевых структур отмечен исследователями, применявшими лазерный луч для рассечения различных органов. Однако только с созданием специальной лазерной хирургической аппаратуры удалось наиболее полно реализовать эффект биологической сварки тканей полых органов во время их рассечения. В облучаемой зоне наблюдается повышенная светоабсорбция за счет большей оптической плотности сжатых тканей и многократного отражения света от внутренних частей аппарата, образующих замкнутое пространство. «Сварка» тканей полых органов происходит послойно вдоль линии разреза в зоне локального сжатия тканей, производимого этими аппаратами.
Морфологическим проявлением изменений, лежащих в основе этого феномена, является коагуляционный термический некроз подвергнутых компрессии тканей с образованием по краю разреза пленки из коагулированных тканевых и клеточных элементов, соединяющей на одном уровне все анатомические слои органа
Следствием трансформации световой энергии излучения в термическую в слизистой оболочке является деформация и укорочение желез, сморщивание эпителиальных клеток с компактным расположением их ядер. Образовавшиеся структуры напоминают «частокол». В мышечной оболочке морфологические изменения менее выражены. Подслизистая основа в зоне «сварки»
![]() Таблица 1
Таблица 1
Глубина (мкм) термических повреждений стенки желудка при гастротомии с помощью углекислотного лазера (по данным световой микроскопии)
| Стенка желудка | Коагуляционный некроз | Зона дистрофических изменений и микроциркуляторных расстройств |
| Слизистая оболочка Подслизистая основа Мышечная оболочка | 36,5±5,6 46,4+5,8 32,6+4,8 | 87,6±6,1 128,6+9,4 56,7+6,3 |
становится слабо различимой. Ширина зоны коагуляционного некроза по краю рассекаемых тканей в этих случаях находится в пределах 1—2 мм. Объем некротических повреждений может быть уменьшен как благодаря увеличению количества жидкости в рассекаемых тканях, так и путем использования адекватной лазерной аппаратуры. Например, при рассечении скелетной мышцы углекислотным лазером ширина зоны коагуляционного некроза, достигающая 1,1—1,2 мм, после предварительного введения жидкости в мышцу уменьшается на 28—40%
В свою очередь применение усовершенствованной в последние годы специальной лазерной хирургической аппаратуры также позволяет сократить зону коагуляционного термического некроза до 30—60 мкм (табл. 1).
В связи с исключительно высокой температурой, присущей лазерному излучению, происходит чрезвычайно быстрое испарение межтканевой и внутриклеточной жидкости, а затем сгорание сухого остатка. Глубина и степень дистрофических изменений тканей при воздействии различных видов лазерного излучения зависят как от их спектральных характеристик, так и от суммарной энергии (продолжительность воздействия) излучения. При небольших экспозициях деструкции подвергаются лишь поверхностные слои тканей. Последовательное увеличение времени воздействия излучения сопровождается увеличением объема поврежденных тканей вплоть до перфорации органа. Перемещение лазерного луча в продольном или поперечном направлении ведет к испарению тканей и формированию линейного разреза органа.
В зоне коагуляционного термического некроза происходит коагуляция стенок сосудов и крови с образованием коагуляционного гиалиноподобного тромба, закупоривающего просвет сосуда и обеспечивающего адекватный гемостаз. В условиях дозированной компрессии при использовании лазерных хирургических аппаратов гемостатический эффект лазерного излучения в значительной степени усиливается, так как
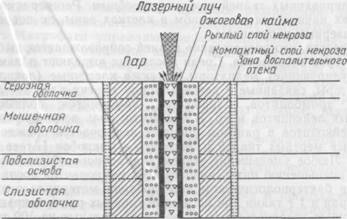
Схематическое изображение лазерной раны желудка
Сосуды с редуцированным кровообращением моментально коагулируются .
Морфология лазерной раны имеет характерные черты, резко отличающие ее от ран другого происхождения. Подвергшиеся термическому воздействию ткани представлены коагуляционным некрозом, формирующим лазерный термический струп. Последний плотно прикрывает поверхность раны. Непосредственно после лазерного воздействия трудно определить полный объем некротизированных тканей. Граница подвергшихся коагуляционному некрозу тканей стабилизируется в основном через сутки. В этот период в узкой зоне сохранившихся тканей на границе с термическим некрозом обнаруживают отек и различной степени выраженности расстройства кровообращения, проявляющиеся гиперемией, стазами, периваскулярными диапедезными кровоизлияниями.
На основе гистологических исследований выделены следующие зоны лазерного воздействия: зона коагуляционного некроза, периферическую часть которой составляет узкий рыхлый («спонгиозный») слой, а центральную — широкий, компактный, и зона воспалительного отека (рис.23).
Отмечены микроциркуляторные расстройства, наиболее выраженные при воздействии излучения АИГ-Nd-лазера и аргонового лазера (при гемостазе острых кровоточащих язв желудка). Процесс рассечения тканей углекислотным лазером сопровождается строго локальной коагуляцией последних по линии разреза, предотвращая тем самым повреждение окружающих тканей.
В лазерных ранах в отличие от ран другого происхождения слабо выражены или даже отсутствуют переходные зоны от![]()
![]() коагулированных тканей к жизнеспособным. Регенерация в этих случаях начинается в основном в клетках зоны, не поврежденной лазерным излучением.
коагулированных тканей к жизнеспособным. Регенерация в этих случаях начинается в основном в клетках зоны, не поврежденной лазерным излучением.
Известно, что повреждение тканей сопровождается выбросом медиаторов воспаления. Среди последних выделяют плазменные (циркулирующие) медиаторы, а также клеточные (локальные) медиаторы, связанные с деятельностью многих клеток — лаброцитов, тромбоцитов, макрофагов, лимфоцитов, полиморфно-ядерных лейкоцитов и др. В частности, роль полиморфно-ядерных лейкоцитов в раневом процессе заключается прежде всего в лизисе мертвых тканей и фагоцитозе микробов. Любое уменьшение степени микробного обсеменения ведет к уменьшению интенсивности всех компонентов воспаления. При бактериологическом исследовании материала с поверхности ран и 1 г ткани при иссечении гнойных ран и некрэктомии с помощью углекислотного лазера у 62 больных из 100 наблюдалась полная стерильность, а в остальных случаях отмечалось снижение содержания микробов ниже критического уровня (105).
Уменьшение степени микробного обсеменения лазерной раны, коагуляционный характер термического некроза и тромбоз сосудов в зоне некроза способствуют снижению экссудативного компонента воспаления. Наличие слабо выраженной лейкоцитарной реакции, а порой и полное ее отсутствие в краях лазерной раны подтверждено работами большинства исследователей. Коагулированные ткани не являются источником вазоактивных посредников, в частности кининов, играющих столь важную роль в становлении и развитии экссудативной фазы воспалительной реакции.
По данным В. И. Елисеенко (1980—1985), для лазерных ран характерна активная ранняя пролиферация клеточных элементов макрофагального и фибробластического ряда, обусловливающая ход репаративного процесса по типу асептического продуктивного воспаления. Пролиферация макрофагов и фибробластов в очаге продуктивного воспаления, начинающаяся с первых суток после воздействия лазерного излучения, лежит в основе формирующейся грануляционной ткани.
Однако имеются данные о том, что заживление лазерных ран может идти обычным путем, т. е. включая фазу лейкоцитарного расплавления некротизированных тканей. Заживление лазерных ран, по данным Ю. Г. Пархоменко (1979, 1983), протекает в основном под лазерным струпом. Преобразование лазерного струпа заключается в постепенной его организации и рассасывании (в паренхиматозных органах — печени и поджелудочной железе) или отторжении (в органах желудочно-кишечного тракта) по мере созревания грануляционной ткани.
Существенное значение в процессе заживления лазерных ран имеют клетки системы мононуклеарных фагоцитов — макрофаги. Макрофаги управляют дифференцировкой гранулоцитов и моноцитов из стволовой клетки, влияют на функциональную активность Т- и В-лимфоцитов, а также принимают участие а их кооперации. Они секретируют шесть первых компонентов комплемента, являясь, таким образом, посредниками привлечения иммунной системы в воспалительную реакцию. Макрофаги индуцируют роль фибробластов и синтез коллагена, т. е. являются стимуляторами завершающей фазы репаративной реакции) при воспалении. В частности, обнаружены клеточные контакты между макрофагами и фибробластами грануляционной ткани.
Можно предположить, что интенсивная и продолжительная макрофагальная реакция в лазерных ранах, связанная с длительной сохранностью коагулированных тканей, является фактором, активно стимулирующим процесс коллагенообразования..По мнению В. И. Елисеенко и соавт. (1982, 1985), функциональная роль пролиферирующих макрофагов заключается в «программировании» всего хода процесса заживления лазерных хирургических ран.
Фибробластическая реакция в процессах раннего заживления лазерных ран занимает одно из ведущих мест.
В лазерных ранах в период активного роста грануляционной ткани (5—10-е сутки) высокая плотность расположения фибробластов сочетается с наиболее резким увеличением активности НАД (НАДФ)-липоамид-дегидрогеназы (устар. диафоразы) в этих клетках, что в определенной степени может отражать повышение в них уровня энергетических и синтетических процессов. Позднее ферментативная активность этих клеток постепенно снижается, что свидетельствует об их созревании.
В формирующемся рубце лазерной раны происходит быстрое, диффузное накопление гликозаминогликанов основного вещества соединительной ткани, что свидетельствует о созревании грануляционной ткани. Известно, что после максимального увеличения числа фибробластов и их созревания усиливается и синтез коллагеновых волокон.
В процессе заживления лазерных хирургических ран органов желудочно-кишечного тракта прослеживается отчетливая взаимосвязь созревания соединительной ткани с ростом эпителия.
Таким образом, реакция макрофагов, пролиферация фибробластов и коллагеногенез проявляются очень рано и выражены тем сильнее, чем менее выражена лейкоцитарная инфильтрация, отсутствие которой обеспечивает заживление лазерных ран первичным натяжением.
Похожие работы
... -лазер мог бы стать важным элементом энергетики будущего. В частности, работая на космической орбите, он мог бы передавать энергию на Землю в виде мощного лазерного луча. 2. ПРИМЕНЕНИЕ ЛАЗЕРОВ 2.1 ПРИМЕНЕНИЕ ЛАЗЕРНОГО ЛУЧА В ПРОМЫШЛЕННОСТИ И ТЕХНИКЕ Оптические квантовые генераторы и их излучение нашли применение во многих отраслях промышленности. Так, например, в индустрии наблюдается ...
... , что исследования взаимодействия лазерного излучения с веществом представляют исключительно большой научный интерес. Лазеры находят широкое применение в современных физических, химических и биологических исследованиях, имеющих фундаментальный характер. Ярким примером могут служить исследования в области нелинейной оптики. Как уже отмечалось, лазерное излучение, обладающее достаточно высокой ...
... . Рабочий газ с большой скоростью продувают через область разряда, и джоулево тепло выносится разрядом. Применение быстрой прокачки позволяет поднять плотности энерговыделения и энергосъема. CO2-лазер в медицине применяется почти исключительно как «оптический скальпель» для резания и испарения во всех хирургических операциях. Режущее действие сфокусированного лазерного пучка основано на взрывном ...
... для анализа, мг 5 – 10 Напряжение сети питания, В 220 Габаритные размеры, мм 800*450*600 Вес не более, кг 45 4. Применение лазерной спектроскопии в анализе объектов окружающей среды Применение метода лазерной искровой спектроскопии в экологических исследованиях. Проблема загрязнения морей приобретает все более глобальный характер. Прогрессирующее загрязнение морской воды связано со ...
0 комментариев