Навигация
Металлургические способы получения лантаноидов
Металлургические способы получения лантаноидов
Содержание
Введение
1. Способы получения редкоземельных металлов
1.1 Электролитическое получение редкоземельных металлов
1.2 Металлотермические методы получения лантаноидов
1.2.1 Восстановление галоидных солей кальцием и магнием
1.2.2 Восстановление окислов с одновременной дистилляцией металлов
2. Расчет процесса восстановления фторидов редкоземельных металлов кальцием
Заключение
Список используемой литературы
Введение
До настоящего времени в промышленных масштабах производят главным образом сплавы редкоземельных металлов, например мишметалл (сплав металлов цериевой группы с различным соотношением церия и лантана), сплав дидим (сплав празеодима и неодима с примесью других лантаноидов). Кроме того, в относительно чистом виде производят церий и лантан.
Отдельные редкоземельные металлы высокой чистоты получают в лабораторных или полупромышленных масштабах.
Ввиду высокой химической прочности соединений лантаноидов (окислов, галоидных солей) для получения металлов применяют электролиз расплавленных сред или металлотермические методы восстановления. Мишметалл и церий в промышленных масштабах производят методом электролиза.
Для получения лантаноидов высокой чистоты используют преимущественно металлотермические методы.
Редкоземельные металлы получают преимущественно из безводных хлоридов или фторидов. В некоторых процессах используют также и окислы редких земель. Окислы обычно получают прокаливанием оксалатов или гидроокисей лантаноидов при температурах 600—700°С. Ниже рассмотрены основные методы получения безводных галогенидов.
Чистота получаемых металлов определяется содержанием примесей в исходных соединениях и инертностью материала, из которого изготовлены тигли для выплавки металлов и электроды (в случае применения электролиза).
Из окислов хорошей устойчивостью до 1200°С отличается электроплавленная окись магния и окись бериллия. Среди тугоплавких металлов наиболее устойчивым оказался тантал, в котором можно плавить лантаноиды при температурах до 1700°С. Хорошей устойчивостью обладает также молибден, который часто используют в качестве катодов при электролитическом получении металлов редких земель.
Графит медленно реагирует с расплавленными лантаноидами и используется в качестве электрода и для изготовления тиглей. Однако получаемые металлы в этом случае всегда содержат примесь углерода.[1]
Данная курсовая работа состоит из двух частей. Целью первой части (теоретической) является рассмотрение способов получения редкоземельных металлов. В этой части описаны электролитический и металлотермические методы получения редкоземельных металлов. Во второй (практической) части приведен расчет процесса восстановления фторидов редкоземельных металлов.
1. Способы получения редкоземельных металлов 1.1 Электролитическое получение редкоземельных металлов
Из исследованных электролитических методов производства лантаноидов практически используется электролиз безводных хлоридов в расплаве из хлоридов натрия, калия или кальция. Этим методом в производственных масштабах получают мишметалл, церий, лантан, неодим и сплав дидим. В процессе электролиза эти металлы выделяются на катоде в расплавленном состоянии, поскольку они имеют сравнительно низкие точки плавления.
Более сложным оказалось применение электролиза для получения металлов группы иттрия, которые, за исключением иттербия, имеют высокие точки плавления (от 1350 до 1700°С). Проводить электролиз при столь высоких температурах (для получения на катоде жидкого металла) практически невозможно из-за испарения галоидных солей, а также трудностей с подбором материалов для ванны и электродов. Чтобы обеспечить выделение этих металлов в жидком виде при температуре ванны не выше 1100°С, разработаны процессы электролиза с жидким катодом из кадмия или цинка с получением сплавов лантаноидов с катодными металлами. Цинк и кадмий от редкоземельного металла отделяют путем вакуумной отгонки. Этим методом в лабораторных масштабах получали лантан, самарий, гадолиний, европий, диспрозий и иттрий. Электролизом в том или ином осуществлении могут быть получены все редкоземельные металлы.[2]
Электролиз хлоридов
В настоящее время электролиз хлоридов преимущественно применяется для производства технических металлов и сплавов.
На рис. 1 показан электролизер, применявшийся для получения технического мишметалла в Германии.
Ванна состоит из графитового тигля, служащего катодом, который установлен на графитовый поддон и помещен в чугунный корпус. Последний имеет цапфы для поворота всей ванны.
Электрический ток подводится к корпусу, контакт его с графитовым поддоном тигля осуществляется с помощью набивки из графита и пека. Графитовый тигель прижимается к поддону чугунным кольцом. Чугунный корпус вместе с тиглем монтирован в железном кожухе. Пространство между кожухом и тиглем заполнено измельченным шамотом, а дно выложено шамотным кирпичом. Объем ванны 30 л. В центре устанавливается подъемный графитовый анод диаметром 100 мм.
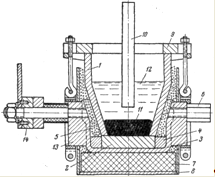
Рис. 1. Электролизер для получения технического мишметалла с тиглем из графита: 1—графитовый тигель; 2—графитовый поддон; 3—чугунный тигель; 4—графитовая набивка; 5—набивка из измельченного шамота; 6—цапфы для поворота электролизера; 7—шамотная кладка; 8—железный корпус; 9—чугунное кольцо; 10—графитовый анод; 11—расплавленный мишметалл; 12—расплавленный электролит; 13—чугунный корпус; 14—подводка тока к катоду
Указывается, что окислы редкоземельных металлов вводятся для снижения содержания углерода в получаемом сплаве. Следует отметить, что окислы лантаноидов малорастворимы в хлоридном расплаве. Вероятно, происходит частичное их хлорирование хлором, выделяющимся на аноде с образованием (РЗ)С13.
Хлориды лантаноидов хорошо растворяются в расплаве смеси КС1 и СаС12, причем последний понижает летучесть хлористого калия. Расплавление ванны первоначально производится пропусканием тока через графитовый стержень, помещенный между электродами. Затем ванна поддерживается в расплавленном состоянии за счет тепла, выделяющегося при прохождении тока через расплав. Периодически в ванну загружают новые порции шихты и ведут процесс до тех пор, пока тигель не будет заполнен. Электролиз ведется при напряжении 12—15 В и силе тока (для тигля емкостью 30 л) 2000—2200 а, что соответствует катодной плотности тока ~3 А/см2.
Содержание в электролите значительного количества оксихлоридов редкоземельных элементов затрудняет проведение электролиза. Оксихлориды не разлагаются током. Однако в их присутствии часть металла выделяется на катоде в тонкодисперсном состоянии (в виде металлического тумана). Тонкие частицы металла всплывают на поверхность ванны и окисляются. Попадая к аноду, частицы металлического тумана хлорируются с образованием хлоридов, которые растворяются в расплаве. Явление металлического тумана приводит к сильному снижению выхода по току. Слишком высокие и очень низкие плотности тока так же содействуют выделению металла в мелкодисперсном состоянии.
Расстояние анода от поверхности расплавленного металла поддерживают 30—35 мм при глубине погружения анода в ванну 100—110 мм [2].
Электролиз ведется при температуре ванны 900—1100°С в зависимости от температуры плавления электролита и мишметалла. Повышенное содержание окислов или оксихлоридов в ванне ведет к загустеванию электролита.
В процессе электролиза на аноде выделяется хлор. Поэтому ванна должна иметь хороший вентиляционный отсос.
После заполнения тигля ванна опрокидывается, и содержимое выливается в стальные изложницы, нагретые до 500—550°С. При этом солевой расплав защищает металл от окисления.
Другая конструкция электролизера показана на рис. 2. Ванна футерована магнезитом, причем катод железный, что несколько повышает содержание железа в металле.
Получаемые мишметалл содержат 94—99% редких земель и ряд примесей: углерод, кальций, алюминий, до 1% Si, от 1 до 2,5% Fe и др [2].
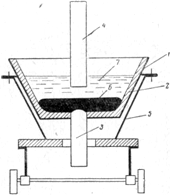
Рис. 2. Ванна для электролитического получения технического мишметалла со стальным тиглем, футерованным магнезитом: 1 — стальной тигель; 2 — магнезитовая футеровка; 3 — стальной катод; 4 — графитовый анод; 5 — тележка; 6 — расплавленный мишметалл; 7 — расплавленный электролит
Чистоту металлов можно повысить применением при изготовлении электродов металлов, не взаимодействующих с лантаноидами (молибден и особенно тантал), использованием для футеровки тигля чистых окислов магния или бериллия, а также проведением электролиза в атмосфере инертного газа.
Исследователями в лабораторных условиях разработаны технологические условия электролитического получения празеодима, иттрия, самария и гадолиния.
Электролиз проводили в графитовом стакане, служащем анодом, в центре которого устанавливали молибденовый стержень — катод. В дне ванны вытачивалось углубление, куда устанавливали фарфоровый тигель — приемник жидкого металла.
При температуре электролита 1050—1100°С и катодной плотности тока 20—30 А/см2 выход по току и извлечение составляют 40—50 и 80—85% соответственно. В процессе электролиза в ванну периодически необходимо добавлять хлорид празеодима из расчета 40—45% выхода по току.
Электролитическое выделение иттрия, гадолиния и самария может быть успешно осуществлено в ванне того же типа, но с применением жидкого цинкового катода. В этом случае, в фарфоровом тигле, помещенном в центре графитового стакана, находится расплавленный цинк—катод. Ток к жидкому катоду подводится молибденовым стержнем, изолированным от соприкосновения с электролитом фарфоровой трубкой.
При температуре электролита 800°С и катодной плотности тока 2 A/см2 выход по току для иттрия и гадолиния составляет до 95%, а для самария 65%. Общее извлечение металлов в сплав с цинком достигает 90%. [2]
Содержание самария в сплаве с цинком может быть доведено до 10%, гадолиния до 13%.
Цинк легко отделяется от редкоземельных металлов отгонкой в вакууме при температуре 900°С.[2]
1.2 Металлотермические методы получения лантаноидовРазличные исследователи изучали восстановление галоидных солей (хлоридов, фторидов), а также окислов лантаноидов щелочными металлами, алюминием, магнием и щелочноземельными металлами.
Из теплот и свободной энергии образования галогенидов лантаноидов и распространенных металлов-восстановителей, можно заключить, что для хлоридов подходящими восстановителями могут служить натрий и кальций, а для фторидов — кальций. При восстановлении хлоридов натрием, однако, не удалось получить редкоземельные металлы в виде слитка, хорошо отделяющегося от шлака.
При восстановлении галогенидов магнием и алюминием получаются сплавы редкоземельных элементов с восстановителями, причем выход в сплав недостаточно высокий. Магний может быть отделен от редкоземельного металла вакуумной дистилляцией при температуре выше температуры плавления лантаноидов, но алюминий достаточно полно этим способом не удаляется.
Лучшие результаты в отношении выхода, выплавки слитка и чистоты металлов получены при восстановлении галогенидов кальцием.
Этим методом могут быть получены все лантаноиды за исключением самария, европия и иттербия, восстановление которых протекает только до низших галогенидов. Для получения самария, европия и иттербия разработан метод восстановления их окислов лантаном, с одновременной вакуумной возгонкой этих металлов.[3]
Похожие работы
... хлоридом аммония в вакууме по методике, разработанной авторами [ 98, 108 ]. Глава III Исследование механизма электровосстановления ионов самария в хлоридных и хлоридно - фторидных расплавах. Исследование процесса электровосстановления ионов Sm3+ вольтамперометрическим методом при стационарных и нестационарных режимах поляризации ...
... ведущим классом может быть авиация, для строительства – машиностроение. При выборе дополнительных прототипов рекомендуется использовать словари технических функций, МКИ (международную классификацию изобретений). Патентные описания за последние 5–10 лет (как по рассматриваемому, так и функционально близким классам технического объекта), каталоги выставок и т.д. Иногда при выборе прототипа ...
... и хромсодержащие кеки. Имеються данные о большом количестве стоков хромовых производств, в которых содержание соединений хрома превышает предельнодопустимые концентрации. [6] 2. ОСНОВНЫЕ СОЕДИНЕНИЯ ТЯЖЕЛЫХ МЕТАЛЛОВ В ПРОМЫШЛЕННОСТИ 2.1 ХРОМ Содержание в земной коре 0,035%, наиболее распространенным видом сырья являются хромитовые руды, феррохром (60-70% получаемого хрома), известно ...
... до точки плавления, цинк опять становится хрупким – происходит очередная перестройка его кристаллической структуры. Листовой цинк широко применяют в производстве гальванических элементов. Первый «вольтов столб» состоял из кружочков цинка и меди. И в современных химических источниках тока отрицательный электрод чаще всего делается из элемента №30. Значительна роль этого элемента в полиграфии. Мы ...





0 комментариев