Навигация
Получение одноатомных спиртов (с примерами)
6. Получение одноатомных спиртов (с примерами).
В промышленности:
1) получение СН3 ОН
- из синтез-газа
- во время сухой перегонки древесины (древесный спирт),
2) гидратация алкенов,
3) брожение сахаристых веществ.
В лаборатории:
1) из алканов через галогенопроизводные,
2) восстановление альдегидов.
Физиологическое действие спиртов на организм негативно.
СН3 ОН – сильный яд! В малых количествах вызывает слепоту, в больших – приводит к смерти.
С2Н5ОН – наркотик. Под влиянием этанола у человека ослабляется внимание, затормаживается реакция, нарушается корреляция движений. При продолжительном употреблении вызывает глубокие нарушения нервной системы, заболевания сердечно-сосудистой системы, пищеварительного тракта, наступает тяжелая болезнь – алкоголизм.
7. Применение спиртов.
1) Метанол:
- в промышленном органическом синтезе (производство формальдегида),
- как растворитель,
- как добавка к бензину.
2) Этанол:
- производство уксусной кислоты,
- как растворитель,
- в парфюмерии,
- в медицине,
- как топливо,
- в пищевой промышленности.
8. Связь между ациклическими углеводородами и спиртами (показать на примерах).
Домашнее задание: пар. 17 (учебник О.С. Габриелян), тренировочные упражнения.
Приложение 1. Закрепление (если позволяет время)
1. Назвать по международной номенклатуре (2-4 примера).
2. Написать структурные формулы изомерных спиртов С4Н9 ОН и назвать их.
Приложение 2. Тренировочные домашние упражнения.
Тема: “Одноатомные спирты”.
Сложность 1 (оценка “удовлетворительно”).
1. Написать структурные формулы следующих соединений: 2-метилпентанол-1; 2,3-диметилбутанол-2; 2-метилпентен-1-ол-3.
2. Назвать вещество и написать два его гомолога и два изомера
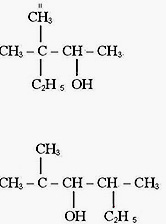
1. Какой объем водорода выделится при взаимодействии 19,5 г калия с этанолом.
Сложность 2 (оценка “хорошо”).
1. Чем объясняется изомерия спиртов? Пояснить это на примере спирта, в молекуле которого четыре атома углерода. Назвать каждый изомер.
2. Написать реакции получения метанола.
3. Осуществить превращения:
Этан -> бромэтан-> этен-> этанол-> метилэтиловый эфир. Где происходит дегиратация?
4. При сжигании 4,8 г органического вещества образовалось 3,36 л оксида углерода (IV) и 5,4 г воды. Плотность паров этого вещества по метану 2. Определить формулу вещества.
Сложность 3 (оценка “отлично”).
1. Чем отличаются первичные, вторичные и третичные спирты? (Привести примеры каждого и назвать их)
2. Предложить схему получения из пропана пропанол-1.
3. Осуществить превращения (предложить две цепочки).
4. При межмолекулярной дегидратации 100г одноатомного предельного спирта неизвестного строения выделилось 21,09 г воды и выход продукта реакции составил 75% от теоретического. Определить строение спирта.
Урок-коррекция.
1 этап. 10-15 минут. Учащиеся задают вопросы по тренировочным упражнениям.
2 этап. 20-30 минут. Самостоятельная работа. Работа разноуровневая. Учащиеся выбирают любой вариант.
Самостоятельная работа (тема: “Одноатомные спирты”).
Оценка “удовлетворительно”
| Вариант 1 | Вариант 2 |
| 1. Какие вещества называют спиртами? (привести примеры). 2. Какие спирты образуются в результате гидратации следующих веществ: этена, бутена-2. 3. Осуществить превращения: 1)С2Н 5 ОН->С2Н 4 ->С2Н 5 Cl->С2Н5 ОН 2)ацетилен- >А-> этанол 4. При взаимодействии 12,8 г спирта с натрием образовалось 4,48 л водорода. Какой это спирт? | 1. Написать общую формулу спиртов. Что такое функциональная группа? 2. Написать уравнение гидролиза водным раствором щелочи следующих соединений: хлорэтана, 2-хлорбутана. 3. Осуществить превращения: 1)СН 4 -> С2Н 2 -> С2Н 4 -> С2Н 5 ОН 2)этанол -> А-> этан 4. При дегидратации 12 г спирта образовался алкен и 3,6 г воды. Какой это спирт? |
Оценка “хорошо”
| Вариант 3 | Вариант 4 |
| 1. Объяснить образование водородных связей между молекулами спирта и влияние на физические свойства. 2. Как получить спирты из алкенов (привести два примера). 3. Осуществить превращение: оксид углерода (IV) – метанол – хлорметан – этан – углекислый газ. 4. Найти молекулярную массу вещества А: пропанол-1 – А - пропанол-2 5. 0,5 моль метанола нагрели с KBr и H2SO4 и получили 38 г бромметана. Найти выход бромметана | 1. Как доказать, что спирты отравляюще и пагубно действуют на организм человека. 2. Дописать уравнения и назвать вещества. 1. СН 3 – CHCl - СН 2 - СН 3 + КОН(водн) 2. СН 3 – CHCl - СН 2 - СН 3 + КОН(спирт) 1. Осуществить превращения: метан – этан – этен – этанол – углекислый газ 2. Определить молекулярную массу вещества А: этанол – А – 1,2-дихлорэтан. 3. Какая масса этилата натрия получится при взаимодействии этанола массой 11,5 г с натрием массой 9,2 г? |
Оценка “отлично”
| Вариант 5 | Вариант 6 |
| 1. Почему температура кипения спиртов намного выше, чем соответствующих углеводородов? 2. Сколько изомерных бутиловых спиртов может образоваться из изомерных алкенов С4Н 8 при их гидратации? 3. Написать уравнения реакций, в результате которых можно получить из метана бутадиен-1,3. 4. Метанол массой 2,04 кг получили взаимодействием оксида углерода (11) объемом 2 м3 с водородом объемом 5 м3 (ну). Найти выход продукта реакции. 5. Определить массу пропанола-2, взятого для реакции, если во время дегидратации пропанола-2 получили пропен, который обесцветил бромную воду массой 200 г. Массовая доля брома в бромной воде равна 3,2%. | 1. Почему нельзя физическими методами получить 100%-ный этанол из его водного раствора? 2. Сколько изомерных третичных спиртов имеют состав .С6Н13 ОН? Написать формулы и назвать . 3. Написать уравнения реакций, в результате которых можно получить из метана диэтиловый эфир. 4. Какую массу бутадиена-1,3 можно получить из спирта объемом 230 л и плотностью 0,8 кг/л, если массовая доля этанола в спирте 95%? Выход продукта реакции составляет 60%. 5. Вычислить массу добытого продукта, если выход на обеих стадиях синтеза составляет по 60%, если известно, что из пропанола-2 массой 24 г добыт 2-бромпропан, из которого синтезировали 2,3-диметилбутан. |
Одноатомные спирты не обладают ни щелочными, ни кислотными свойствами. Водные растворы спиртов на индикаторы не действуют.
Рассмотрим химические свойства спиртов на примере этанола. В молекуле этилового спирта СН3–СН2–ОН имеется четыре типа химических связей, различающихся полярностью: 1) Н–О;
2) С–О; 3) С–Н; 4) С–С. В результате химических превращений разрываются наиболее полярные связи Н–О, С–О и С–Н. Неполярная связь С–С в реакциях спиртов не разрывается.
1. Разрыв связи Н–О в реакции с натрием:
![]()
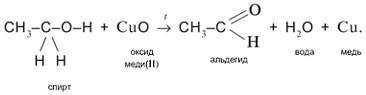
2. Одновременный разрыв связей Н–О и С–Н, находящихся при спиртовом атоме углерода, под действием окислителя (CuO) с отщеплением молекулы Н2О и образованием альдегида (СН3СНО):
2. Разрыв связи ![]() под действием нуклеофильных реагентов (ионов В– или молекул с неравномерным распределением заряда в молекуле
под действием нуклеофильных реагентов (ионов В– или молекул с неравномерным распределением заряда в молекуле ![]() ) в кислой среде.
) в кислой среде.
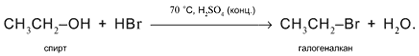
3. а) Действие кислот НСl или НВr с образованием галогеналканов:
б) Действие кислородсодержащих кислот – неорганических и органических – с образованием сложных эфиров (подробнее см. урок 29):
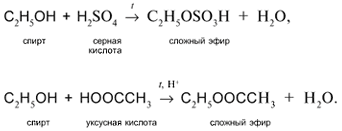
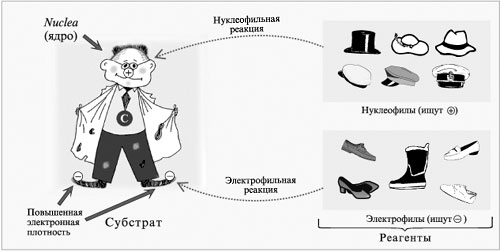
Модель нуклеофильного и электрофильного процессов
4. Внутримолекулярное отщепление Н и ОН от соседних атомов С в присутствии концентрированной серной кислоты при нагревании с образованием алкена:
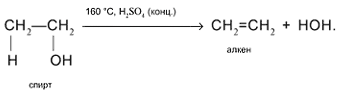
5. Межмолекулярное отщепление Н и ОН от двух разных молекул спирта при умеренном нагревании в присутствии дегидратирующих агентов. Продукт реакции – простой эфир:
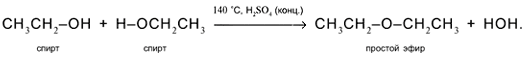
6. Спирты горят на воздухе с расщеплением всех связей и образованием углекислого газа и воды:
С2Н5ОН + 3О2![]() 2СО2 + 3Н2О.
2СО2 + 3Н2О.
Задача. Составьте уравнения реакций пропанола-1 СН3СН2СН2ОН со следующими реагентами: а) Na; б) CuO; в) HCl в присутствии H2SO4 (конц.) при нагревании; г) H2SO4 (конц.) при 160 °С (продукт – алкен); д) H2SO4 (конц.) при 140 °С (продукт – простой эфир).
Решение
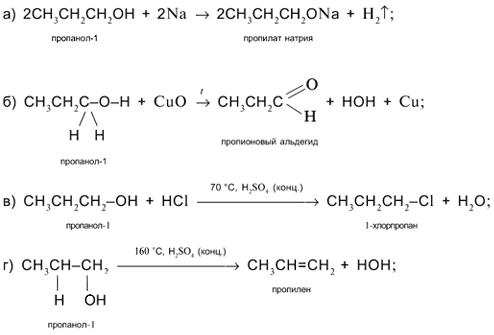
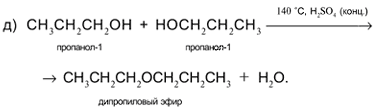
1. Составьте уравнения реакций пропанола-2 СН3СН(ОН)СН3 со следующими реагентами:
а) Na; б) CuO; в) HCl в присутствии H2SO4 (конц.) при нагревании; г) H2SO4 (конц.) при 160 °С (продукт – алкен); д) H2SO4 (конц.) при 140 °С (продукт – простой эфир).
2. Алюминий реагирует со спиртами подобно натрию. При этом происходит замещение гидроксильного водорода на металл и выделение свободного водорода Н2. Реакция протекает при нагревании около температуры кипения спирта. Составьте уравнения реакций металлического алюминия со спиртами: а) метанолом; б) этанолом.
3. Почему температуры кипения спиртов выше, чем у соответствующих по молекулярной массе углеводородов (С2Н5ОН, Мr = 46, tкип = 78 °С; С3Н8, Мr = 44, tкип = –42 °С)?
Похожие работы
... деятельность. Поиск методов и форм обучения, способствующих воспитанию творческой личности, привел к появлению некоторых специфических способов обучения, одним из которых являются игровые методы. Реализация игровых методов обучения при изучении химии в условиях соблюдения дидактических и психолого-педагогических особенностей, повышает уровень подготовки учащихся. Слово «игра» в русском языке ...
... на новые программы и учебники этот вопрос становится наиболее острым. Наша школа перешла на новое учебники О.С. Габриеляна и новую программу, как и большинство школ Заволжского района, поэтому мы представляем календарно-тематическое планирование к курсу "Органическая химия" 10 класс. Тематическое планирование составлено согласно программе разработанной Департамента образовательных программ и ...
... самообразования; повышает прочность и осознанность знаний; вырабатывает навыки общения. Необходимость использования в учебном процессе самостоятельной работы учащихся с учебником не вызывает сомнений. Учебник – это основной источник знаний по предмету, средство формирования учебных умений и овладения приемами познавательной деятельности. В процессе обучения учебник выполняет информативную, ...
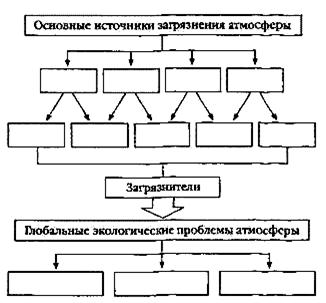
... человека. Попадая с воздухом в легкие человека, пары и асфальтовая пыль могут вызвать раковое заболевание легких. Глава 3. МЕТОДИЧЕСКИЕ РАЗРАБОТКИ ПО ТЕМЕ «ПРИРОДНЫЕ ИСТОЧНИКИ УГЛЕВОДОРОДОВ» Природные источники углеводородов Интегрированный урок по географии и химии Цели. Обобщить и систематизировать знания, активизировать познавательную деятельность учащихся, показать межпредметную связь ...

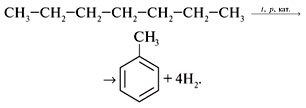
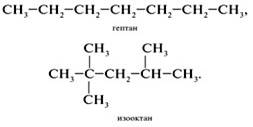
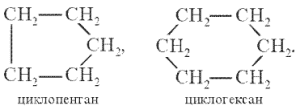
0 комментариев