Навигация
Метод підбора кінетичного рівняння
2.1 Метод підбора кінетичного рівняння
Експериментальні дані залежності концентрації реагуючої речовини від часу підставляють у різні кінетичні рівняння (7), (14) і ін.
Якщо розраховані значення константи швидкості, наприклад, по рівнянню (14) зберігаються постійними (у межах погрішностей досвіду), то порядок досліджуваної реакції буде другим.
2.2 Графічний метод
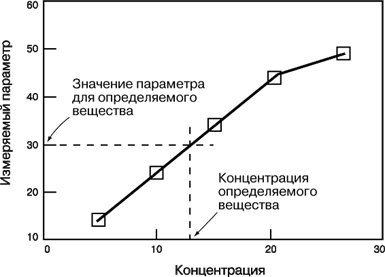
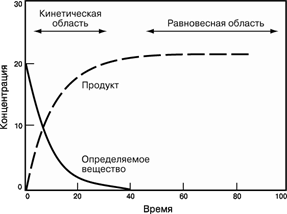
Порядок реакції зручно визначати графічним методом. Нижче приведені диференціальні рівняння швидкостей реакцій різних порядків і їхнього рішення:
кінетичний рівняння хімічна реакція
| Порядок | Рівняння швидкості реакції | Рішення рівняння |
| 1 |
|
|
| 2 |
|
|
| 3 |
|
|
Відклавши на осі абсцис час τ, а на осі ординат lgС, 1/C і 1/C2, для досліджуваної реакції одержують три лінії. Та з них, що відповідає порядкові даної реакції, буде прямою. Наприклад, якщо реакція має другий порядок, то 1/C, представлена як функція від τ, буде прямою, а функції lgС і 1/C2 від τ виявляться кривими.
2.3 Метод Оствальда- Нойеса
Допускають, що швидкість реакції при концентраціях реагентів, пропорційних їхнім стехіометричним коефіцієнтам у рівнянні хімічної реакції (або при надлишку всіх реагентів, крім одного), відповідає рівнянню (18).
Підставляючи в (18) ![]() і перетворюючи, маємо
і перетворюючи, маємо
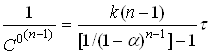 (21)
(21)
Для двох кінетичних дослідів, що протікають до одного і того ж ступеня перетворення (![]() )
)
 (22)
(22)
де С10 і С20 - початкові концентрації реагуючих речовин у досліді (1) і (2);
τ1 і τ2 - час протікання реакції в двох дослідах до одного і того ж ступеня перетворення ά.
Після логарифмування рівняння (22) одержують:
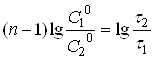
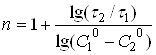 (23)
(23)
Рівняння (23) справедливе, якщо реакцію проводять до будь-якого ступеня перетворення.
Порядок реакції п може бути також розрахований на підставі даних двох кінетичних дослідів з початковими концентраціями реагуючих речовин С10 і С20 по рівнянню
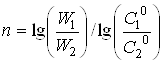 (24)
(24)
Література
1. Панченков Г.М., Лебедев В.П. Химическая кинетика и катализ: Учеб. пособие для вузов. Изд. 3-е перераб. и дополн. – М.: Химия, 1985.-592 с.
2. Боре П. Кинетика гетерогенных процессов/ Пер. с француз. – М.: Мир. 1976. - 390 с.
3. Еремин Е.Н.Основы химической кинетики. – М.: Высш. шк.,1976.-375 с.
4. Позин М.Е., Зинюк Р.Ю. Физико-химическое основы неорганической технологии: Учеб. пособие для вузов. – Л.: Химия. 1985. - 384 с.
5. Царева З.М., Орлова Е.И. Теоретические основы химической технологии. – К.: Вища шк., 1986. - 271 с.
6. Зайцев О.С. Общая химия. Состояние веществ и химические реакции. – М.: Химия. 1990. - 352 с.
Похожие работы
... є розраховувати час досягнення заданих ступенів перетворення вихідних речовин у процесах і мінімізувати цей час шляхом оптимального варіювання факторів, що впливають на швидкість реакції. Таким чином, для практичного впровадження хіміко-технологічних процесів необхідний комплексний підхід, що враховує основні закони як хімічної термодинаміки, так і хімічної кінетики. У 1865 р. М.М.Бекетов, а в ...
... ів на установці ЭМР-100 у режимі дифракції на відображення з поверхні тертя при напрузі, яка з ковзає , 100 кв. 2.3 Математична модель процесів тертя й зношування покрити по пружно - пластичній основі На підставі [12-21] простір існування властивостей детонаційно-газових покриттів можна описати, як: Ω (Rфм Rмф Rфт Rі) З обліком першого обмеження: Ω Ψ де Ψ - простір ...
... R.A. Naryshkin. Collision integral of highly excited gas // 3rd International Conference PLM MP. Abstracts. – Kyiv, 2005 (May 27–31). – P. 56 (2-6. O.). АНОТАЦІЇ Наришкін Р.О. Гідродинамічна нестійкість вихрового руху в системах з об’ємним стоком речовини. — Рукопис. Дисертація на здобуття наукового ступеня кандидата фізико-математичних наук за спеціальністю 01.04.02 — теоретична фізика.— ...
... що знаходяться в стані рівноваги. Для одержання остаточних висновків і підвищення вірогідності застосовуються методи математичного аналізу і математичного моделювання. Розділ ІІ 2.1 Міжпредметні зв’язки при розв’язуванні хімічних задач «Рішення задач – визнаний засіб розвитку мислення, яке легко поєднується з іншими засобами і прийомами навчання» (Цитович І.К.). При вивченні курсу хімії ...



0 комментариев