Навигация
Влияние гербицидов на растения
1.2 Влияние гербицидов на растения
В основе механизма действия гербицидов лежит их многостороннее влияние на рост и развитие целого растения, отдельных его органов, тканей и клеток, на клеточные структуры, органеллы клетки, физиологические и биохимические процессы, ферментативные реакции и белково-ферментные структуры.
Лишь комплексная оценка этих влияний позволяет выявить общий механизм действия гербицидов на растение. Первичное место действия гербицидов определяется его взаимодействием с чувствительными системами растения на молекулярном уровне.
Так как до настоящего времени еще не раскрыта молекулярная природа многих процессов жизнедеятельности, происходящих в растениях, то возникают трудности и с определением первичного механизма действия гербицидов.
Механизм действия гербицидов тесно связан с характером и поведением вещества-токсиканта в растении, с поглощением и перемещением его по растению и с непосредственным влиянием на жизненно важные процессы: основной, промежуточный и вторичный метаболизмы.
Действие гербицидов на основной метаболизм проявляется в нарушении процессов образования органических соединений в ходе фотосинтеза, процессов генерирования высокоэнергетических химических связей при дыхании и окислительном фосфорилировании, в ингибировании синтеза основных клеточных полимеров – белков, нуклеиновых кислот, крахмала и клетчатки. В результате действия гербицидов на промежуточный метаболизм нарушаются процессы распада и образования низкомолекулярных органических соединений, необходимых для нового синтеза; действие на вторичный метаболизм выражается в нарушении синтеза различных специфических компонентов растительных клеток типа алкалоидов, пектина, кумаринов, антоциана, фитогормонов, танинов [24].
Гербициды могут влиять на рост растений. Однако практический интерес представляют соединения, действующие на процессы основного и вторичного метаболизмов. Такие гербициды нетоксичны для теплокровных животных и человека. Более опасны и менее избирательны гербициды, нарушающие промежуточный метаболизм в растительных тканях, который в значительной степени сходен для всех живых клеток, содержащих ядра.
Механизм действия контактных гербицидов сводится к нарушению целостности клеточных мембран, увеличению их проницаемости и разрушению, ведущему к потере содержимого клеток и их отмиранию. В силу такого действия гербициды слабо или практически не перемещаются по флоэме. Однако они могут перемещаться с транспирационным током по клеткам ксилемы.
Системные гербициды действуют на один или несколько физиологических и (или) метаболических процессов в растении. Они вызывают гибель растения через несколько дней или недель после поглощения гербицида, то есть проявляют хроническое токсическое действие, в отличие от быстродействующих контактных гербицидов. Многие гербициды проявляют одновременно и контактное, и системное действия.
По характеру перемещения по растению гербициды делятся на перемещающиеся преимущественно с транспирационным током по ксилеме или с продуктами фотосинтеза по флоэме. Системные гербициды свободно перемещаются от клетки к клетке через плазмодесмы, проникая через мембраны и аккумулируясь в местах действия в токсичных количествах, не повреждая при своем движении живых, жизненно важных систем [25].
Устойчивость растений к гербицидам определяется совокупностью морфологических, физиологических и биохимических факторов, от которых зависит соотношение количеств попавшего на растение, поглощенного и разрушенного токсиканта. Если скорость детоксикации гербицида равна скорости его поступления в места действия, растение проявляет устойчивость.
Поступившие в растения и достигшие мест действия гербициды могут оказывать разностороннее влияние на важные процессы жизнедеятельности: деление клеток, развитие тканей, образование хлорофилла или пластид, фотосинтез и дыхание.
Гербициды, нарушающие процесс деления клеток (например, производные карбаматов и дитиокарбаматов), рассматриваются как митотические яды. Они прерывают нормальный процесс деления клеток (митоз) в период между метафазой и анафазой, препятствуют образованию перегородок в делящихся клетках, формирующихся после телафазы, что приводит к возникновению ненормальных многоядерных клеток [26].
Проводили сравнительные цитогенетические исследования количественных и качественных закономерностей действия гербицидов трефлан (2,6 – динитро-4 – (трифторметил) – N, N-дипропиланилин) и зенкор (4-амино-6-трет-бутил-3-метилтио – 1,2,4 – триазинон-5).
Выявлена цитогенетическая активность трефлана (рисунок 1): частота перестроек в опыте, где концентрация гербицида составляла 1 мг/л, была выше, чем в контроле более чем в 68 раз (32,37 и 0,47% соответственно).
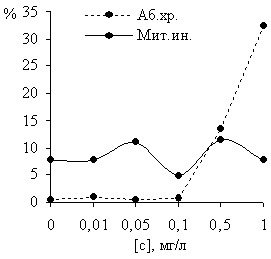
Рисунок 1 – Влияние гербицидного препарата трефлан на частоту хромосомных аберраций и величину митотического индекса у Hordeum vulgare L. сорт «Визит»
Большинство изменений представляли собой различные типы нарушений ахроматинового веретена: наблюдалось полное его разрушение, разрыв части его нитей и многополюсность, вызывающие образование полиплоидных и полиядерных клеток, в том числе клеток с микроядрами, иными словами, клеток с нерегулярным числом хромосом.
В результате изучения действия зенкора на меристематические клетки ячменя установлено, что препарат негативно влияет на процесс образования клеточной перегородки при митозе. Наблюдали двуядерные интерфазные клетки, иногда в центре таких клеток имелась незавершенная межклеточная перегородка. В анафазе регистрировали нарушения расхождения хромосом: отставания хромосом, неравномерное расхождение хромосом к полюсам, многополюсность (рисунок 2). Зенкор также негативно влиял на пролиферативную активность клеток. Показатель митотического индекса для концентраций 250, 500, и 750 мг/л был достоверно ниже, чем в контроле.
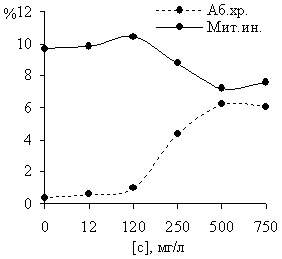
Рисунок 2 – Влияние гербицидного препарата зенкор на частоту хромосомных аберраций и величину митотического индекса у Hordeum vulgare L. Сорт «Гонар»
Гербициды типа регуляторов роста – арилоксиалканкарбоновые кислоты и их производные – нарушают рост и развитие клеток ксилемы и флоэмы, вызывая их деформацию.
Наиболее безопасными для человека и животных являются препараты, влияющие на структуры и процессы, свойственные растительным организмам и отсутствующие у теплокровных. Это прежде всего гербициды, воздействующие на процесс преобразования солнечной энергии в химическую – фотосинтез. Группа ингибиторов фотосинтеза многочисленна и включает половину препаратов, известных в настоящее время. Среди них соединения нарушающие биосинтез хлорофилла и других фотосинтетических пигментов. Фомезафен, например, ингибирует синтез каратиноидов на этапе фитоина.
К этой же группе относятся вещества, подавляющие сам процесс фотосинтеза на различных его этапах. При воздействии гербицида на фотосинтез на световой стадии I нарушается процесс восстановления метаболита Х, обладающего минимальным потенциалом, и окисления метаболита Р700, обладающего промежуточным потенциалом; действие на световой стадии II сказывается на процессе восстановления метаболита Y и одновременно протекающем процессе фотолиза воды и выделения кислорода.
Производные 4,4 – дипиридила, попав в растение, становятся посредниками при переносе электрона на световой стадии I, нарушают ее ход и «обесценивают» солнечную энергию, поглощаемую растением. Электронно-транспортная система при этом не блокируется, как в случае других гербицидов, подавляющих фотосинтез.
Большинство гербицидов – ингибиторов фотосинтеза – действуют на световую реакцию II, прерывая поток электронов к хлорофиллу и подавляя процесс фотолиза воды (реакция Хилла). Так проявляют себя нитрофенолы, производные карбаминовой кислоты, анилиды, гидроксибензонитрилы, производные мочевины, производные 1,2,5 – триазина, 1,2,4 – триазина, производные пиримидина, бензимидазолы, пиридазиноны, производные фурана (этофумезат) и производные тиадиазолов (бентазон) [28].
Перспективными являются гербициды, влияющие на синтез органических азотсодержащих веществ, в частности аминокислот в тканях растений. Сульфонилмочевины нарушают биосинтез валина и изолейцина, воздействуя на фермент ацетолактатсинтазу, катализирующую первый этап этого процесса. Аналогично действуют гербициды новой группы имидазолинонов (арсенал, АС 243997). Биосинтез ароматических аминокислот ингибирует раундап, гистидина – амитрол, глютамина – баста (фосфинотрицин).
Отсутствуют гербициды со специфичным действием на процесс дыхания растений. Некоторые препараты могут подавлять перенос электронов, блокируя отдельные этапы фосфорилирования, другие – разобщать фосфорилирование путем разрыва (гидролиза) высокоэнергетических молекул веществ, участвующих в переносе энергии, что приводит к непроизводительному расходованию энергии, освобождающейся при дыхании.
Ряд гербицидов изменяет активность клеточных ферментов, действуя на них прямо или косвенно. В первом случае молекулы гербицида взаимодействуют с веществами клеточных ядер, конкурируют с субстратом за активные места на молекулах ферментов, образуют комплексные соединения с ферментами или с их субстратами, что в одних условиях подавляет, а в других – стимулирует активность ферментов. Гербицид может конкурировать с кофакторами ферментативных белков: изменять состояние белкового кофактора и предотвращать активную связь кофактора с протеиновой частью фермента.
Косвенное действие гербицида на ферменты проявляется в торможении поступления в клетки энергии, необходимой для реакций образования АТФ, а также исходных материалов для синтеза коферментов и простетических групп, в изменении условий протекания ферментативных реакций [26].
0 комментариев