Навигация
Геохимия титана и свинца
Геологический факультет
Реферат на тему:
Геохимия титана и свинца
Выполнила студентка
4 курса геологического ф-та
Кафедры гидрогеологии
Чубарова Ирина
Санкт-Петербург 2008 год
Содержание
1. Титан – Ti
1.1 Общие сведения и история открытия элемента титана
1.2 Минералогия титана
1.3 Геохимия титана
2. Свинец – Pb
2.1 Общие сведения и история открытия элемента свинец
2.2 Минералогия свинца
2.3 Геохимия свинца
Список используемой литературы
1. Титан - Ti
1.1 Общие сведения и история открытия элемента титана
Титан открыт в конце XVIII в., когда поиски и анализы новых, еще не описанных в литературе минералов увлекали не только химиков и минералогов, но и ученых-любителей. Один из таких любителей, английский священник Грегор, нашел в своем приходе в долине Меначан в Корнуэлле черный песок, смешанный с тонким грязно-белым песком. Грегор растворил пробу песка в соляной кислоте; при этом из песка выделилось 46% железа. Оставшуюся часть пробы Грегор растворил в серной кислоте, причем почти все вещество перешло в раствор, за исключением 3,5% кремнезема. После упаривания сернокислотного раствора остался белый порошок в количестве 46% пробы. Грегор счел его особым видом извести, растворимой в избытке кислоты и осаждаемой едким кали. Продолжая исследования порошка, Грегор пришел к выводу, что он представляет собой соединение железа с каким-то неизвестным металлом. Посоветовавшись с своим другом, минералогом Хавкинсом, Грегор опубликовал в 1791 г. результаты своей работы, предложив назвать новый металл меначином (Menachine) от имени долины, в которой был найден черный песок. В соответствии с этим исходный минерал получил название менаконит. Клапрот познакомился с сообщением Грегора и независимо от него занялся анализом минерала, известного в то время под названием "красного венгерского шерла" (рутил). Вскоре ему удалось выделить из минерала окисел неизвестного металла, который он назвал титаном (Titan) по аналогии с титанами - древними мифическими обитателями земли. Клапрот намеренно избрал мифологическое название в противовес названиям элементов по их свойствам, как было предложено Лавуазье и Номенклатурной комиссией Парижской академии наук и что приводило к серьезным недоразумениям. Подозревая, что меначин Грегора и титан - один и тот же элемент, Клапрот произвел сравнительный анализ менаконита и рутила и установил идентичность обоих элементов. В России в конце XIX в. титан выделил из ильменита и подробно изучил с химической стороны Т.Е. Ловиц; при этом он отметил некоторые ошибки в определениях Клапрота. Электролитически чистый титан был получен в 1895 г. Муассаном. В русской литературе начала XIХ в. титан иногда называется титаний (Двигубский, 1824), там же через пять лет фигурирует название титан.
В периодической системе элементов титан входит в 4 группу металлов (циркон, гафний, ванадий , скандий, ниобий, тантал) с близкими по размерам атомными радиусами. В химических соединениях он проявляет валентность 2, 3, 4. Атомная масса титана 47,9, радиус иона Ti +4 0, 064 нм.
Титан существует в двух состояниях: аморфный — темно-серый порошок, плотность 3,392—3,395г/см3, и кристаллический, плотность 4,5 г/см3. Для кристаллического титана известны две модификации с точкой перехода при 885° (ниже 885° устойчивая гексагональная форма, выше — кубическая); t°пл. ок. 1680°; t кип. выше 3000°. Титан активно поглощает газы (водород, кислород, азот), которые делают его очень хрупким. Технический металл поддаётся горячей обработке давлением. Совершенно чистый металл может быть прокатан на холоду. На воздухе при обыкновенной температуре титан не изменяется, при накаливании образует смесь окиси Ti2O3 и нитрида TiN. В токе кислорода при красном калении окисляется до двуокиси TiO2. При высоких температурах реагирует с углеродом, кремнием, фосфором, серой и др. Устойчив к морской воде, азотной кислоте, влажному хлору, органическим кислотам и сильным щелочам. Растворяется в серной, соляной и плавиковой кислотах, лучше всего — в смеси HF и HNO3. Добавление к кислотам окислителя предохраняет металл от коррозии при комнатной температуре. В соединениях проявляет валентность 2, 3 и 4.
Наименее устойчивы производные Ti(2). Соединения Ti(3) устойчивы в растворе и являются сильными восстановителями. С кислородом титан даёт амфотерную двуокись титана, закись Ti0 и окись Ti2O3, имеющие основной характер, а также некоторые промежуточные окислы и перекись TiO3. Галогениды четырёхвалентного титана, за исключением TiCl4 — кристаллические тела, легкоплавкие и летучие в водном растворе гидрализованы, склонны к образованию комплексных соединений, из которых в технологии и аналитической практике имеет значение фтортитанат калия K2TiF6. Важное значение имеют карбид TiC и нитрид TiN— металлоподобные вещества, отличающиеся большой твёрдостью (карбид титан тверже карборунда), тугоплавкостью (TiC, t°пл. 3140°; TiN, t°пл. 3200°) и хорошей электропроводностью.
Похожие работы
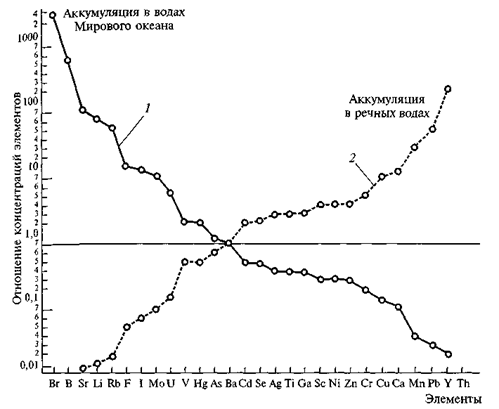
рассеянных химических элементов. Наиболее обоснованные данные о средних значениях (кларках) химических элементов в воде Мирового океана приведены в сводках Э.Д. Голдберга (1963), А.П. Виноградова (1967), Б. Мейсона (1971), Г. Хорна (1972), А.П. Лисицина (1983), К.Н. Турекиана (1969). В табл. 4.1 использованы результаты преимущественно двух последних авторов. Как видно из приведенных данных, ...
... меньше и измеряются тысячными и меньшими долями процента. Понятие о состоянии рассеяния химических элементов, так же как и о их «всюдности», было введено в науку В.И. Вернадским. Полный химический состав верхнего, так называемого гранитного, слоя континентального блока земной коры приведен в табл. 1.1. Таблица 1.1 Кларки химических элементов гранитного слоя коры континентов Химический ...
... островной дуги, разрезанной более молодыми структурами САХ. Обсуждение К основным факторам, определяющим разнообразие состава вулканитов в районе тройного сочленения Буве, относятся: плюмовая активность, сложная геодинамика района тройного сочленения, приведшая к многообразию форм взаимодействия плюмового магматизма с рифтовым магматизмом и веществом литосферы, а также, возможно, ...
... с кислородом, восстановлением - отнятие кислорода. С введением в химию электронных представлений понятие окислительно-восстановительных реакций было распространено на реакции, в которых кислород не участвует. В неорганической химии окислительно-восстановительные реакции (ОВР) формально могут рассматриваться как перемещение электронов от атома одного реагента (восстановителя) к атому другого ( ...





0 комментариев