Навигация
Способы восстановления оксидов азота
Введение
Основными источниками загрязнения атмосферного воздуха являются промышленные предприятия, транспорт, тепловые электростанции, животноводческие комплексы. Каждый из этих источников связан с выделением большого количества специфических токсичных веществ, иногда не поддающихся сразу идентификации, хотя номенклатура многотоннажных загрязнений сравнительно мала.
Для снижения загрязнения атмосферы от промышленных выбросов совершенствуют технологические процессы, осуществляют герметизацию технологического оборудования, применяют пневмотранспорт, строят различные очистные сооружения.
Наиболее эффективным направлением снижения выбросов является создание безотходных технологических процессов, предусматривающих, например, внедрение замкнутых газообразных потоков, однако до настоящего времени основным средством предотвращения вредных выбросов остается разработка и внедрение эффективных систем очистки газов. При этом под очисткой газа понимают отделение газа или превращение в безвредное состояние загрязняющего вещества, поступающего от промышленного источника.
Для обезвреживания отходящих газов от газообразных и парообразных токсичных веществ применяют следующие методы: абсорбции, адсорбции, каталитические, термические, конденсации и компримирования.
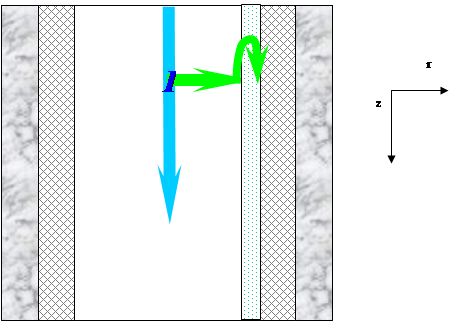
Каталитические методы очистки основаны на химических превращениях токсичных компонентов в нетоксичные на поверхности твердых катализаторов. Очистке подвергаются газы, не содержащие пыли и катализаторных ядов. Методы используются для очистки газов от оксидов азота, серы, углерода и от органических примесей. Их проводят р реакторах различной конструкции.
1. Литературный обзор
1.1 Оксиды азота, их некоторые свойства и источники
В природе известны следующие оксиды азота
Оксид азота (I) N2O представляет собой бесцветный газ со слабым запахом и сладковатым вкусом. Он известен как «веселящий газ», выделяется из почвы при внесении азотных удобрений. Оксид азота (1) довольно хорошо растворяется в воде (один объем воды поглощает при 0°С около 1,3, а при 25°С — 0,6 объема N2O), однако с ней химически не взаимодействует. Он не взаимодействует также с кислотами и щелочами. При высоких концентрациях вызывает удушье вследствие вытеснения кислорода из легких. Оксид азота (I) малотоксичен, вдыхание его в смеси с воздухом вызывает характерное состояние опьянения, сопровождающееся ослаблением болевых ощущений. Поэтому смесь оксида азота (1) с кислородом может применяться для наркоза (80% N0 и 20%О2). При температурах выше 500°С оксид азота (1) разлагается с образованием молекулы азота и кислорода
2N2O![]() 2N2 +О2
2N2 +О2
Оксид азота (II) N0 — бесцветный токсичный газ. ПДК с.с. =0.06 мг/м3. Фоновые концентрации N0 составляют до 7,4 мкг/ м3. Оксид азота плохо растворяется в воде (в одном объеме воды при 0°С растворяется лишь 0,007 объемов N0) и в химическую реакцию с ней не вступает. Температура плавления оксида азота равна -164°С, а температура кипения составляет 151°С. В твердом и жидком состояниях оксид азота имеет синий цвет. Оксид азота под действием сильных окислителей окисляется, а в присутствии восстановителей — восстанавливается. Так, он легко окисляется с кислородом и озоном.
Диоксид азота (IV) NO2 представляет собой в обычных условиях газ бурого цвета, обладает раздражающим и прижигающим действием на дыхательные пути. Более токсичен, чем NO. ПДКс.с.=0,04 мкг/ м3. Фоновые концентрации NO2 изменяются в пределах 0,4-9,4 мкг/ м3 .Он хорошо растворим в воде, один моль воды растворяет два моля диоксида азота.
Диоксид азота легко переходит в жидкость, кипящую при 21 °С. При температуре ниже 11 °С жидкий диоксид азота застывает с образованием бесцветной кристаллической массы в которой молекулы NO2 образуют димеры N2O4. Полный распад димеров на молекулы диоксида азота происходит лишь при температурах выше 140°С. Таким образом, каждой температуре в промежутке между -11° и +140°С отвечает определенное состояние равновесия обратимой реакции
NO2 +NO2![]() N2O4
N2O4
кроме них в различных производственных условиях могут образоваться следующие стабильные оксиды: N2O3 и N2O5.
NO и NO2 в атмосфере и составе газовых выбросов всегда присутствуют вместе и поэтому обобщенно обозначаются как NOX (NO +NO2=NOX). Они относятся к массовым загрязнителям атмосферы. Установлено что даже сравнительно небольшие концентрации оксидов азота в воздухе при постоянном воздействии на организм человека вызывают не благоприятную реакцию с гемоглобином крови. При концентрациях 1000-5000 мг/м3 оксид азота токсичнее диоксида азота.
Особую опасность представляет взаимодействие оксидов азота с кислородом и находящимися в воздухе углеводородами, приводящее в присутствии солнечного излучения к протеканию следующих реакций:
2NO + O2![]() 2NO2
2NO2
NO 2![]() NO + O О+О2
NO + O О+О2![]() Оз
Оз ![]() альдегиды
альдегиды ![]() кетоны
кетоны
Оз+RCH3![]() органические кислоты
органические кислоты ![]() свободные радикалы
свободные радикалы
O3 + N02 + RCH3![]() RCOONO2 // О
RCOONO2 // О
Видно, что в результате этих реакций, лежащих в основе фотохимического смога, образуется пероксиацетилнитрат, вызывающий резь в глазах, раздражающий легочную ткань.
Оксиды азота представляют опасность для озонового слоя в связи с тем, что они попадают в стратосферу в составе выхлопных газов реактивных самолетов, особенно боевых, летающих на высоте 20-50 км. Содержание оксидов азота в таких выбросах достигает 0.1% об. Под действием мягкого УФ-излучения Солнца, которое в стратосфере озоном почти не задерживается, диоксид азота разлагается с выделением оксида азота, а последний окисляется озоном. В результате ряда последовательных реакций одна молекула оксида азота способствует уничтожению в среднем 10 молекул озона.
В природных условиях оксиды азота образуются в количествах порядка 700 млн. тонн в год в результате извержения вулканов, лесных пожаров, грозовых разрядов, а также в почве и поверхностных слоях океана - вследствие протекания анаэробных процессов. Однако такое количество оксидов азота равномерно распределяется в атмосфере и образует лишь фоновые концентрации, не представляющие опасности для растений и живых организмов. Часть атмосферного диоксида азота взаимодействует с дождем и в виде азотной кислоты поступает в почву. Вероятность выпадения диоксида азота в виде кислотных дождей составляет 0,4. Азотная кислота в почве превращается в нитраты и поглощается растениями, являясь азотным удобрением природного происхождения. Полагают, что таким путем ежегодно в почву вносится до 150 кг связанного азота на гектар.
Наиболее опасны для окружающей среды и человека оксиды азота, образующиеся в результате производственной деятельности человека. Общая масса антропогенных выбросов оксидов азота составляет около 75 млн. тонн в год, т. е. примерно в 10 раз меньше природных выбросов. Несмотря на это, антропогенные выбросы представляют серьезную опасность для растений и живых организмов из-за образования локальных высоких концентраций, превышающих предельно-допустимые в десятки и более раз. Антропогенные выбросы оксидов азота образуются:
1. В процессе горения топлива в тепловых электростанциях, котельных агрегатах, двигателях внутреннего сгорания. При температурах 1000°С и выше между азотом и кислородом воздуха идет следующая реакция:
О2 + N2![]() 2NO
2NO
Часть N0 при выходе из дымовой трубы окисляется в N0: за счет взаимодействия с озоном и кислородом воздуха:
N0 + О3![]() N02 + 02
N02 + 02
2NO + О2![]() 2NO2
2NO2
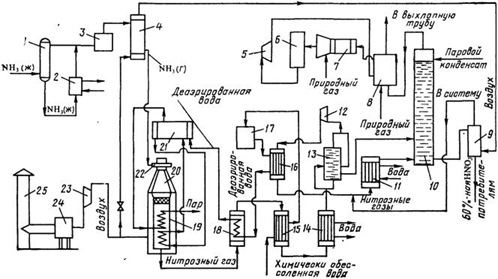
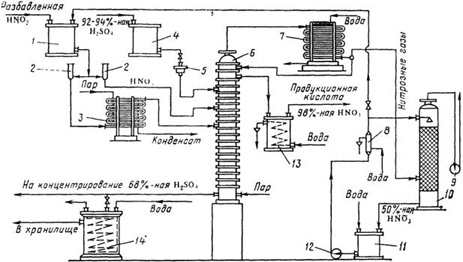
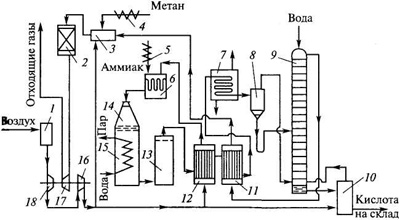
Ежегодно в составе дымовых газов в атмосферу выбрасывается порядка 50 млн. тонн оксидов азота; 2. В процессах получения и применения азотной кислоты, при производстве взрывчатых веществ, алифатических и ароматических нитросоединений, азотных удобрений, серной кислоты нитрозным способом, анилиновых красителей, вискозного волокна, травления металлов и др.. а также в газовых выбросах химической промышленности объем оксидов азота составляет порядка 25 млн. тонн в год. Например, заводы, производящие азотные удобрения, выбрасывают 5-12 т/сутки NOх и NH3, и их концентрации на расстоянии 500 м от предприятия могут достигать 1.3 мг/м3. Такие концентрации представляют опасность не только для здоровья людей, но и для растений, поскольку оксиды азота поглощаются листьями растений, нарушая при этом обмен веществ. При концентрациях от 0.2 до 0.56 мг/м3 NO2 повреждает томаты и бобовые культуры.
Способы очистки промышленных газовых выбросов от оксидов азота
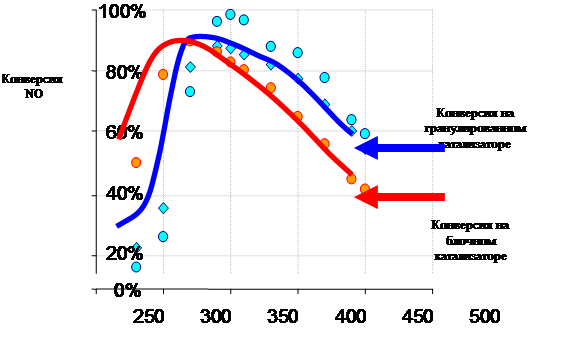
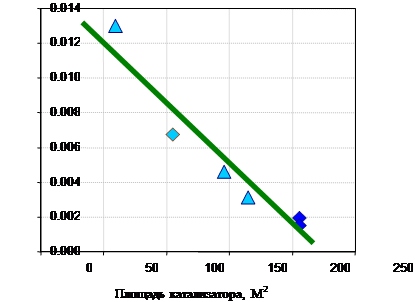
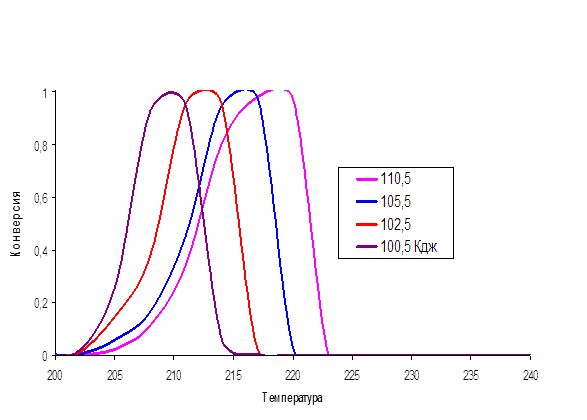
Существующие способы очистки газовых выбросов от оксидов азота подразделяются на следующие: - абсорбционные процессы очистки с хемосорбцией NOх и их превращением в другие продукты, например, в азотную кислоту, нитраты, нитриты и др. - адсорбционные методы улавливания оксидов азота с одновременным частичным или полным превращением в другие продукты, например в HNO3. - термические и термокаталитические методы восстановления оксидов азота до молекулярного азота.
Похожие работы
... ,111]. Восстановление NOx было изучено на Ag-содержащих катализаторах. Был предложен следующий ряд активности восстановителей: метанол<этанол<2-пропанол, ацетон [112]. 1.3.6. Особенности процесса каталитического восстановления оксидов азота и требования к используемым катализаторам Основной проблемой данного процесса является то, что восстановление оксидов азота необходимо проводить в ...
... ) и выбрасывают в атмосферу. Содержание оксидов азота в очищенных выхлопных газах составляет 0,005–0,008%, содержание СО2 – 0,23%. Глава 2. Реализация технологии некаталитической очистки дымовых газов от оксидов азота на мусоросжигательном заводе Процессы термического обезвреживания отходов сопровождаются образованием комплекса загрязняющих веществ, которые выбрасываются с дымовыми газами в ...
... света и, поглощая квант, переходят в возбужденное состояние. Эти вещества обладают и другой особенностью - способностью передавать энергию возбуждения молекулам кислорода, переводя их тем самым в синглетное состояние. Такие вещества называют сенсибилизаторами (S). Оксиды азота и являются активными сенсибилизаторами, вызывающими образование синглетного кислорода: S + hn S* S* + 3O2 S + 1O2 а ...
... необходимым вернуться к рассмотрению этих вопросов вновь, тем более, что можно многое использовать из ранее проделанной работы. Вредные выбросы прокатных цехов в атмосферу В прокатном производстве, как и в остальных производствах, имеются организованные технологические и неорганизованные выбросы. Основной источник технологических выбросов - нагревательные колодцы, ...

0 комментариев