Навигация
2. Расчётная часть
Как уже было сказано ранее, бериллиевая бронза БрБ2 содержит в своём составе (по массе) 97,5% Cu, 0,5% Ni, 2% Be.
Если условно обозначить медь, как компонент 1, никель, как компонент 2 и бериллий, как компонент 3, то можно для каждого компонента этой тройной системы переписать уравнение (1.3), подставив в него уравнение (1.6) в следующем виде:
![]()
![]()
![]() (2.1)
(2.1)
![]()
![]() (2.2)
(2.2)
![]()
![]() (2.3)
(2.3)
Для определения активностей компонентов бронзы при 25°С необходимо установить температурные зависимости энергий смешения Q в низкотемпературном интервале. Для этого можно использовать диаграммы состояния бинарных систем.
Для систем Be – Cu и Be – Ni такие зависимости были получены предшествующими исследователями. В данной работе будет выполнен анализ зависимостей для системы Cu – Ni.
2.1 Расчёт зависимости энергий смешения компонентов системы Cu – Ni от температуры
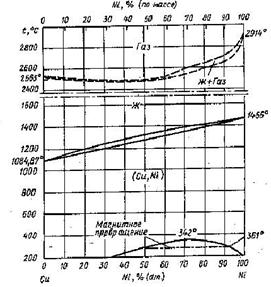
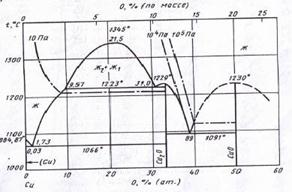
Рассмотрим низкотемпературную часть диаграммы Cu – Ni (см. рис. 1.7). Ниже линии солидуса образуется ряд непрерывных твёрдых растворов с решёткой ГЦК. Однако при температурах ниже 342°С наблюдается купол расслаивания на твёрдый раствор на основе меди (обозначим его, как α-фазу) и твёрдый раствор на основе никеля (обозначим его, как γ-фазу). Внутри купола находится смесь этих фаз.
На границе купола α-фаза находится в равновесии с γ-фазой. Это можно записать следующими уравнениями:
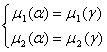 (2.4)
(2.4)
Для любого из компонентов 1 и 2 и в α- и в γ-фазе справедливо соотношение:
![]() (2.5)
(2.5)
Обе фазы имеют одинаковую структуру (ГЦК). Это можно объяснить высоким сродством меди и никеля. На диаграмме состояния (рис. 1.7) видно, что сплав плавится конгруэнтно во всём диапазоне концентраций. Более того, линии ликвидуса и солидуса расположены очень близко друг к другу, то есть плавление происходит почти в изотермических условиях, как у чистого металла. Аналогично происходит и испарение сплава.
На основании этого можно записать, что:
![]() (2.6)
(2.6)
Тогда система (2.4) перепишется в виде:
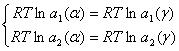 (2.7)
(2.7)
Обозначим через х мольные доли компонентов в α-фазе, а через N – мольные доли компонентов в γ-фазе, и учитывая условия нормировки их на единицу, можно систему уравнений (2.7) с учётом (1.3) и (1.6) переписать в следующем виде:
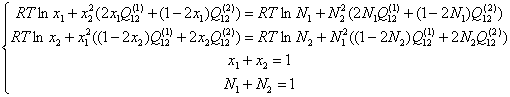 (2.8)
(2.8)
Если бы были известны мольные доли x и N при 25°С, то можно было бы с помощью (2.8) непосредственно вычислить значения Q при этой температуре. Однако при столь низкой температуре невозможно получить экспериментальных данных о координатах купола расслаивания. Дело в том, что наступление равновесия между фазами происходит, благодаря диффузии атомов, а в комнатных условиях она протекала бы экстремально долго (несколько сотен лет). Поэтому необходимо изучить температурную зависимость энергий смешения и экстраполировать её на уровень комнатных температур.
Если T=const и известны все x и N, то система уравнений (2.8) линейна относительна параметров Q и может быть решена аналитически.
Обозначим ![]() . Если теперь перенести правую часть системы (2.8) в левую, то она перепишется в виде:
. Если теперь перенести правую часть системы (2.8) в левую, то она перепишется в виде:
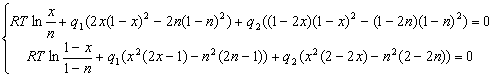 (2.9)
(2.9)
Выразим ![]() из первого уравнения системы (2.9):
из первого уравнения системы (2.9):
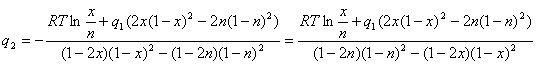 (2.10)
(2.10)
Подставим (2.10) во второе уравнение системы (2.9):
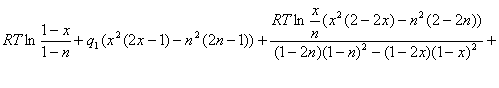
![]() (2.11)
(2.11)
Теперь можно выразить в явном виде величину ![]() :
:
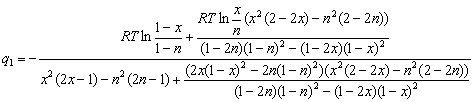 (2.12)
(2.12)
Теперь приведём выражения в числителе и знаменателе дроби (2.12) к общему знаменателю:

(2.13)
Умножив числитель и знаменатель дроби (2.13) на выражение ![]() , окончательно получим:
, окончательно получим:
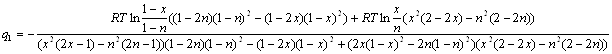
(2.14)
Система уравнений (2.9) не имеет степеней свободы, поэтому случайная погрешность отсутствует. Возможно, пользуясь законом накопления ошибок, определить систематическую погрешность и рассчитать доверительный интервал для значений Q. В данной работе это не учитывается.
Координаты купола расслаивания при различных температурах были сняты с диаграммы состояния Cu – Ni (рис. 1.7) и представлены в таблице 2.1.
Табл. 2.1. Координаты купола расслаивания твёрдого раствора при разных температурах.
| t, oC | Состав α-фазы (Cu) | Состав γ-фазы (Ni) | ||
| x1 | x2 | N1 | N2 | |
| 200 | 0,650 | 0,350 | 0,013 | 0,987 |
| 225 | 0,633 | 0,367 | 0,027 | 0,973 |
| 250 | 0,580 | 0,420 | 0,053 | 0,947 |
| 275 | 0,513 | 0,487 | 0,073 | 0,927 |
| 300 | 0,467 | 0,533 | 0,113 | 0,887 |
| 325 | 0,387 | 0,613 | 0,187 | 0,813 |
| 342 | 0,300 | 0,700 | 0,300 | 0,700 |
Для каждой из температур были проведены вычисления значений энергий смешения. ![]() вычислены по формуле (2.14), а
вычислены по формуле (2.14), а ![]() при известной
при известной ![]() по формуле (2.10). Для вычислений была использована компьютерная программа, текст которой приведён в приложении А.
по формуле (2.10). Для вычислений была использована компьютерная программа, текст которой приведён в приложении А.
Результаты вычислений приведены в таблице 2.2, а график температурной зависимости энергий смешения – на рисунке 2.1.
Табл. 2.2. Значения энергий смешения компонентов системы Cu – Ni при разных температурах
| T, K | Q12(1), Дж/моль | Q12(2), Дж/моль |
| 473 | -3197,734 | 15175,28 |
| 498 | -465,2206 | 13963,91 |
| 523 | 642,8817 | 12621,02 |
| 548 | -507,406 | 11923,95 |
| 573 | 870,6937 | 11582,78 |
| 598 | 2055,722 | 11269,64 |
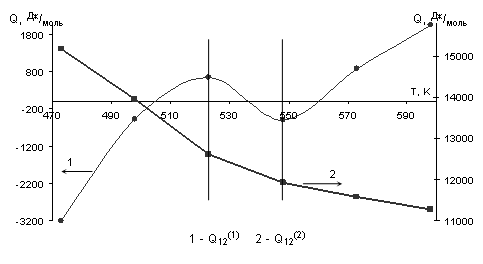
Рис. 2.1. Зависимости энергий смешения компонентов системы Cu – Ni от температуры.
Похожие работы
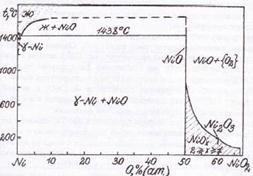
... VIII – CuO + NiO2 + {O2}. Области I и V очень малы и в масштабе диаграммы вырождаются в линии. Анализируя диаграмму Cu – Ni – O можно сделать следующие выводы о химической устойчивости медно-никелевых сплавов: 1) Окисление сплавов начинается уже при давлениях кислорода в газовой фазе над сплавами большем чем атм. Поэтому медно-никелевые сплавы будут окисляться кислородом воздуха при 25оС. 2) ...

0 комментариев