Навигация
Построение калибровочного графика
2.4. Построение калибровочного графика
В восемь конических колб вместимостью 100 мл с притертыми пробками помещаем по 25 мл приготовленных растворов. Добавляем в каждую по 15 мл 2 М Na2CO3. Одновременно в две другие колбы наливают по 10 мл раствора паранитроанилина и приливают по каплям 2%-ный раствор нитрита натрия до обесцвечивания. При этом происходит реакция образования диазопаранитроанилина.
Затем еще в одной конической колбе готовится контрольная проба: к 25 мл дистиллированной воды добавляется 15 мл карбоната натрия. Полученный раствор диазопаранитроанилина вливают в рабочую и контрольную пробы и через 5 минут измеряют оптическую плотность растворов в кюветах на 50 мм при длине волны 540 нм (зеленый светофильтр).
Каждое измерение повторяют 2 – 3 раза и из полученных расчетов берут среднее. Последовательно измеряют все восемь приготовленных растров с последовательно возрастающей концентрацией фенолов. Результаты измерений заносят в таблицу по форме 7.
Форма 7. Оптическая плотность эталонных растворов
| Концентрация фенолов в эталонных растворах, мг/л (С) | |||||||
| 0.5 | 1.0 | 1.5 | 2.0 | 2.5 | 3.0 | 3.5 | 4.0 |
| Оптическая плотность растворов (А) | |||||||
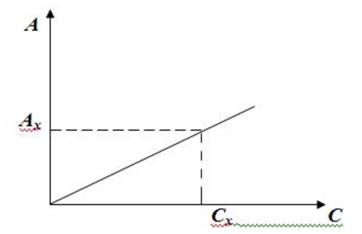
По полученным данным строят калибровочный график в координатах Аэт. – Сэт. Масштаб графика должен соответствовать точности измерений.
3. Проведение анализа отобранной пробы сточной воды.
Для анализа отбирают 25 мл анализируемой воды в коническую колбу вместимостью 100 мл с притертой пробкой и добавляют 15 мл 2 М карбоната натрия. Одновременно в другую колбу наливают 10 мл раствора паранитроанилина и приливают по каплям (около 8 капель) 2%-ный раствор нитрита натрия до обесвечивания раствора.
Полученный раствор диазопаранитроанилина вливают в рабочую пробу и через 5 минут измеряют оптическую плотность (абсорбцию) в кювете на 50 мм при длине волны 540 нм.
Контрольная проба готовится в другой конической колбе одновременно: вносится 25 мл дистиллированной воды, 15 мл 2 М карбоната натрия и 10 мл раствора паранитроанилина. Измерение оптической плотности производится в тех же условиях, что и рабочий раствор. По значению измеренной оптической плотности по калибровочному графику определяют концентрацию фенола в анализируемой воде
Если результат измерения оптической плотности выйдет за пределы калибровочного графика, то есть концентрация фенола в анализируемой воде окажется выше 4 мг/л, то предварительно делается разведение анализируемой воды дистиллированной водой, которое учитывается при подсчете результата определения.
Расчет массовой доли фенолов в анализируемой вводе производится по формуле:
ω (ф) = С ⋅ Р
где ω (ф) – массовая доля фенолов в анализируемой воде, мг/л; С – массовая доля фенолов (мг/л) по калибровочному графику; Р – разбавление дистиллированной водой анализируемой воды.
4. Оценка качества анализированной воды.
В соответствии с требованиями стандарта данного предприятия в сточных водах производственных очистных сооружений массовая доля фенолов, мг/л, не должна превышать 800 мг/л.
Сопоставив рассчитанную массовую долю фенолов в анализируемой воде ω (ф) с указанной нормой стандарта, формулируют вывод о качестве очистки сточной воды.
5. Содержание отчета.
Отчет о работе должен содержать:
1. Цель работы.
2. Краткое описание методики определения и уравнения реакций.
3. Данные измерения оптической плотности стандартных растворов в таблице по форме 7 для построения калибровочного графика.
4. Калибровочный график зависимости оптической плотности эталонных растворов от их концентрации.
5. Результаты измерения оптической плотности анализируемой сточной воды.
6. Расчет массовой доли фенолов в анализируемой сточной воде.
7. Оценку качества очистки анализированной сточной воды, очищенной от смол, разбавленной технической водой до определенной концентрации фенолов после установки обессмоливания.
7.2 Определение фенола методом броматометрического титрования
Теория броматометрического метода анализа.
Для титрования неорганических и органических соединений в практике аналитической химии используют бром и бромат калия. Бромат является более сильным окислителем по сравнению с бромом поэтому в качестве титранта преимущественно применяют раствор бромата.
Титрование стандартным раствором бромата основано на окислении восстановителей – олова(II), мышьяка(III), сурьмы(III), селена(IV), гидроксиламина, производных гидразина и т.п. в кислой среде и может быть осуществлено прямым и обратным методами. Наряду с реакциями окисления – восстановления в присутствии бромидов наблюдаются также реакции присоединения брома и замещение бромом, который образуется в процессе взаимодействия бромата с бромидом в кислой среде. Поэтому очень часто титрование производят раствором смеси бромата и бромида калия в отношении 1:5.
В методе прямого титрования определение точки эквивалентности осуществляют визуально по изменению окраски титруемого раствора, индикаторным методом (органические азокрасители) и инструментальными методами. В методе обратного титрования конечную точку титрования определяют, как правило, индикацией конца титрования избытка брома в присутствии индикатора – крахмал-иодид.
Техника титрования
Титрование проводят в кислой среде в присутствии хлористоводородной или серной кислоты, способствующих мгновенному выделению брома. Во многих случаях для улучшения растворимости анализируемого продукта наряду с водой применяют и неводные растворители (безводную уксусную кислоту, спирты и др.). Во избежание улетучивания свободного брома титрование, как правило, проводят при комнатной температуре, а иногда и при 0 °С. В особых случаях медленно протекающих реакций окисления – восстановления прибегают к нагреванию титруемого раствора до 40 – 70 °С. Для предотвращения потерь брома титрование проводят в конических колбах, снабженных стеклянными притертыми пробками. Для ускорения реакций в титруемый раствор добавляют катализаторы: сульфат марганца или ртути (II), молибдат натрия и др.
В методах обратного титрования очень часто прибегают к постановке холостого опыта для того, чтобы уточнить, какое количество стандартного раствора титранта расходуется на титрование определенного объема реагента. При титровании избытка брома добавляют иодид калия, реагирующий с бромом с выделением йода, который оттитровывают стандартным раствором тиосульфата в присутствии индикатора – крахмала.
Рабочий раствор броматометрии – бромат калия – обычно готовят по точной навеске его кристаллической соли. Препарат КВrО3 получается достаточно чистым после перекристаллизации из воды и высушивания при 150…180 °С. Титр раствора бромата иногда проверяют йодометрическим методом, добавляя KI к отмеренному объему бромата и титруя выделившийся йод тиосульфатом натрия. Водные растворы бромата калия устойчивы неопределенно долго. В практике используют также бромат-бро-мидные нейтральные растворы, содержащие бромат калия точно известной концентрации и примерно пятикратный избыток бромида калия. При подкислении такой раствор выделяет свободный бром в количестве, эквивалентном взятому количеству бромата.
Кроме того, броматометрию применяют для определения многих других неорганических и органических соединений: фенолов и их производных, аминов, аскорбиновой кислоты, 8-оксихинолина (и осаждаемых этими соединениями ионов: Мg2+, А13+, В13+, Fе3+, In3+ и др.), тиомочевины, меркаптанов и т.п.
Широкое применение в броматометрических определениях получила способность свободного брома вступать в реакцию замещения, присоединения и окисления-восстановления с некоторыми органическими соединениями по точному стехиометрическому уравнению без образования каких-либо побочных продуктов. Таким образом, можно отметить два основных типа броматометрических определений. В реакциях первого типа непосредственно используется реакция бромата с определяемым восстановителем, а в реакциях второго типа участвует свободный бром, выделяющийся при взаимодействии бромата с бромидом. В реакциях первого типа также не исключается образование свободного брома как промежуточного продукта реакции, – однако в таких реакциях бромид калия в реагирующую систему не вводят.
C6H5OH + 3Br2 3HBr + C6H2Br3OH
H2C=CH2 + Br2 H2CBr-CBrH2
Индикаторами броматометрии являются азокрасители, такие, как метиловый оранжевый или метиловый красный. В точке эквивалентности происходит необратимое окисление индикатора с образованием бесцветных продуктов. Азокрасители могут окисляться непосредственно броматом, поэтому перед точкой эквивалентности обычно вновь добавляют несколько капель индикатора, который обесцвечивается в точке эквивалентности. Обратимо изменяют свою окраску при проведении броматометрических определений n-этоксихризоидин, – нафтофлавон, хинолиновый желтый и др.
Достоинства и недостатки броматометрического метода.
Броматометрический метод отличается рядом достоинств по сравнению с другими методами.
1. Бромат-бромидные растворы можно применять не только для определения восстановителей и окислителей, но и для анализа органических ненасыщенных, ароматических и гетероциклических соединений, а также для косвенного определения разнообразных ионов, осаждаемых в виде нерастворимых в воде соединений, например в виде оксихинолятов.
2. В отличие от стандартных растворов йода или брома, применяемых для анализа тех же соединений, растворы бромата калия устойчивы и не меняют своего титра в течение продолжительного времени. Поэтому при пользовании броматом получаются более надежные результаты анализа.
3. При введении в бромат-бромидную смесь ионов ртути (II) увеличивается потенциал системы бром – бромид благодаря образованию устойчивых комплексных ионов [HgBr4] 2–; случае превышает. При этом происходит окисление таких ионов и соединений, которые в отсутствие ионов ртути не окисляются бромат-бромидной смесью. Например, хром (III) легко окисляется до хрома (VI) в присутствии ионов ртути (II).
Броматометрический метод имеет также ряд недостатков
1. Вода, присутствующая в растворе или образующаяся в процессе титрования неводных растворов, мешает определению многих органических соединений.
2. Окисление некоторых органических соединений сопровождается нежелательными побочными реакциями гидролиза, замещения и присоединения, вызываемыми действием ионов воды и брома.
3. В ряде случаев реакции бромата калия с органическими веществами протекают не в строго стехиометрических отношениях, что приводит к искажению конечных результатов анализа.
Определение фенола
Большое практическое применение имеет броматометрическое определение фенола. Определение фенола основано на том, что в анализируемый раствор вводится избыток бромат-бромидной смеси, которая в кислой среде выделяет свободный бром. Образующийся бром реагирует с фенолом:
С6Н5ОН + ЗВг2 С6Н2Вг3ОН + 3HBr
При добавлении к этому раствору иодида калия избыточный, не прореагировавший бром окисляет иодид до йода, который титруют стандартным раствором тиосульфата натрия:
Br2 + 2I = 2Br + I2
I2 + 2S2O = 2I + S4O
Реактивы
1. Тиосульфат натрия 0,02 М раствор (или стандартизированный)*
2. Бромат-бромидная смесь.
3. Серная кислота 1М раствор
4. Крахмал, 0,5% раствор
5. Иодид калия, KI (к)
Посуда:
1. Колба мерная 500 мл
2. Колба коническая 250–300 мл
3. Мерный цилиндр 20 мл
4. Пипетки 20 и 25 мл
5. Бюретка 25 мл
Выполнение работы
Бромат-бромидный раствор можно приготовить по навеске: 0,334 г. KBrO3 и 1,2 KBr растворяют в дистиллированной воде и доводят до метки в мерной колбе вместимостью 500 мл, в этом случае концентрация приблизительно равна 0,024 М. Для получения такой же концентрации раствор можно приготовить из фиксанала KBrO3 – KBr 0,1 Н но в этом случае содержимое запаянной ампулы нужно растворить в 4 л дистиллированной воды.
Для анализа отбирают аликвоту (10 мл) раствора, содержащего 0,02–0,4 г/л фенола**, пипеткой в коническую колбу для титрования. Прибавляют 12 мл (пипеткой) бромат-бромидной смеси, 10 мл 1М раствора серной кислоты, закрывают пробкой и оставляют на 30 мин. Затем прибавляют 1 г иодида калия, взвешенного на технических весах, и снова закрывают пробкой. Через 5 мин титруют выделившийся йод раствором тиосульфата натрия, прибавляя в конце титрования, когда окраска раствора станет светло-желтой, 2–3 мл раствора крахмала. Титрование продолжают до исчезновения синей окраски раствора. Проводят три титрования и рассчитывают средний объем V1 из сходящихся результатов.
Определение общей массы брома, выделяющейся из бромат-бромидного раствора, выполняют следующим образом
В чистые конические колбы приливают дистиллированную воду в том же объеме, в каком был взят анализируемый раствор, прибавляют 25 мл (той же пипеткой) бромат-бромидный раствор, 10 мл 1М раствора серной кислоты, закрывают пробкой, выдерживают 30 мин, прибавляют 1 г иодида калия и также через 5 мин оттитровывают выделившийся иод тиосульфатом натрия. Титрование повторяют три раза, находят средний результат V2.
Рассчитывают концентрацию (мг/л) фенола:
где m (1/6С6Н5ОН) – молярная масса эквивалента фенола; Vпр – объем пробы, взятый для анализа.
Результаты эксперимента:
V1, мл 1,45 1,40 1,40 V2, мл 15,4 15,3 15,3
С1= (мг/л)
С2= (мг/л)
С3= (мг/л)
Математическая обработка результатов (P=0,95 tp, n-1=4,30 при n=3), мг/л мг/л 402,41 0,96 400,97 401,45 0,48 0,831 2,06 401,45 2,06 400,97 0,48
На основании данного эксперимента можно сделать вывод о том, что метод броматометрического определения фенола вполне точный, т. к. были получены результаты, удовлетворяющие исходному условию. Оценка данных эксперимента методом математической обработки показала, что погрешность, связанная с различными факторами, присутствует только в третьем знаке после запятой, что допустимо для данного определения.
Важно также отметить, что данный метод достаточно быстрый (~50 мин), простой и не требует больших расходов.
Похожие работы
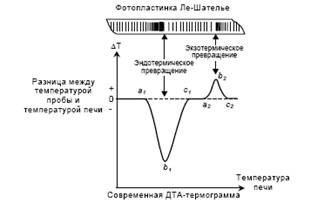
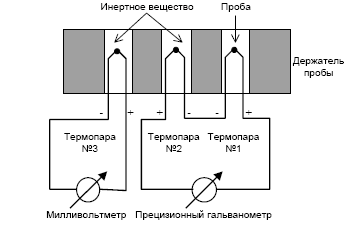
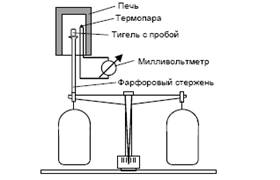
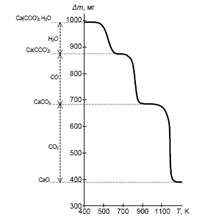
... анализа, что делает его одним из наиболее точных методов (наряду с классическим весовым анализом). 7.2 Дериватография коррозия бетон термических физический превращение Комплексный метод исследования химических и физико-химических процессов, происходящих в образце в условиях программированного изменения температуры, который основан на сочетании дифференциального термического анализа (ДТА) с ...
... свет вещества и толщине слоя раствора, через который он проходит. Закон Бугера - Ламберта - Бера является основным законом светопоглощения и лежит в основе большинства фотометрических методов анализа. Математически он выражается уравнением: или Величину lg I /I0 называют оптuческой плотностью поглощающего вещества и обозначают буквами D или А. Тогда закон можно записать так: ...
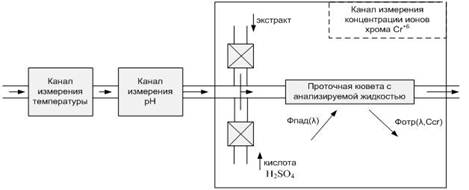
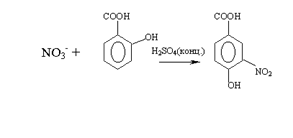
ления тяжелых металлов в природных водах Экстракционно-фотометрический метод определения хрома[16] На протекание естественных процессов в воде большое влияние оказывает содержание в ней тяжелых металлов. Были проведены исследования, целью которых являлась количественная оценка загрязнения реки Кальмиус тяжелыми металлами. Результаты данного исследования показали, что одним из тяжелых металлов ...
... . Сигнал детектора фиксируется регистратором (в виде пиков) и обрабатывается вычислительным интегратором. В ГХ используют детекторы, которые преобразуют в электрический сигнал изменения физических или физико-химических свойств газового потока, выходящего из колонки, по сравнению с чистым газом - носителем. Существует множество детекторов, однако широкое применение находят только те из них, ...


0 комментариев