Навигация
Что было сделано до дня великого открытия
2. Что было сделано до дня великого открытия
Предпосылки открытия периодического закона следует искать в книге Д.И. Менделеева (далее Д.И.) «Основы химии». Первые главы 2-й части этой книги Д.И. написал в начале 1869 г. 1-я глава была посвящена натрию, 2-я – его аналогам, 3-я – теплоемкости, 4-я – щелочноземельным металлам. Ко дню открытия периодического закона (17 февраля 1869 г.) он, вероятно, уже успел изложить вопрос о соотношении таких полярно-противоположных элементов, как щелочные металлы и галоиды, которые были сближены между собой по величине их атомности (валентности), а также вопрос о соотношении самих щелочных металлов по величине их атомных весов. Он вплотную подошел и к вопросу о сближении и сопоставлении двух групп полярно-противоположных элементов по величине атомных весов их членов, что фактически уже означало отказ от принципа распределения элементов по их атомности и переход к принципу их распределения по атомным весам. Этот переход представлял собой не подготовку к открытию периодического закона, а уже начало самого открытия
К началу 1869 г. Значительная часть элементов была объединена в отдельные естественные группы и семейства по признаку общности химических свойств; наряду с этим другая часть их представлял собой разрозненные, стоявшие особняком отдельные элементы, которые не были объединены в особые группы. Твердо установленными считались следующие:
– группа щелочных металлов – литий, натрий, калий, рубидий и цезий;
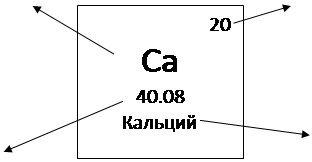
– группа щелочноземельных металлов – кальций, стронций и барий;
– группа кислорода – кислород, сера, селен и теллур;
– группа азота – азот, фосфор, мышьяк и сурьма. Кроме того, сюда часто присоединяли висмут, а в качестве неполного аналога азота и мышьяка рассматривали ванадий;
– группа углерода – углерод, кремний и олово, причем в качестве неполных аналогов кремния и олова рассматривали титан и цирконий;
– группа галогенов (галоидов) – фтор, хлор, бром и йод;
– группа меди – медь и серебро;
– группа цинка – цинк и кадмий
– семейство железа – железо, кобальт, никель, марганец и хром;
– семейство платиновых металлов – платина, осмий, иридий, палладий, рутений и родий.
Сложнее дело обстояло с такими элементами, которые могли быть отнесены к разным группам или семействам:
– свинец, ртуть, магний, золото, бор, водород, алюминий, таллий, молибден, вольфрам.
Кроме того был известен ряд элементов, свойства которых были еще недостаточно изучены:
– семейство редкоземельных элементов – иттрий, «эрбий», церий, лантан и «дидим»;
– ниобий и тантал;
– бериллий;
– торий;
– уран;
– индий.
3. День великого открытия
Д.И. был весьма разносторонним ученым. Он давно и очень сильно интересовался вопросами сельского хозяйства. Он принимал самое близкое участие в деятельности Вольного экономического общества в Петербурге (ВЭО), членом которого он состоял. ВЭО организовало в ряде северных губерний артельное сыроварение. Одним из инициаторов этого начинания был Н.В. Верещагин. В конце 1868 г., т.е. в то время как Д.И. заканчивал вып. 2 своей книги, Верещагин обратился в ВЭО с просьбой прислать кого-нибудь из членов Общества для того, чтобы на месте обследовать работу артельных сыроварен. Согласие на такого рода поездку выразил Д.И. В декабре 1868 г. он обследовал ряд артельных сыроварен в Тверской губернии. Для завершения обследования нужна было дополнительная командировка. Как раз на 17 февраля 1869 г. и был назначен отъезд.
Если бы Д.И. мог наперед знать, что именно 17 февраля он займется новым химическим исследованием и что последующая обработка результатов займет у него столько времени, то вряд ли за 2 дня до открытия он взял бы из университета, где работал, отпускное свидетельство для поездки в ряд губерний, начиная с 17 февраля 1869 г.
Рассмотрим, как прошел день 17 февраля и какие события в жизни и творчестве его наполнили. В связи с этими событиями Д.И, не смог в намеченный срок выехать на сыроварни и был вынужден задержаться в Петербурге до начала марта. Все это время он был занят совершением и обработкой периодического закона и его первичной публикацией в виде таблицы элементов.
Чтобы лучше рассмотреть, как протекало открытие, выделим несколько стадий, которые оно прошло в течение этого одного дня:
1) начальная стадия, когда Д.И. нащупал новый принцип распределения элементов, делая выкладки на только что полученном письме от Ходнева;
2) стадия составления первых двух неполных набросков основной части будущей системы элементов;
3) стадия составления карточек элементов для «химического пасьянса»;
4) решающая стадия – составление полного чернового варианта всей системы;
5) заключительная стадия – переписывание набело только что открытой системы элементов для опубликования ее в печати.
В день отъезда Д.И. получил письмо за подписью секретаря ВЭО А.И. Ходнева. Д.И., по свидетельствам современников часто использовал обратную сторону писем для своих научных изысканий. А поскольку его неотступно преследовала мысль о нахождении общей закономерности свойств элементов, то, неудивительно, что, получив письмо, он стал делать на нем наброски будущей системы элементов.
Д.И. сопоставлял не отдельные элементы, а группы элементов, имеющих сходные свойства. Начал он с сопоставления группы щелочных металлов и галоидов. Затем долго искал переход от щелочных к щелочноземельным металлам. Он предполагал, что между ними должны находится т. наз. «переходные» металлы (Cu, Ag, Hg), а затем все же поставил щелочноземельные металлы после щелочных, минуя переходные.
Далее последовали две неполные таблички элементов, составленные на одном листе бумаги, в которых Д.И. продолжал составлять из групп элементов и отдельных элементов, не вошедших в группы, варианты будущей таблицы.
Решающим шагом к открытию периодического закона стало то, что Д.И. попытался сопоставить по величине атомных весов группы несходных элементов. Изначально Д.И. предполагал строить свою систему на основе принципа атомности (валентности) элементов. Однако затем он перешел к принципу распределения на основе величины атомной массы элементов. Тем не менее, принцип атомности не был отброшен, он применялся вкупе с новым принципом. Так, Менделеев выстраивал свои групп на основе не только общности химических свойств элементов, но и на основе их одинаковой валентности. А при составлении будущих периодов таблицы, он отмечал закономерное изменение валентности от1 до 4 при переходе от Li к C, а затем вновь до 1 при переходе к F.
При составлении нижней неполной таблички элементов для Д.И. становилось ясно, что решена была только первая, далеко не самая сложная задача – размещение уже довольно изученных элементов в центральной части будущей таблицы. Предстояла же самая сложная и трудная часть задачи с размещением элементов на периферии формирующейся системы.
В результате составления набросков двух неполных табличек элементов на отдельном листке бумаги выявилось несовершенство метода, примененного для выработки полной таблицы элементов, которая должна была охватить собой все элементы. При неясности положения того или иного элемента, этот элемент приходилось бы передвигать не один раз с места на место; тогда табличка заполнялась бы вычеркиваниями и поправками, что не дало бы возможности быстро ориентироваться при размещении новых элементов. Нужно было найти какой-то более гибкий, более подвижный способ, который позволял бы в любой момент видеть картину распределения элементов как бы в чистом виде, не заслоненную предшествующими переносами, исправлениями и зачеркиваниями. Такой прием Д.И, нашел в карточках с написанными на них элементами. Такие карточки легко можно было переставлять, имея перед глазами всю картину распределения элементов, достигнутого в данный момент. Вместе с тем можно было в любой момент обозревать карточки тех элементов, которые еще не попали в таблицу. Так возник прием, который А.Е. Ферсман очень удачно назвал «пасьянсом».
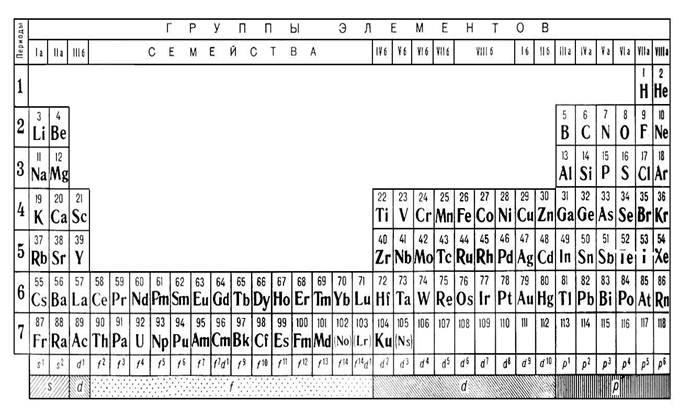
Все 63 карточки Д.И. разделил на четыре категории по признаку их распространенности и изученности. В 1-ю категорию попало 14 элементов, которые распространены повсеместно и составляют главный материал видимых тел: Al, C, Ca, Cl, Fe, H, K, Mg, N, Na, O, P, S, Si. В силу своей распространенности, эти элементы должны были входить в число хорошо исследованных. Во 2-ю категорию попали такие элементы (21), которые встречаются в свободном виде или в виде соединений, хотя и не распространены повсюду или встречаются в малых количествах: Ag, As, Au, B, Ba, Bi, Br, Co, Cr, Cu, F, Hg, I, Mn, Ni, Pb, Pt, Sb, Sn, Sr, Zn. Эти элементы также должны были входить в число хорошо изученных. В 3-ю категорию вошло 18 элементов редких, но хорошо исследованных: Be, Ce, Cd, Cs, In, Ir, Li, Mo, Os, Pd, Rb, Se, Te, Tl, Ur, Wo, Y. В 4-ю категорию вошло 10 элементов редких и мало исследованных: Di, Er, La, Nb, Rh, Ru, Ta, Th, Va, Zr. В дальнейшем Д.И. мог сделать некоторые перестановки элементов между первыми тремя категориями и последней категорией. Когда карточки всех 63 элементов были готовы, Д.И. не прибегая еще к «химическому пасьянсу», установил порядок включения в свою готовящуюся систему отдельных категорий элементов. Но так как все элементы были изображены теперь на карточках, то можно предположить, что разбивка их на различные категории выражалась в разбивке карточек на несколько кучек. Вероятно, в первую очередь в таблицу должны были войти наиболее изученные элементы, причем те, связи между которыми были бесспорно выяснены на предшествующей стадии открытия периодического закона. При определении порядка включения элементов в таблицу признак распространенности не имел существенного значения, тогда как решающее значение приобретал атомный вес. Сначала вносились в таблицу более легкие, а затем – более тяжелые элементы. Первая кучка – наиболее изученные элементы; следующие за ней две кучки – менее изученные элементы; из них вторая – «легкие», третья – «тяжелые» элементы; четвертая – слабо изученные элементы. Разбив карточки всех элементов на кучки, Д.И. определил этим общую последовательность составления таблицы элементов.
К моменту раскладывания «пасьянса» открытие периодического закона вступило в свою решающую фазу. Определяющая роль атомного веса при сопоставлении групп несходных элементов выяснилась в полной мере. Центральная часть будущей системы элементов сформировалась в своей основе. Осталось «только» одно: доказать всеобщий характер того принципа, который уже был доказан в его применении к центральной части таблицы. Но это «только» составляло главную, непреодолимую еще трудность при создании периодической системы элементов.
При доведении до конца построения своей таблицы элементов Д.И. продолжил применять тот же прием сопоставления групп несходных элементов, с помощью которого он начал строить эту таблицу в первых записях, сделанных на письме Ходнева, и в обеих неполных табличках. Так, путем преставления карточек элементов на основе имеющихся уже сведений, и был открыт периодический закон.
Когда периодический закон был открыт, и была составлена система элементов в первом ее варианте, оставалось оформить достигнутый результат в виде чистой таблицы, по которой другие ученые могли бы ознакомиться с открытием, сделанным Д.И. При переписывании таблицы набело Д.И. внес следующие изменения: элементы в ней располагались не в порядке убывания, а в порядке возрастания атомных весов, т.е. более тяжелые элементы подписывались под более легкими, а на тех местах, где были пропуски и где можно было предполагать не известные еще элементы, Д.И. поставил знак вопроса и предположительно вычислил атомные веса.
Отдав в типографию для набора рукопись «Опыта системы элементов», Д.И. не мог уехать из Петербурга на сыроварни до тех пор, пока не пришла корректура. Для набора требовалось время, и это время Д.И. использовал для того, чтобы обобщить и обработать сделанное им открытие в виде статьи, изложив в ней то, что было заключено в «Опыте системы элементов». К моменту написания статьи Д.И. составил уже много различных вариантов системы элементов, основанной на их атомном весе. Свою статью он озаглавил «Соотношение свойств с атомным весом элементов»
В своей статье Д.И. писал: «Убедясь предыдущею таблицею в том, что атомный вес элементов может служить опорою их системы, я первоначально расположил элементы в непрерывном порядке по величине атомного веса и тотчас заметил, что существуют некоторые перерывы в ряду таким образом поставленных элементов». Анализируя это и другие высказывания Д.И., можно сделать вывод о том, что Д.И. сначала составил свой «Опыт системы элементов» (путем сопоставления групп элементов), а затем убедился, что атомный вес может являться основой системы элементов. После этого Д.И. приступил к дальнейшему исследованию открытой им закономерности, и это свое дальнейшее исследование начал с того, что расположил все элементы в непрерывный ряд по возрастанию их атомных весов. Это опровергает мнение некоторых химиков, будто сначала Д.И. составил общий ряд элементов по величине их атомного веса, и только после этого он заметил периодичность в изменении свойств; затем он разделил общий ряд на периоды и составил из этих отрезков свой «Опыт системы элементов». Все содержание статьи неоспоримо свидетельствует о том, что в этой статье Д.И. отразил, обобщил и подытожил тот путь, каким он шел в день 17 февраля 1869 г. При создании периодической системы элементов.
Похожие работы
... периодов, начиная с четвёртого. В главных подгруппах сверху вниз металлические свойства усиливаются, а не металлические свойства ослабляются. Все элементы побочных подгрупп являются металлами. 2.4 Периодический закон и его обоснование Периодический закон позволил привести в систему и обобщить огромный объем научной информации в химии. Эту функцию закона принято называть интегративной. ...
... разовая) – 0,01%. 4 Содержание Введение......................................................................................................................4 Глава 1. Межпредметные связи в курсе школьного предмета химии на примере углерода и его соединений.......................................................................5 1.1 Использование межпредметных связей для формирования у учащихся ...
... удобрений в Смоленской, Петербургской, Московской и Симбирской губерниях. Менделеев уделял большое внимание орошению земель Нижнего Поволжья. 6. Участие ученого в аэродинамике и гидродинамике. Дмитрий Иванович Менделеев всегда служил образцом ученого, тесно связывающего свои открытия с их промышленными приложениями, в частности, не отрывал свои научные интересы в области аэродинамики от ...
... , имеющая дело со строением атомов и исследующая неизвестные до того времени силы и взаимодействия частиц в ядре атома. Три открытия 1932 г. считаются особенно важными для дальнейшего развития атомной и ядерной физики: 1. открытие нейтрона; 2. обнаружение позитрона К. Андерсоном в космических лучах. Это была первая открытая учеными античастица; 3. открытие американским химиком Г. ...





0 комментариев