
 |
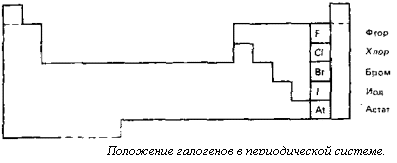
Всем известно, что фтор вводят в состав зубной пасты, а хлором дезинфицируют воду в плавательных бассейнах. Бром применяют в качестве успокоительного средства, а спиртовой раствор йода как антисептическое средство. Фтор, хлор, бром и йод образуют семейство галогенов. Галогены относятся к неметаллическим элементам. Они входят в VII группу периодической системы (см. рис.).
 |
О происхождении названий галогенов
Названия всех галогенов, за исключением фтора, происходят от греческих слов:
| Название | Исходное слово | Значение |
| Галоген | галс (греч.) ген (греч.) | Соль Образующий |
| Фтор | флуо (лат.) | Течь, текучий (в старину минерал полевой шпат CaF, использовали в металлургии в качестве флюса для придания легкоплавкости шлакам) |
| Хлор | хлорос (греч.) | Зеленовато-желтый |
| Бром | бромос (греч.) | Зловонный |
| Иод | иодес (греч.) | Фиолетовый |
| Астат | астатос (греч.) | Неустойчивый |
Слог «ген» в качестве приставки либо суффикса входит во многие научные термины, например в слова генератор и антиген. Обычно он означает рост или образование чего-либо. Таким образом, слово галоген (гало + ген) означает «образующий соль».
ЭЛЕКТРОННАЯ СТРУКТУРА АТОМОВ ГАЛОГЕНОВ
Атомы всех галогенов имеют во внешней оболочке семь электронов. Они легко присоединяют еще один электрон, образуя галогенидные ионы. Галогенид-ион имеет устойчивый октет электронов. Галогены характеризуются высокой электроотрицательностью и реакционной способностью и поэтому в свободном виде не встречаются в природе. Однако галогенид-ионы широко распространены в природе.
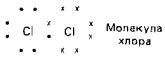
Галогены в свободном виде существуют в форме двухатомных молекул. Атомы в этих молекулах связаны между собой простой ковалентной связью. Каждая такая связь образуется в результате обобществления пары электронов - по одному от каждого атома:
В табл. 1 приведены некоторые данные о структуре атомов и молекул галогенов. Обратим внимание на то, что атомные и ионные радиусы галогенов, а также длины связи в их молекулах последовательно возрастают при перемещении к нижней части группы. Однако энергии диссоциации связи и, следовательно, прочность связи в молекулах галогенов при этом, наоборот, уменьшаются. Исключением в этом отношении является только фтор. Небольшая прочность связи фтора, по-видимому, обусловлена слишком близким расположением атомов в его молекуле. Это приводит к сильному отталкиванию между несвязывающими электронами, что вызывает ослабление связи.
Таблица 1. Электронное строение и свойства галогенов
| Элемент | Атомный номер | Электронная конфигурация атомов | Конфигурация внешней оболочки | Атомный радиус, нм | Ионный радиус, нм | Длина связи, нм | Энергия диссоциации связи, кДж/моль |
| Фтор | 9 | 2.7 | 2s22p5 | 0,072 | 0,136 | 0,142 | 158 |
| Хлор | 17 | 2.8.7 | Зs23p5 | 0,099 | 0,181 | 0,200 | 242 |
| Бром | 35 | 2.8.18.7 | 4s24р5 | 0,114 | 0,195 | 0,229 | 193 |
| Иод | 53 | 2.8.18.18.7 | 5s25р5 | 0,133 | 0,216 | 0,266 | 151 |
ЛАБОРАТОРНЫЕ МЕТОДЫ ПОЛУЧЕНИЯ ГАЛОГЕНОВ
Хлор. Хлор можно получить в лабораторных условиях окислением концентрированной соляной кислоты манганатом(VII) калия:
![]()
Выделяющийся хлор пропускают через воду, чтобы удалить следы хлороводородов, а затем через концентрированную серную кислоту, чтобы осушить его. Полученный хлор собирают в перевернутом сосуде, из которого он вытесняет воздух.
Другой способ лабораторного получения хлора основан на реакции между отбеливающим порошком (гипохлоритом кальция) и разбавленной соляной кислотой:
![]()
Бром. Для получения брома в лабораторных условиях добавляют оксид марган-Ha(IV) к смеси концентрированной серной кислоты с бромидом калия. Бромоводород-ная кислота, обоазуюшаяся в оеакции между сеоной кислотой и бромидом калия:
![]()
окисляется оксидом марганца(IV)
![]()
Бром отделяют от реакционной смеси перегонкой.
Иод. Иод получают тем же способом, что и бром, только вместо бромида калия используется иодид калия. Полученный иод отделяют от реакционной смеси возгонкой.
ФИЗИЧЕСКИЕ И БИОЛОГИЧЕСКИЕ СВОЙСТВА
Все галогены - токсичные вещества.
Отравление хлором. Жидкий хлор вызывает серьезные ожоги кожи. Газообразный хлор оказывает сильное раздражающее действие, особенно на глаза и дыхательную систему. Он реагирует с водой, содержащейся в глазах, легких и слизистых оболочках органов дыхания, образуя соляную кислоту и хлорноватистую кислоту (см. ниже «Реакции с водой и щелочами»). Симптомами отравления хлором являются жжение глаз и органов дыхания, непрекращающийся кашель и, в тяжелых случаях, кровавая мокрота. В легких, отравленных хлором, может развиваться бронхиальная пневмония. Предельно допустимая концентрация хлора в воздухе составляет 0,005 мг/дм3. Уровень 0,2 мг/дм3 считается опасным, а концентрация 2 мг/дм3 может вызвать быструю смерть. Однако случаи отравления хлором со смертельным исходом в аварийной обстановке нечасты, поскольку людей, надышавшихся этим газом, обычно удается вовремя удалить из отравленной зоны.
Галогены имеют характерный резкий запах, хорошо знакомый тем, кто посещает плавательные бассейны.
Все галогены имеют большую летучесть. Она объясняется тем, что их молекулы удерживаются вместе лишь слабыми вандерваальсовыми силами. Хотя вандерваальсовы силы постепенно возрастают при перемещении к нижней части группы галогенов, они остаются очень слабыми даже в кристаллах иода, которые поэтому легко возгоняются при нагревании. При этом образуются фиолетовые пары иода. Температуры плавления и кипения галогенов указаны в табл. 2.
Таблица 2. Физические свойства галогенов
| Элемент | Температура плавления, °С | Температура кипения, °С | Агрегатное состояние и внешний вид при 20°С |
| Фтор | -220 | -188 | Бледно-желтый газ |
| Хлор | -101 | -34 | Желто-зеленый газ |
| Бром | -7 | 58 | Коричневая жидкость с тяжелыми коричневыми парами |
| Иод | 114 | 183 | Блестящие серо-черные кристаллы |
Все галогены - окрашенные вещества. Интенсивность их окраски возрастает по мере перемещения к нижней части группы.
Галогены обладают небольшой растворимостью в воде. Раствор хлора в воде называется хлорной водой. Галогены хорошо растворяются в органических растворителях, образуя окрашенные растворы. Например, хлор растворяется в тетрахлоро-метане, образуя желтый раствор, бром образует красный раствор, а иод-фиолетовый.
РЕАКЦИОННАЯ СПОСОБНОСТЬ ГАЛОГЕНОВ
Галогены представляют собой наиболее реакционноспособную группу элементов в периодической системе. Они состоят из молекул с очень низкими энергиями диссоциации связи (см. табл. 1), а их атомы имеют во внешней оболочке семь электронов и поэтому очень электроотрицательны. Фтор-наиболее электроотрицательный и наиболее реакционноспособный неметаллический элемент в периодической системе. Реакционная способность галогенов постепенно уменьшается при перемещении к нижней части группы. В следующем разделе будет рассмотрена способность галогенов окислять металлы и неметаллы и показано, как эта способность уменьшается в направлении от фтора к иоду.
ГАЛОГЕНЫ КАК ОКИСЛИТЕЛИ
При пропускании газообразного сероводорода через хлорную воду происходит осаждение серы. Реакция протекает по уравнению
![]()
В этой реакции хлор окисляет сероводород, отнимая у него водород. Хлор окисляет также железо (II) до железа (III). Например, если перемешивать встряхиванием хлор с водным раствором сульфата железа (II), образуется сульфат железа (III):
![]()
Происходящая при этом окислительная полуреакция описывается уравнением
![]()
В качестве другого примера окислительного действия хлора приведем синтез хлорида натрия при сжигании натрия в хлоре:
![]()
В этой реакции происходит окисление натрия, поскольку каждый атом натрия теряет электрон, образуя ион натрия:
![]()
Хлор присоединяет эти электроны, образуя хлорид-ионы:
![]()
Таблица 3. Стандартные электродные потенциалы галогенов
| Электродная реакция | Стандартный электродный потенциал Е°, В |
| F2 (г.)+2e–«2F– (водн.) | +2,87 |
| Cl2 (г.)+2e–«2Cl– (водн.) | +1,36 |
| Br2 (ж.)+2e–«2Br– (водн.) | +1,09 |
| I2 (тв.)+2e–«2I– (водн.) | +0,54 |
Таблица 4. Стандартные энтальпии образования галогенидов натрия
| Галогенид | Стандартная энтальпия образования, DH°обр, m, кДж/моль |
| NaF | -573 |
| NaCl | -414 |
| NaBr | -361 |
| Nal | -288 |
Окислителями являются все галогены, из них фтор-самый сильный окислитель. В табл. 3 указаны стандартные электродные потенциалы галогенов. Из этой таблицы видно, что окислительная способность галогенов постепенно уменьшается в направлении к нижней части группы. Эту закономерность можно продемонстрировать, добавляя раствор бромида калия в сосуд с газообразным хлором. Хлор окисляет бромид-ионы, в результате чего образуется бром; это приводит к появлению окраски у прежде бесцветного раствора:
![]()
Таким образом, можно убедиться, что хлор более сильный окислитель, чем бром. Точно так же, если смешать раствор иодида калия с бромом, образуется черный осадок из твердого иода. Это означает, что бром окисляет иодид-ионы:
![]()
Обе описанные реакции являются примерами реакций вытеснения (замещения). В каждом случае более реакционноспособный, то есть являющийся более сильным окислителем, галоген вытесняет из раствора менее реакционноспособный галоген.
Окисление металлов. Галогены легко окисляют металлы. Фтор легко окисляет все металлы, исключая золото и серебро. Мы уже упоминали о том, что хлор окисляет натрий, образуя с ним хлорид натрия. Приведем еще один пример: когда поток газообразного хлора пропускают над поверхностью нагретых железных опилок, образуется хлорид железа (III), твердое коричневое вещество:
![]()
Даже иод способен, хотя и медленно, окислять металлы, расположенные в электрохимическом ряду ниже его. Легкость окисления металлов различными галогенами уменьшается при перемещении к нижней части VII группы. В этом можно убедиться, сравнивая энергии образования галогенидов из исходных элементов. В табл. 4 указаны стандартные энтальпии образования галогенидов натрия в порядке перемещения к нижней части группы.
Окисление неметаллов. За исключением азота и большинства благородных газов, фтор окисляет все остальные неметаллы. Хлор реагирует с фосфором и серой. Углерод, азот и кислород не вступают в реакции непосредственно с хлором, бромом или иодом. Об относительной реакционной способности галогенов к неметаллам можно судить, сравнивая их реакции с водородом (табл. 5).
Окисление углеводородов. При определенных условиях галогены окисляют углеводороды. Например, хлор полностью отщепляет водород от молекулы скипидара:
![]()
Окисление ацетилена может протекать со взрывом:
![]()
Таблица 5. Реакции галогенов с водородом
| Реакция | Характер и условия протекания |
| Н2(г.)+F2(г.) ® 2НF (г.) | Протекает со взрывом |
| Н2(г.)+Сl2(г.) ® 2НСl (г.) | Протекает со взрывом на свету, но медленно в темноте |
| Н2(г.)+Вr2(г.) ® 2НВr (г.) | Протекает только при нагревании и в присутствии катализатора |
| Н2(г.)+I2(г.) ® 2НI (г.) | Протекает медленно даже при нагревании |
Реакции с водой и щелочами
Фтор реагирует с холодной водой, образуя фтороводород и кислород:
![]()
Хлор медленно растворяется в воде, образуя хлорную воду. Хлорная вода имеет небольшую кислотность вследствие того, что в ней происходит диспропорционирование хлора с образованием соляной кислоты и хлорноватистой кислоты:
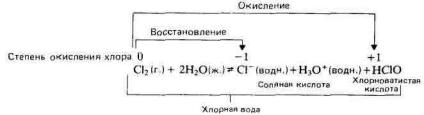
Бром и иод диспропорционируют в воде аналогичным образом, но степень диспропорционирования в воде уменьшается от хлора к иоду.
Хлор, бром и иод диспропорционируют также в щелочах. Например, в холодной разбавленной щелочи бром диспропорционирует на бромид-ионы и гипобромит-ионы (бромат (I)-ионы):
![]()
При взаимодействии брома с горячими концентрированными щелочами диспропорционирование протекает дальше:
![]()
Иодат (I), или гипоиодит-ион, неустойчив даже в холодных разбавленных щелочах. Он самопроизвольно диспропорционирует с образованием иодид-иона и иодат(V)-иона.
Реакция фтора со щелочами, как и его реакция с водой, не похожа на аналогичные реакции других галогенов. В холодной разбавленной щелочи протекает следующая реакция:
![]()
В горячей концентрированной щелочи реакция с фтором протекает так:
![]()
Анализ на галогены и с участием галогенов
Качественный и количественный анализ на галогены обычно выполняется с помощью оаствора нитрата серебра. Например
![]()
Для качественного и количественного определения иода может использоваться раствор крахмала. Поскольку иод очень мало растворим в воде, его обычно анализируют в присутствии иодида калия. Так поступают по той причине, что иод образует с иодид-ионом растворимый трииодидный ион I3–:
![]()
Растворы иода с иодидами используются для аналитического определения различных восстановителей, например тиосульфат (VI)-ионов, а также некоторых окислителей, например манганат(VII)-ионов. Окислители смещают указанное выше равновесие влево, высвобождая иод. Иод затем титруют тиосульфатом (VI).
Похожие работы
... в небольшом избытке. Полученная смесь HCI и MgCI2используется для демонстрации опытов: а) кислота + металл: 2HCI(MgCI2) + Mg = MgCI2+H2; б) основание + кислота: Mg(OH)2+2HCI(MgCI2) = MgCI2+2H2O; в) соль + кислота: MgCO3+2HCI(MgCI2) = MgCI2+CO2+H2O. Далее растворы MgCI2 отфильтровать и использовать в качестве реактива; магний, Mg(OH)2и MgCO3 высушить и поместить в соответствующие склянки. ...
шли широкое применение в производстве галогенных ламп бромистый метил (СН3Вг) и бромидный метилен (СН2Вг2). 2 Технологический процесс изготовления кварцевой галогенной лампы 2.1 Физические свойства кварцевого стекла и методы его обработки Значительное уменьшение габаритных размеров галогенных ламп и необходимость создания условий для действия галогенного цикла потребовали наличия высоких ...
... и, конечно же, за многими другими, которые будут получены, — будущее. В этом направлении и работают многие НИИ и исследователи. Аспекты поиска новых лекарств, изыскание новых лекарственных веществ состоит из трех основных этапов: химический синтез, установление фармакологической активности и безвредности (токсичности). Такая стратегия поиска с большой затратой времени, реактивов, животных, труда ...
... образом, чтобы не возникал избыток нитрозирующего агента. диазотирования – первая стадия синтеза азокрасителей, а также р-ций Зандмейера, Гомберга, Шимана, Гаттермана, Несмеянова, Барта, Меервейна. Диазотирование открыто П. Гриссом в 1858. Нитрование Введение нитрогруппы – NO2 в молекулы органических соединений. Может проходить по электрофильному, нуклеофильному и радикальному механизмам; ...

0 комментариев