Навигация
Вода. Растворы. Основания. Галогены
Лабораторная работа
Эксперимент по теме: "Вода. Растворы. Основания"
Опыт 1. Взаимодействие натрия с водой.
Оборудование и реактивы: Штатив с лапкой, пробирки, воронка, натрий, дистиллированная вода, скальпель, пинцет, фильтры, фенолфталеин, лучинка.
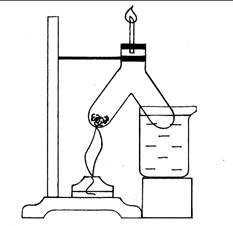
Ход работы: Пробирку с водой закрепляют вертикально в лапке штатива. В воду бросают очищенный при помощи фильтровальной бумаги и скальпеля кусочек металлического натрия величиной с полгорошины и накрывают пробирку воронкой. Выжидают некоторое время с целью заполнения водородом пробирки и воронки. Затем газ поджигают у конца воронки пламенем горящей лучинки. Когда весь натрий прореагирует, то в воду капают раствор фенолфталеина, чтобы показать образование щелочи (малиновая окраска). Пробирку заполняют водой так, чтобы остался свободный объем примерно на 1–2 см от края пробирки. Наблюдать и объяснить происходящие эффекты. Записать уравнение реакции.
Техника безопасности: Не трогать руками металлический натрий. Остатки натрия вместе с фильтровальной бумагой погрузить в кристаллизатор с водой.
Утилизация: Содержимое пробирки слить в емкость-нейтрализатор, т.е. в емкость со щелочным раствором.
Опыт 2. Взаимодействие натрия с водой в кристаллизаторе
Оборудование и реактивы: Кристаллизатор, фильтровальная бумага, металлический натрий, пластинка (крышка для кристаллизатора), зеркало, вода, скальпель, пинцет, фенолфталеин.
Ход работы: В кристаллизатор с водой и фенолфталеином помещают фильтровальную бумагу. На влажную фильтровальную бумагу бросают кусочек натрия размером 1/2 горошины. Накрывают кристаллизатор стеклянной пластиной. Подставляют зеркало и наблюдают происходящие явления (дети сидят за партой). Разъяснить происходящие явления.
Техника безопасности: Фильтровальную бумагу, на которой резали натрий, нельзя выбрасывать в мусорный ящик во избежание возникновения пожара. Нужно положить ее в кристаллизатор с водой, чтобы остатки натрия прореагировали с водой. Не брать руками металлический натрий. Пластина служит для предохранения от разбрызгивания жидкости в кристаллизаторе. Установку после демонстрации ставят под вытяжку.
Утилизация: см. опыт 1.
Опыт 3. Взаимодействие магния с водой
Оборудование и реактивы: Пробирка, штатив с лапкой, спиртовка, спички, порошок магния, речной песок, стеклянная палочка, стеклянная трубочка, мерная пипетка на 2 мл, противень с песком, дистиллированная вода.
Ход работы: В пробирку при помощи пипетки наливают около 1 мл воды так, чтобы не замочить водой внутренние стенки пробирки. Затем насыпают такое количество речного песка, чтобы поглотилась вся вода. В этом случае пробирку можно держать горизонтально. При помощи стеклянной трубочки в пробирку вносят немного порошка магния, располагая его у края отверстия пробирки. Пробирку закрепляют в лапке штатива дном немного выше отверстия. Сильно прогревают магний до воспламенения. Как только вспыхнет магний, нагревают влажный песок. Пары воды проходят над магнием. Магний эффектно взаимодействует с водой. Выделяющийся водород загорается, пламя выходит из отверстия пробирки. После прекращения реакции между магнием и водой пробирку охлаждают и разбирают. Написать уравнения реакций, объяснить наблюдаемые явления.
Техника безопасности: Под прибор подставляем противень во избежание возгорания магния на столе при растрескивании пробирки. Не держать спиртовку руками при нагревании магния и песка.
Утилизация. В результате опыта, образуется белый оксид магния: 2Мg+O2 =2MgO. Оксид собрать в склянку и использовать для демонстрации свойств основных оксидов: а) MgO+2HCI=MgCI2+H2O;
б) MgO+H2O=Mg(OH)2 - при нагревании в присутствии фенолфталеина появляется малиновая окраска (тема «Металлы главных подгрупп I–III групп периодической системы», IX класс).
В опыте с соляной кислотой – кислоту брать в небольшом избытке. Полученная смесь HCI и MgCI2используется для демонстрации опытов: а) кислота + металл: 2HCI(MgCI2) + Mg = MgCI2+H2;
б) основание + кислота: Mg(OH)2+2HCI(MgCI2) = MgCI2+2H2O;
в) соль + кислота: MgCO3+2HCI(MgCI2) = MgCI2+CO2+H2O.
Далее растворы MgCI2 отфильтровать и использовать в качестве реактива; магний, Mg(OH)2и MgCO3 высушить и поместить в соответствующие склянки.
Опыт 4. Приготовление растворов с заданной молярной концентрацией
Оборудование и реактивы: Весы с разновесом, мерная колба на 200 мл, воронка сульфат натрия кристаллический, дистиллированная вода.
Ход работы: Приготовить раствор сульфата натрия объемом 200 мл молярной концентрацией 0,5 моль/л.
Дано:
Сm = 0,5 моль/л
Vр-ра= 0,2 л
Найти: m (Na2SO4) – ?
Решение: Mr (Na2SO4) = 142
М (Na2SO4) =142 г./моль
Сm = v (Na2SO4) / Vр-ра (л)
v = m / M
Cm = m (Na2SO4) / M. 1 /Vр-ра (л)
m = Cm. Vр-ра. M = 0,5 моль/л. 0,2 л. 142 г./моль=14,2 г
Сульфат натрия массой 14,2 г переносят в колбу на 200 мл с помощью воронки и растворяют в небольшой порции воды. При постоянном перемешивании раствора в колбе постепенно объем воды доводят до метки 200 мл.
Опыт 5. Приготовление растворов с заданной массовой долей растворенного вещества
Оборудование и реактивы: Весы с разновесом, химический стакан, стеклянная палочка, шпатель, хлорид натрия, мерный цилиндр.
Ход работы: Приготовить раствор хлорида натрия массой 150 г. массовой долей 5%.
Дано: Решение:
m (р-ра) = 150 г. w%(NaCl) = m (NaCl).100% / m (р-ра)
w%(NaCl) = 5% m(NaCl) = w%(NaCl). m (р-ра) / 100%
Найти: m(NaCl) = 7,5 г
m(NaCl) – ? m(H2O) = 150 – 7,5 = 142,5 г
m(H2О) – ? V (H2О) =142,5 г / 1г/мл = 142,5 мл
Хлорид натрия массой 7,5 г помещают в химический стакан. Отмерить 142,5 мл воды. Добавить в стакан с хлоридом натрия массой 7,5 г воды объемом 142,5 мл. Размешать стеклянной палочкой с резиновым наконечником.
Утилизация. Готовят необходимые для лаборатории растворы.
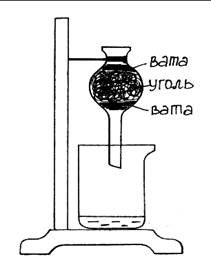
Опыт 6. Очистка воды перегонкой
Оборудование и реактивы: Круглодонная колба, газоотводная трубка, стакан, электрическая плитка, вода, загрязненная почвой, ткань.
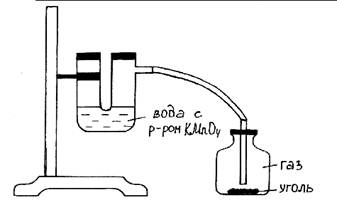
Ход работы: Собрать прибор как показано на рис. 19. На трубку повесить ткань, периодически смачивать ее холодной водой. Избыток воды стекает в кристаллизатор. Чтобы вода не стекала по трубке, на нее надевают пробку. Круглодонную колбу с загрязненной водой нагревают на плитке. Чистая (дистиллированная) вода собирается в химический стакан.
Техника безопасности: Перед включением плитки проверить целостность шнура и вилки.
Опыт 7. Взаимодействие кальция с водой
Оборудование и реактивы: Кристаллизатор, цилиндр, кальций, фильтры, пинцет, скальпель, стеклянная пластинка, спиртовка, спички, лучина, фенолфталеин.
Ход работы: В кристаллизатор с водой ставят вверх дном цилиндр, заполненный водой. Кусочек кальция, очищенный от продуктов окисления, немного прополаскивают в воде пинцетом и подводят его в цилиндр с водой. В кристаллизатор капают фенолфталеин. Кальций взаимодействует с водой, в цилиндре накапливается водород. После полного заполнения цилиндра водородом, его закрывают под водой стеклянной пластинкой, переворачивают и ставят на стол. На вытянутой руке подносят к краю открытого цилиндра горящую лучину. Наблюдают загорание водорода. Объяснить наблюдаемые эффекты взаимодействия кальция с водой. Записать уравнение реакции.
Техника безопасности: 1. Не брать руками металлический кальций.
Похожие работы
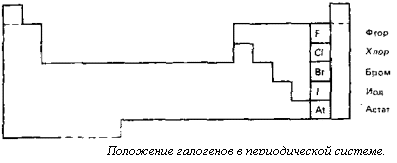
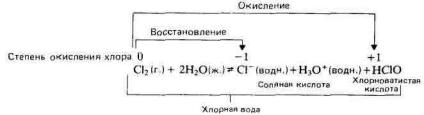
семь электронов. Они легко присоединяют еще один электрон, образуя галогенидные ионы. Галогенид-ион имеет устойчивый октет электронов. Галогены характеризуются высокой электроотрицательностью и реакционной способностью и поэтому в свободном виде не встречаются в природе. Однако галогенид-ионы широко распространены в природе. Галогены в свободном виде существуют в форме двухатомных молекул. Атомы ...
... коррозия железа. Утилизация. Все растворы из стаканов сливают в раковину, кроме раствора с соединениями цинка, который помещают в нейтрализатор. ЛАБОРАТОРНАЯ РАБОТА № 3 ТЕМА: “МЕТАЛЛЫ ГЛАВНЫХ ПОДГРУПП I-III ГРУПП” Опыт № 1. Горение кальция Оборудование и реактивы: Плоскогубцы, фильтровальная бумага, спиртовка, спички, напильник, кальций. Ход работы: Взять кальций плоскогубцами и ...
... разовая) – 0,01%. 4 Содержание Введение......................................................................................................................4 Глава 1. Межпредметные связи в курсе школьного предмета химии на примере углерода и его соединений.......................................................................5 1.1 Использование межпредметных связей для формирования у учащихся ...
... Просвещение, 1976. 35. Третьяков Ю.Д., Зайцев О.С. Программное пособие по общей и неорганической химии. М.: Юнити, 2005. 36. Фаязов Д.Ф. Формирование умений учащихся пользоваться химическим языком // Химия в школе. 1983. № 2. 37. Фигуровский Н.А. Открытие элементов и происхождение их названий. М.: Наука, 1970. 38. Цветков Л.А. Преподавание органической химии в средней ...







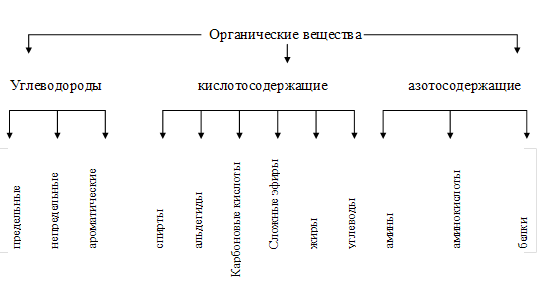

0 комментариев