Работа по химии
Ученика 9б класса
Школы №653
Николаева А.
Металлы – простые вещества, обладающие высокими значениями электро- и теплопроводности, способностью хорошо отражать световые волны (что обуславливает их блеск и непрозрачность), пластичностью. В твердом состоянии обычно имеют кристаллическое строение (металлический кристалл); большинство кристаллизуется в плотноупакованных кубической и гексагональной решетках. Металлы обладают низкими энергиями ионизации атомов. В кристаллах химических соединений с другими элементами и в растворах металлы образуют положительные элементарные ионы; в сложных ионах и полярных молекулах атомы металлов являются центрами положительного заряда. В металлах присутствует металлическая связь. Эта связь обусловлена наличием валентных электронов, обладающих большой свободой движения в кристаллической решетке, образуемой положительными ионами металла. Очень прочна химическая связь в тяжелых переходных металлах, что определяет их высокие модули упругости, температуры плавления и кипения, механическую прочность. Металлическая связь позволяет осуществлять значительное смещение атомов из положения равновесия, обуславливая пластичность металлов; большое количество подвижных элементов обеспечивает их высокую тепло- и электропроводность.
Из 107 элементов периодической системы 83 – металлы. Металлы 1-ой группы главной подгруппы называются щелочными, 2-ой гр. гл. подгруппы (исключая Mg и Be) – щелочноземельными. Для металлов главных подгрупп характерно последовательное заполнение s- и p-электронных оболочек атомов, для металлов побочных подгрупп d-оболочек, для лантаноидов и актиноидов – f-оболочек.
Металлический кристалл:

Физические свойства:
- агрегатное состояние – твердое (исключение ртуть)
- хорошая электро- и теплопроводность
- отражают световые волны (блеск)
- пластичность
- разные температуры плавления
Химические свойства:
| Металл | |
| Неметалл | Соль |
| Кислота | Соль + H2 Искл. HNO3 |
| Соль растворимая | Новая соль + металл |
| Вода | Щелочь + H2 (Li K Ca Na Ba) |
| Основной оксид | Новый металл + новый оксид |
1. Mg + 2Cl = MgCl2
2. Ca + H2SO4 = CaSO4 + H2
3. Zn + CuSO4 = ZnSO4 +Cu
4. Ca + H2O = CaOH2 + H2
5. Be + Ag2O = BeO + 2Ag
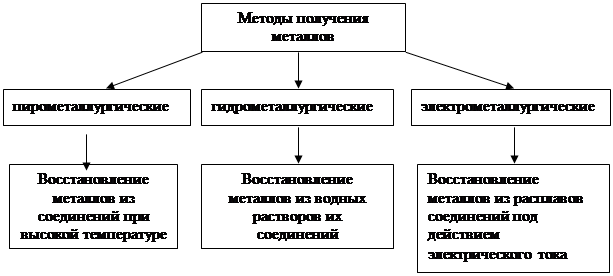
Похожие работы
... и их содержимым. Способ изящен, и его применение, по-видимому, будет расширяться, как только будут преодолены сложности измерения и контроля. Покрытия, как метод защиты металлов от коррозии. Защита металлов, основанная на изменение их свойств, осуществляется или специальной обработкой их поверхности, или легированием. Обработка поверхности металла с целью уменьшения коррозии проводится одним ...
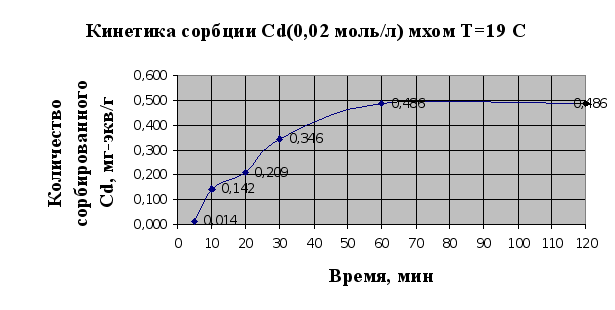
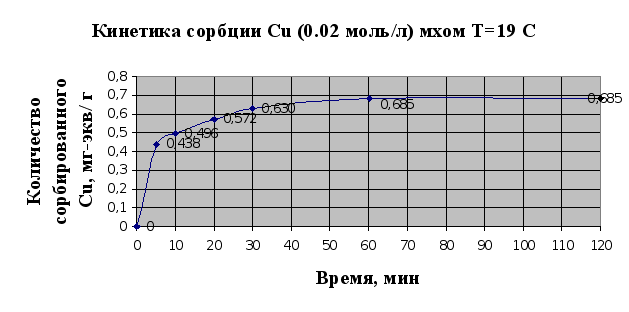
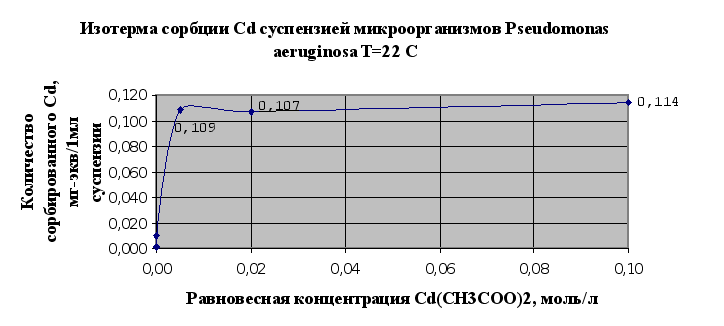
... Листов Пров. 1 2 Консульт. БГТУ 7140607 2004 Н. контр. Утв. Целью данной дипломной работы является изучение сорбционных свойств мха по отношению к микроорганизмам и тяжелым металлам, а также изучение сорбционной способности системы «мох-микроорганизмы» и выявление доли участия каждого компонента этой ...
... обратимых потенциалов кислородного электрода при различных рН среды и Р P (атм) V ,B, при рН среды рН=0 рН=7 рН=14 0,21 +1,218 +0,805 +0,381 1 +1,229 +0,815 +0,400 Коррозия металла с кислородной деполяризацией в большинстве практических случаев происходит в электролитах, соприкасающихся с атмосферой, парциальное давление кислорода в которой ...
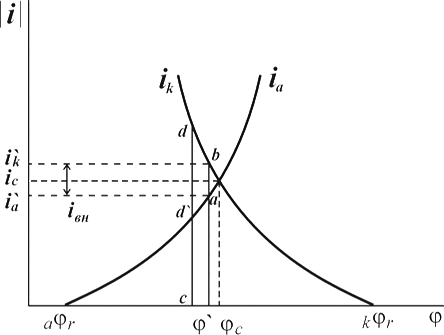
... Основным критерием, характеризующим состояние поверхности металла, является электродный потенциал. Обычно возможность применения анодной защиты для конкретного металла или сплава определяют методом снятия анодных поляризационных кривых. При этом получают следующие данные: а) потенциал коррозии металла в исследуемом растворе; б) протяженность области устойчивой пассивности; в) плотность тока в ...


0 комментариев