Навигация
Введение 3
1. Нильс Бор - ученый и человек 4
2. От великих открытий конца XIX века к теории атома Бора 5
3. Развитие учения о спектрах 10
4. Теория атома Бора 16
5. Заключение 27
Литература 28
- 3 -
ВведениеВот Бор всем известный...
А вот дополнительный закон,
Который был Бором провозглашен,
Который описывает с двух сторон
Как электрон, так и протон
Атома,
Который построил Бор.
А вот электронные уровни
Атома,
Который построил Бор.
Которые спектр характерный дают
На них перескакивают электроны,
Атома
Который построил Бор.
А вот ядроАтома,
Который построил Бор,
Которое видит он как каплю,
Которая находится точно в центре
Атома,
Который построил Бор.
Стихи Р.Е. Пайерлса в честь семидесятой годовщины со дня рождения Нильса Бора.
В своем выступлении на вечере памяти Нильса Бора в Политехническом музее в Москве 16 декабря 1962 года академик И. Е. Тамм сказал: "Бор не только был основателем квантовой теории, которая открыла человечеству путь к познанию нового мира - мира атомов и элементарных частиц - и тем самым проложила путь в атомный век и позволила овладеть атомной энергией. Труды Бора наряду с работами Эйнштейна оказали решающее влияние не только на физику нашего века, но и на современное научное мировоззрение в целом".
Одной из главных научных работ Нильса Бора является его статья "О строении атомов и молекул", три части которой вышли в июле, сентябре и ноябре 1913 года. В ней Бор рассматривал модель атома Резерфорда с использованием кванта действия Планка. Получившая, в последствии, название модель атома Резерфорда-Бора объясняла многие физические явления и стала основой квантовой теории. Истории создания этой модели атома и посвящен этот реферат.
- 4 -
1. НИЛЬС БОР УЧЕНЫЙ И ЧЕЛОВЕК.
Нильс Бор родился 7 октября 1885 г. в Копенгагене. Отец Нильса Бора, профессор Христиан Бор был известным физиологом. В 1903 г. Нильс поступает в Копенгагенский университет. В 1907 г. ему присуждается золотая медаль Королевской Датской академии за экспериментальное исследование поверхностного натяжения жидкостей. В 1909 г. Бор получает степень магистра наук, а затем в феврале 1911 г. - докторскую степень.
В сентябре того же года бор получает стипендию Карлсбергского фонда для стажировки за границей у Дж. Дж. Томсона в Кавендишской лаборатории.
В марте 1912 г. он переезжает к Резерфорду в Манчестер. В лаборатории Резерфорда он столкнулся с трудностями теории атома того времени: устойчивость планетарного атома не совместима с законами классической электродинамики и механики. Исходя из теории квантования энергии, Бор создает свою теорию.1918 г. - Бор дает общую формулировку принципа соответствия.
1921 г. - открытие института Бора.
1927 г. - формулировка принципа дополнительности.
1933 г. - приход к власти Гитлера, создание Бором Датского комитета помощи немецким изгнанникам-антифашистам.
1934 г. - первая поездка в Советский Союз.
1937 г. - работа Бора - Калькара о превращении атомных ядер.
1944 г.- работа в Лос-Аламосе. Бор предвидит будущую политику атомного шантажа, встречи с Рузвельтом и Черчиллем, борьба за международный контроль над ядерным оружием.
1950 - Бор пишет "Открытое Письмо" ООН с программой борьбы за мир.
Нильс Бор был не только видный ученый, но и ярый борец за мир, за невоенное использование ядерной энергии. Смерть Бора 18 ноября 1962 года - это потеря человечеством не только замечательного ученого, но и великого человека.
- 5 -
2. ОТ ВЕЛИКИХ ОТКРЫТИЙ КОНЦА XIX ВЕКА К ТЕОРИИ АТОМА.
История создания теории Бора не ограничивается тем кратким промежутком с 1912 года, когда он познакомился с Резерфордом и результата ми его исследований. Исследования которые привели Бора к его квантовой теории атома начались гораздо раньше с исследований оптических спектров и других явлений, связанных со строением вещества.
В конце XIX в. были открыты рентгеновские лучи (1895 – Вильгельм Конрад Рентген, впоследствии первый лауреат Нобелевской премии по физике), радиоактивность (1896 - Анри Беккерель), электрон (1897 - Томсон).
Рентген к своему открытию пришел в результате систематических поисков излучения, которое было бы способно проникать сквозь вещества, непрозрачные для обычного света.
Рентген работал с разрядной трубкой, в которой был достигнут довольно высокий вакуум. Для обнаружения излучения он пользовался флуоресцирующим экраном, покрытым платиносинеродистым барием. При излучении достаточно коротких волн он наблюдал свечение экрана, которое продолжалось и в том случае, когда разрядная трубка полностью закрывалась бумагой. В своем первом сообщении от 28 декабря 1895 года Рентген писал, что при достаточном затемнении флуоресценция заметна еще на расстоянии двух метров от трубки и что причины флуоресценции исходят именно от разрядной трубки, а не от какого-нибудь места проводника.
Опыты показали, что свечение вызывается особыми лучами, названые Рентгеном Х - лучами, которые проходят через бумагу, дерево, картон. Рентген обнаружил также, что эти лучи действуют на фотографическую пластинку, вызывая ее почернение. При возрастании плотности тел уменьшается их прозрачность в отношении рентгеновских лучей. Прозрачность мала у элементов с большим атомным весом.
Попытки Рентгена получить отражение и преломление рентгеновских лучей не увенчались успехом. Также не увенчались успехом первые попытки его и других исследователей обнаружить интерференцию, дифракцию и поляризацию рентгеновских лучей. Опыты Рентгена по отклонению лучей в магнитном поле привели к отрицательному результату. Возникла проблема какова же природа рентгеновских лучей?
В 1899 г. Хага и Винд, а затем в 1909 г. Вальтер и Поль пытались определить длину волны этих лучей по дифракции на очень узкой щели. Они фотографировали рентгеновскими лучами узкую клиновидную щель. Хотя ширина щель измерялась всего несколькими микронами, расширения изображения щели, которое указывало бы на дифракцию щели, достоверно обнаружить не удалось.
- 6 -
В феврале 1912 года П. Эвальд обратился к Лауэ с вопросом, о поведении световых волн в пространственной решетке из поляризующихся атомов. При обсуждении Лауэ пришла мысль, что если атомы образуют пространственные решетки, то должны наблюдаться явления интерференции, подобные световой интерференции.
В феврале 1912 г. два ученика Рентгена Фридрих и Книппинг, по предложению Лауэ поставили опыт по дифракции рентгеновских лучей на кристаллической решетке. Опыт состоял в следующем. При помощи ряда свинцовых диафрагм выделяли узкий пучок рентгеновских лучей. Этот пучок падал на тонкий кристалл цинковой обманки. Пройдя сквозь кристалл, рентгеновские лучи попадали на фотопластинку. Пластинка была поставлена перпендикулярно начальному направлению лучей. После проявления на пластинке получалось интенсивное центральное пятно и ряд правильно расположенных пятнышек. Было наглядно доказано, что кристаллы являются подходящей дифракционной решеткой для рентгеновских лучей.
Это открытие позволило исследовать с большей точностью спектры рентгеновских лучей, что сыграло важную роль в создании теории Бора. Макс Лауэ разработал простую математическую теорию, которая позволила сравнить длину волны рентгеновских лучей с постоянной решетки кристалла. Абсолютная величина длинны волны, в теории Лауэ, не определялась. У.Г. Брэгг и У.Л. Брэгг и одновременно с ними Г.В. Вульф дали объяснения диаграммам Лауэ и разработали метод абсолютного измерения длины волны рентгеновских лучей. Основная мысль принадлежала Брэггу - сыну. Брэгги стали исследовать не прохождение рентгеновских лучей через кристаллическую пластинку, а отражение их от поверхности пластинки. Бор писал, что самой важной новой информацией на Сольвеевском конгрессе в 1913 году была информация об открытии дифракции рентгеновских лучей в кристаллах, сделанном Лауэ в 1912 году.
Опыты Рентгена привлекли к себе внимание Анри Беккереля, много занимавшегося фосфоресценцией. В начале 1896 г., в тот самый день, когда в Париже стало известно об опытах Рентгена, Беккерель решил проверить, не испускают ли рентгеновские лучи всякое фосфоресцирующее вещество. Опыты не подтвердили его предположения, но он произвел следующий опыт. Фотографическая пластинка с бромжелатиновой эмульсией была завернута в слой черной бумаги. Плоский кристалл сернокислой соли урана был положен сверху. Когда пластинку проявили, на ней был обнаружен черный отпечаток фосфоресцирующего кристалла. Поместив между фосфоресцирующим веществом и бумагой монеты, Беккерель обнаружил на пластинке изображение. Он заключил, что взятое им фосфоресцирующее вещество испускает излучение, проникающее через светонепроницаемую бумагу и действующее на соли серебра.
После того, как Беккерель установил, что источником открытых им лучей
- 7 -
является уран, естественно возник вопрос о том, не существуют ли другие химические элементы, обладающие такими же свойствами. В 1898 г. открытие Беккереля привлекло к себе внимание Г. Шмидта в Германии и М. Кюри во Франции. Кюри исследовала на радиоактивность различные минералы. Некоторые из них оказались радиоактивными, в том числе урановая смоляная обманка, хальколит, отенит и другие. Эти минералы содержат или уран или торий.
Бор многократно обращался к оценке работ М. Кюри. Он полагал, что решающий прогресс в атомной физике стал возможным благодаря порази- тельному открытию радиоактивности некоторых элементов, в истории которого замечательной вехой явилось выделение радия Марией Кюри.
Для рассматриваемого периода существенную роль сыграли работы Дж. Дж. Томсона. Исследуя прохождение электрического тока сквозь разряженные газы, Томсон в 1897 г. показал, что отношение электрического заряда к массе (е/m) для частиц - носителей катодных лучей (электронов) во много раз больше, чем для ионов водорода при электролизе. На основании полученного отношения e/m он высказал гипотезу, что в катодных лучах электрические заряды переносятся "корпускулами", размер и массы которых во много раз меньше размеров атома водорода.
В 1898 г. Томсон определил заряд "корпускулы" и нашел его равным заряду иона водорода при электролизе. Впервые Томсон сделал вывод о существовании элементарной частицы, названой электроном.
Оптические и рентгеновские спектры, модели атома, учение Планка об излучении - основные вехи на пути создания теории атома Бора. До теории атома Бора было выдвинуто много различных гипотез относительно строения атомов ("модели атома"). В 1902 г. Вильям Томсон (Лорд Кельвин) предположил, что атом имеет вид сферы, равномерно наполненной положительным электричеством. Внутри сферы находится такое число электронов, которое эквивалентно заряду самого шара. Дж. Дж. Томсон широко разработал и усовершенствовал модель атома Вильяма Томсона. Он изучил условия равновесия различных групп электронов внутри сферы с положительным зарядом. Электроны, находящиеся внутри положительного шара, должны совершать гармонические, колебательные движения, вызывая, тем самым, испускание атомами лучистой энергии, которое дает резкие спектральные линии.
Бор придавал большое значение стремлению Дж. Дж. Томсона объяснить периодическую систему исходя из устойчивости различных электронных конфигураций. Он писал: "Со времени знаменитой попытки Дж. Дж. Томсона истолковать периодическую систему на основании исследования устойчивости различных электронных конфигураций идея о разделении электронов в атоме на группы стала исходным пунктом и более новых воззрений. Предположение Томсона, о распределении положительного заряда в атоме, оказалась несовместимо с опытными результатами, полученными на основании изучения ра-
- 8 -
диоактивных веществ. Тем не менее, эта работа содержит много оригинальных мыслей, и оказала большое влияние на дальнейшее развитей атомной теории".
Вместе с тем Бор отметил, что объяснение спектральных законов не удавалось согласовать с оценкой числа электронов в атоме, произведенной Дж. Дж. Томсоном из наблюдения рассеяния рентгеновских лучей, использую при этом классическую теорию.
Бор особенно ценил Дж. Дж. Томсона за то, что в те времена, когда многие физики скептически относились к существованию атомов, Томсон начал исследование внутриатомного мира. Существенно для Бора было то, что из общих идей Томсона о соотношении между числом электронов и местом элемента в периодической таблице следовало обобщение, что для любого элемента число электронов вне ядра в нейтральном атоме определяется атомным номером, указывающим положение элемента в таблице Менделеева.
Решающими, однако, для возникновения теории атома Бора были работы Резерфорда и Планка. В 1895 г. в Кавендишскую лабораторию пришел Резерфорд. Первое время он продолжал начатые им ранее работы по приему электромагнитных волн и совершенствовал свой магнитный детектор. Затем он приступил к работе по ионизации газов рентгеновскими лучами. В сентябре 1898 г. Резерфорд переехал в Монреаль, где стал изучать радиоактивные свойства урана и тория. С января 1901 г. Резерфорд работает вместе с Фредериком Соди. Ими было обнаружено, что радиоактивность сопровождают такие превращения, при которых возникают новые элементы. Они показали, что радиоактивность есть атомное явление, связанное с химическими превращениями, в результате которых появляются новые элементы.
Об этом периоде Бор писал, что благодаря экспериментальным открытиям в области радиоактивности положение с изучением составных частей атома значительно изменилось. Изучение прохождения частиц, испускаемых радиоактивными веществами, привело Резерфорда к мысли о ядерном строении атома. Он предположил, что в атоме имеется ядро, заряженное положительным электричеством. Это ядро очень мало по сравнению с размерами всего атома, однако, в нем сосредоточена большая часть массы атома. Вокруг ядра движется строго определенное число электронов.
Бор многократно обращался к оценке деятельности Резерфорда. В 1913 г. в статье "Теория торможения заряженных частиц при прохождении через вещество" он анализировал работу Резерфорда 1911 г., посвященную теории рассеяния ![]() -частиц веществом. Бор писал, что в соответствии с теорией рассеяния
-частиц веществом. Бор писал, что в соответствии с теорией рассеяния ![]() -частиц веществом, развитой Резерфордом, предполагается, что :
-частиц веществом, развитой Резерфордом, предполагается, что :
1) атомы вещества состоят из облаков электронов и ядра;
2) электроны удерживаются силами притяжения к ядру;
- 9 -
3) ядро обладает положительным зарядом, равным сумме отрицательных зарядов электронов;
4) на ядро приходится основная часть массы атома;
5) Размеры ядра малы по сравнению с размерами атома;
6) ![]() -частица есть ядро атома гелия.
-частица есть ядро атома гелия.
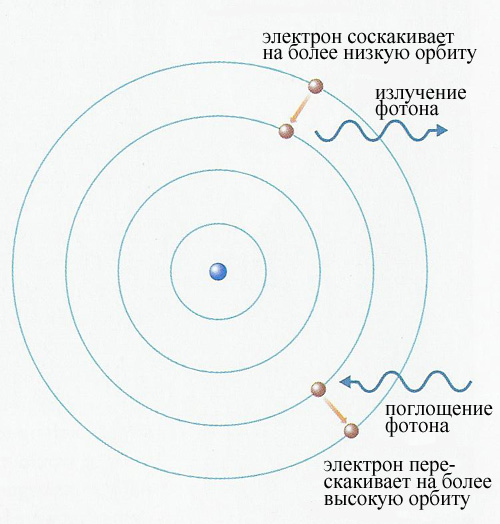
Расчеты Резерфорда навели Бора на мысль, что очень быстрый электрон, пролетающий через атом и сталкивающийся со связанными электронами, теряет свою энергию определенными конечными порциями - квантами. Рассматривая столкновение между свободным и связанным электроном, Бор заключил, что связанный электрон не может приобрести энергию меньшую, чем разность энергий между двумя последовательными стационарными состояниями, а, следовательно, свободный электрон, сталкиваясь с ним, не может терять меньшее количество энергии.
В то время Бор считал, что необходимым следствием теории атома Ре- зерфорда является
внутриядерное происхождение ![]() - частиц и что быстрые
- частиц и что быстрые ![]() - частицы испускаются ядром.
- частицы испускаются ядром.
- 10 -
Похожие работы
... сумки. Группа однокурсников Бора организовала кружок “Эклиптика”. В его состав входили братья Бор . На кружке студенты обсуждали проблемы философии и физики , и все очень быстро заметили, что Боры лучше всего выглядят тогда, когда выступают дуэтом. Уже в Университете Нильс Бор обнаружил в себе тягу к исследованию загадок атомарной структуры вещество , а Харальд Бор проявил в себе наклонности к ...
... квантовой механике оказало воздействие на решение вопроса о причинной обусловленности и о строгой предсказуемости всех природных процессов. Вместе с другими ведущими представителями квантовой теории Нильс Бор придерживался мнения, что исследование субатомных явлений в мельчайших подробностях невозможно, потому что любая попытка изучения этих процессов сопровождается нежелательным вмешательством ...
... , а с другой - к выяснению структуры отдельных атомов и установлению связи между ними. Однако оставалось еще много явлений в этой области, объяснить которые теория Бора не могла. Движение электронов в атомах Бор представлял как простое механическое, однако оно является сложным и своеобразным. Это своеобразие было объяснено новой квантовой теорией. Отсюда и пошло: “Карпускулярно-вролновой дуализм ...
... университет, который окончил в 1908 году. В 1911-1912 годах Нильс Бор работал под руководством английского физика Дж. Дж. Томсона в Кавендишской лаборатории Кембриджского университета. В 1912-1913 годы Нильс Хенрик Давид Бор работал в Манчестерском университетете, в лаборатории Э. Резерфорда. В 1913 году Нильс Бор создал первую квантовую теорию атома водорода, в которой он: 1) Показал, что ...
0 комментариев