Навигация
4. ТЕОРИЯ АТОМА БОРА.
В 1913 г. в английском журнале "Philosophikal Magazine" была опубликована статья Н. Бора "О строении атомов и молекул". Статья состояла из трех частей. Первая часть озаглавлена "Связывание электронов положительным ядром", вторая - "Системы, содержащие только одно ядро", третья - "Системы с несколькими ядрами".
В статье излагалась новая теория строения атома. "Введение" к статье Бор начал с краткой характеристики модели атома Резерфорда, согласно которой атом состоит положительно заряженного ядра и системы окружающих его электронов. Силами притяжения электроны удерживаются на определенных расстояниях от ядра. Положительный заряд ядра и общий отрицательный заряд электронов равны между собой. Линейные размеры ядра очень малы по сравнению с линейными размерами атома в целом. Основная часть массы атома заключена в ядре. Бор полностью принял модель атома, предложенную Резерфордом. Он считал, что вокруг ядра атома водорода вращается только один электрон и заряд ядра Е = е; в атоме гелия вращаются два электрона, в атоме лития - три электрона и т.д.
До Резерфорда в физике господствовала модель атома Дж. Дж. Томсона, согласно которой атом состоит из шара, равномерно заполненного положи- тельным электрическим зарядом. В этом шаре электроны движутся по окружностям. Основное различие между моделями Томсона и Резерфорда Бор усматривал в том, что в модели Томсона силы, действующие на электроны, допускают такие конфигурации и движения, которое обеспечивают устойчивое равновесие системы, в то время как для модели Резерфорда, по-видимому, такие конфигурации не существуют. Это различие проявляется в том, что среди величин характеризующих атом Томсона, имеется одна величина - радиус положительно заряженного шара - с размерностью длины, в то время как среди величин, характеризующих атом Резерфорда, такая длина отсутствует.
Теория теплового излучения Планка и прямые подтверждения существо-вания элементарного кванта действия в опытах по теплоемкости, фотоэффекту и других, побудили Бора усомниться в применимости классической электродинамики к атомным системам. Бор поставил перед собой задачу ввести в законы движения электронов элементарный квант действия. Атом Резерфорда и квант действия Планка - исходные моменты теории атома Бора.
В первой части статьи Бора на основе теории Планка рассматривается механизм связывания электрона с ядром. На примере простейшей системы, состоящей из положительно заряженного ядра и электрона, движущегося по замкнутой орбите вокруг ядра, показано, что при излучении, которое должно иметь место по законам электродинамики, электрон не может двигаться по стационарным орбитам. В результате излучения энергия будет непрерывно убы-
- 17 -
вать. Электрон будет приближаться к ядру, описывая все меньшие орбиты. Частота его вращения вокруг ядра будет все увеличиваться. Поведение такой системы, вытекающее из основ классической электродинамики, отличается от того, что имеет место в действительности. Атомы длительное время имеют определенные размеры и частоты. "Далее, - пишет Бор, - представляется, что если рассмотреть какой - либо молекулярный процесс, то после излучения определенного количества энергии, характерного для изучаемой системы, эта система всегда вновь окажется в состоянии устойчивого равновесия, в котором расстояния между частицами будут того же порядка величины, что и до процесса".
Бор ясно показал, что следствия классической электродинамики не соответствуют тому, что мы наблюдаем в атомных системах. Высший критерий физики есть опыт. Поскольку опыт в области атомных явлений нельзя объяснить представлениями и теорией классической физики, Бор обращается к теории излучения Планка. Эта теория утверждает, что излучение энергии атомной системы происходит не непрерывно, а определенными раздельными порциями. Количество испускаемой атомным излучателем энергии при каждом процессе излучения равно ![]() , где
, где ![]() - целое число, h -
универсальная постоянная Планка,
- целое число, h -
универсальная постоянная Планка, ![]() -
частота. Бор допускает, что электрон испускает монохроматическое излучение с частотой
-
частота. Бор допускает, что электрон испускает монохроматическое излучение с частотой ![]() , равной половине частоты обращения электрона по своей окончательной орбите.
, равной половине частоты обращения электрона по своей окончательной орбите.
Энергия излучения :
W =![]() ,
,
где:
![]() ,
,
W - среднее значение кинетической энергии электрона за одно полное обращение, e и E - заряды электрона и ядра, m - масса электрона. Подставив значение ![]() , получим:
, получим:
W =![]() ,
,
Длина большой полуоси орбиты:
- 18 -
2а ![]() ,
,
Придав ![]() разные значения, мы получим ряд значений W,
разные значения, мы получим ряд значений W, ![]() , и а, соответствующих ряду конфигураций системы. В этих состояниях атом не излучает.
W принимает максимальное значение при
, и а, соответствующих ряду конфигураций системы. В этих состояниях атом не излучает.
W принимает максимальное значение при ![]() =1,
подставив значения E = e = 4,7 * 10-10 , e/m = 5,31 * 1017 , h = 6,54 * 10-27 ,имеем 2а = 1,1 * 10-8 см,
=1,
подставив значения E = e = 4,7 * 10-10 , e/m = 5,31 * 1017 , h = 6,54 * 10-27 ,имеем 2а = 1,1 * 10-8 см, ![]() = 6,2 * 1015 с-1, W/e = 13 в. Эти величины того же порядка, что и линейные размеры атома, оптические частоты и ионизационные потенциалы.
= 6,2 * 1015 с-1, W/e = 13 в. Эти величины того же порядка, что и линейные размеры атома, оптические частоты и ионизационные потенциалы.
Бор указывает, какова предыстория применения теории Планка к атомным системам: "На всеобщее значение теории Планка для обсуждения поведения атомных систем впервые указал Эйнштейн. Соображения Эйнштейна, были затем развиты и применены к различным явлениям в особенности Штарком, Нернстом и Зоммерфельдом. Соответствие наблюдаемых частот и размеров атома и вычисленных на основе соображений, приведенных выше, было предметом многочисленных обсуждений". С точки зрения теории Планка Дж. Никольсон рассматривал системы, у которых силы взаимодействия между частицами обратно пропорциональны квадрату расстояния между ними. Однако его теория не в состоянии была объяснить известные спектральные закономерности Ритца и Бальмера.
Бор исходит из двух следующих допущений:
1. Динамическое равновесие системы в стационарных состояниях можно рассматривать с помощью обычной механики, тогда как переход системы из одного стационарного состояния в другое нельзя трактовать на его основе.
2. Указанный переход сопровождается испусканием монохроматического излучения, для которого соотношения между частотой и количеством выделенной энергии именно такое, которое дает теория Планка.
Полагая в атоме водорода заряд ядра равным заряду электрона E = e, получают выражение для общего количества энергии, испускаемой при образовании стационарного состояния:
Wr ![]() .
.
При переходе из состояния, соответствующего ![]() , в состояние, соответствующее
, в состояние, соответствующее ![]() , испускается количество энергии
, испускается количество энергии
Wr2 - Wr1 = ![]() ,
,
следовательно:
- 19 -
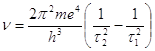 .
.
Если положить ![]() = 2 и варьировать
= 2 и варьировать ![]() , то получают серию Бальмера. Если положить
, то получают серию Бальмера. Если положить ![]() = 3,
получают серию которую наблюдал в 1908 г. Пашен в инфракрасной области. Бор отмечает, что если
= 3,
получают серию которую наблюдал в 1908 г. Пашен в инфракрасной области. Бор отмечает, что если ![]() = 1 и
= 1 и ![]() = 4, 5,..., то получают в
крайней ультрафиолетовой и соответственно в крайней инфракрасной области серии, которые еще никем не наблюдались.
= 4, 5,..., то получают в
крайней ультрафиолетовой и соответственно в крайней инфракрасной области серии, которые еще никем не наблюдались.
Путь, по которому шел Бор к своему открытию он описал в воспоминаниях о Резерфорде. "Мои письма к Резерфорду, написанные осенью 1912 г., посвящены продолжавшимся усилиям, выяснить роль кванта действия в электронном строении атома Резерфорда, включая сюда проблему молекулярной связи, а также вопросы излучения и магнитные эффекты. Однако вопросы устойчивости, неизбежно возникающие при таких рассмотрениях, резко увеличивали трудности и вынуждали искать более надежную основу для решения проблемы. После многочисленных попыток использовать квантовые идеи в более строгой форме ранней весной 1913 г. мне пришло в голову, что ключом к решению проблемы атомной устойчивости, непосредственно приложенным к атому Резерфорда, являются изумительно простые законы, определяющие оптический спектр элементов"
Об этом же писали Л. Розенфельд и Э. Рюдингер в статье "Годы перело- ма". Они отметили, что летом и осенью 1912 г. Бор построил несколько моделей атомов и молекул в их основном состоянии. В начале февраля 1913 г. "он напал на след третьего и самого важного члена головоломки, а именно формулы выведенной 28 лет тому назад швейцарцем Бальмером. Когда Бору задавали вопрос, не удивительно ли, что никому раньше и в голову не приходило, что формула Бальмера и другие родственные ей формулы должны были раскрыть основные закономерности, он только сказал: "Их воспринимали так же, как прекрасные узоры на крыльях бабочек, красота которых всех очаровывает, но никто не подозревает, что она поможет раскрыть основные биологические закономерности".
Бор многократно говорил, что как только он увидел формулу Бальмера, ему все сразу же стало ясно. Еще 31 января 1912 г. в письме к Резерфорду и в письме к Хевеши от 7 февраля 1913 г. Бор упоминает, что он не занимается вопросом вычисления частот, соответствующих наблюдаемым линиям в видимом спектре. Однако вскоре было сделано фундаментальное открытие. В данном случае, мы являемся свидетелями совершенно невероятного процесса созидания: все приобретенные Бором знания, все его мысли о строении атомов ,с разгадкой последнего звена головоломки, мгновенно предстали перед его глазами, и с такой наглядностью воссоздали картину целого, что Бор менее чем в месяц
- 20 -
сумел закончить знаменитую первую часть своего труда о строении атомов, в основу которого положено соответствие с оптическими спектрами.
В 6 марта 1913 г. Бор послал свою статью вместе с письмом Резерфорду. В письме он подчеркнул важность решения вопроса о происхождении линии Пикеринга. Он пытался узнать, нельзя ли в лаборатории Резерфорда провести необходимые опыты.
20 марта 1913 г. Резерфорд в ответном письме писал, что мысли Бора относительно причин возникновения спектра водорода очень остроумны. Он считает их хорошо продуманными, но их сочетание с идеей Планка создает большие трудности. "Я - пишет Резерфорд, - обнаружил серьезное затруднение в связи с Вашей гипотезой, оно состоит в следующем: как может знать электрон, с какой частотой он должен колебаться, когда он переходит из одного стационарного состояния в другое? "Этот вопрос в дальнейшем стал предметом многих дискуссий. Кроме того, в своем письме, Резерорд трижды подчеркнул, что работа Бора представляется ему слишком длинной и что ее следует сократить. "Надеюсь, что Вы не будете ничего иметь против, если я по собственному усмотрению сокращу то, что считаю в Вашей статье лишним. Будьте любезны ответить". Зная, как тщательно обрабатывал свои статьи Бор, легко представить его ужас при мысли о таком вмешательстве! Правда, получив письмо, Бор отослал Резерфорду еще несколько дополнений к своей статье, но, чувству опасность столь критической ситуации, он решил тотчас же отправиться в Манчестер, чтобы , как он сам выразился, "выиграть дело" у Резерфорда. И ему это удалось.
В 1897 г. Э.Ч. Пикеринг обнаружил в ![]() спектре звезды
спектре звезды ![]() Кормы серию, которую он трактовал как побочную серию водорода. В 1898 г. Фаулер обнаружил одну из линий этой серии в спектре солнечной хромосферы. В 1912 г. Фаулер нашел линии Пикеринга в разрядной трубке, содержащей смесь водорода и гелия. Бор естественным образом объяснил происхождение этих линий, приписав их гелию. Согласно теории Резерфорда, нейтральный атом гелия состоит из положительного ядра с зарядом 2е и двух электронов. Если рассматривать ионизированный гелий, в котором имеется связь одного электрона с ядром, то
Кормы серию, которую он трактовал как побочную серию водорода. В 1898 г. Фаулер обнаружил одну из линий этой серии в спектре солнечной хромосферы. В 1912 г. Фаулер нашел линии Пикеринга в разрядной трубке, содержащей смесь водорода и гелия. Бор естественным образом объяснил происхождение этих линий, приписав их гелию. Согласно теории Резерфорда, нейтральный атом гелия состоит из положительного ядра с зарядом 2е и двух электронов. Если рассматривать ионизированный гелий, в котором имеется связь одного электрона с ядром, то ![]() принимает значение
принимает значение
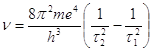 .
.![]()
Полагая ![]() =1 или 2, получают серии линий в крайнем ультрафиолете. если полагать
=1 или 2, получают серии линий в крайнем ультрафиолете. если полагать ![]() = 3 и варьировать
= 3 и варьировать ![]() , то получают серию, включающую две серии, наблюдавшиеся Фаулером. Если
, то получают серию, включающую две серии, наблюдавшиеся Фаулером. Если ![]() = 4, то получают серию, которую Пикеринг наблюдал в спектре
= 4, то получают серию, которую Пикеринг наблюдал в спектре ![]() Кормы.
Кормы.
- 21 -
Еще в своем ответном письме от 20 марта 1913 г. Резерфорд писал: "Кстати, я очень заинтересовался Вашими предположениями относительно спектров Фаулера. Я рассказал здесь об этом Эвансу, который ответил мне, что его этот вопрос также занимает; я считаю вполне возможным, что он попытается поставить несколько опытов в этом направлении..."
Опыты показали, что каждая вторая линия в серии Пикеринга идентична одной из линий серии Бальмера в спектре водорода. Что рассматриваемый спектр не наблюдался в обычных гелиевых трубках, Бор считал возможным объяснить тем, что в этих трубках ионизация гелия не столь большая как в ![]() Кормы, или в опытах Фаулера. Бор не ограничился рассмотрением спектров водорода и
гелия. Он рассмотрел также вопрос о спектрах систем, содержащих большее число электронов. Очевидно, что для таких систем в линейчатых спектрах
должны существовать более сложные закономерности. В 1908 г. Ритц обобщил теорию Ридберга. Он нашел, что частота, соответствующая линии какого-либо элемента, может быть выражена формулой:
Кормы, или в опытах Фаулера. Бор не ограничился рассмотрением спектров водорода и
гелия. Он рассмотрел также вопрос о спектрах систем, содержащих большее число электронов. Очевидно, что для таких систем в линейчатых спектрах
должны существовать более сложные закономерности. В 1908 г. Ритц обобщил теорию Ридберга. Он нашел, что частота, соответствующая линии какого-либо элемента, может быть выражена формулой:
![]() ,
,
где: ![]() и
и ![]() - целые числа,
- целые числа,
![]() - функции вида
- функции вида
![]() ,
, ![]() ,
,
где: K = ![]() - универсальная постоянная.
- универсальная постоянная.
По-видимому, происхождение линии в спектрах других элементов по- добно тому как это имеет место в спектрах водорода. Линии соответствуют тому излучению, которое имеет место при переходе системы из одного стационарного состояния в другое стационарное состояние.
Для многоэлектронных систем существует много различных конфигура- ций электронов, которые необходимо учитывать как стационарные состояния. Это имеет своим следствием существование различных групп серий у этих систем.
В первой части своей работы Бор рассмотрел также вопрос о поглощении излучения. Предположения о механизме поглощения излучения необходимы были такие, которые соответствовали бы используемым при объяснении механизма испускания. Бор предполагает, что система, состоящая из ядра и вращающегося вокруг него электрона, при определенных условиях поглощает из-
- 22 -
лучение, частота которого соответствует частоте монохроматического излучения, испускаемого при переходе атома между двумя стационарными состояниями.
Если рассмотреть испускание излучения переходе системы между двумя стационарными
состояниями А1 и А2 , которым соответствуют числа ![]()
![]() и
и ![]() , где
, где ![]() >
> ![]() , аналогично тому, как необходимым условием испускания рассматриваемого излучения является пребывание системы в состоянии А1, необходимым условием поглощения
излучения является пребывание системы в состоянии А2 .Бор считает, что опыты с рентгеновскими лучами позволяют думать, что на основе классической электродинамики нельзя рассматривать соударения электронов,
из которых , один связан в атоме. Он анализирует расчеты энергии
, аналогично тому, как необходимым условием испускания рассматриваемого излучения является пребывание системы в состоянии А1, необходимым условием поглощения
излучения является пребывание системы в состоянии А2 .Бор считает, что опыты с рентгеновскими лучами позволяют думать, что на основе классической электродинамики нельзя рассматривать соударения электронов,
из которых , один связан в атоме. Он анализирует расчеты энергии ![]() -частиц, опубликованные
Резерфордом. "Эти расчеты, - пишет Бор, - наводят на мысль, что этот вывод сильно отличается от результатов, которые получаются, если рассматривать
столкновения на основе обычных законов механики". Бор считает, что то, что классическая механика не дает правильного ответа на вопрос о характере столкновения, можно было ожидать, поскольку закон равномерного распределения кинетической энергии не применим при рассмотрении взаимодействия между свободными электронами и связанными в атоме.
-частиц, опубликованные
Резерфордом. "Эти расчеты, - пишет Бор, - наводят на мысль, что этот вывод сильно отличается от результатов, которые получаются, если рассматривать
столкновения на основе обычных законов механики". Бор считает, что то, что классическая механика не дает правильного ответа на вопрос о характере столкновения, можно было ожидать, поскольку закон равномерного распределения кинетической энергии не применим при рассмотрении взаимодействия между свободными электронами и связанными в атоме.
В первой своей работе Бор допускает, что в системах, где ядро связывает несколько электронов, в основном состоянии конфигурация электронов такова, что они располагаются в кольце вокруг ядра. Во второй части Бор предполагает, что электроны расположены на равных угловых интервалах в коаксиальных кольцах,
которые вращаются вокруг ядра. Для определения частоты и размеров кольца Бор прибегает к гипотезе, что в основном состоянии атома момент импульса каждого
электрона относительно центра своей орбиты равен 2![]() . Бор в то время считал,
что на одной и той же круговой орбите могут двигаться, на равных друг от
друга расстояниях, несколько электронов. Предполагалось, что все кольца
расположены в одной плоскости. Рассматривался вопрос о распределении
электронов по различным кольцам. Бор предположил, что в атоме гелия два электрона движутся по одной орбите, при этом они постоянно остаются на противоположных концах диаметра орбиты. В отношении атома лития он предположил, что два атома движутся по одной орбите, а третий - по орбите имеющий больший радиус. На второй орбите в атомах бериллия, бора и углерода движутся два, три,
соответственно у углерода - четыре равностоящих друг от друга электрона.
. Бор в то время считал,
что на одной и той же круговой орбите могут двигаться, на равных друг от
друга расстояниях, несколько электронов. Предполагалось, что все кольца
расположены в одной плоскости. Рассматривался вопрос о распределении
электронов по различным кольцам. Бор предположил, что в атоме гелия два электрона движутся по одной орбите, при этом они постоянно остаются на противоположных концах диаметра орбиты. В отношении атома лития он предположил, что два атома движутся по одной орбите, а третий - по орбите имеющий больший радиус. На второй орбите в атомах бериллия, бора и углерода движутся два, три,
соответственно у углерода - четыре равностоящих друг от друга электрона.
Если на орбите симметрично расположены несколько электронов, то на каждый из них кроме притяжения к ядру действуют еще отталкивающие силы со стороны остальных электронов. Если рассмотреть кольцо, состоящее из n-электронов, вращающихся вокруг ядра и расположенных на равных угловых
- 23 -
интервалах по окружности, то суммарная потенциальная энергия системы, стоящей из электронов и ядра,
Р = ![]() ,
,
где:
![]() cosec
cosec![]()
где: E - заряд ядра,
a - радиус окружности,
n - число электронов.
В дальнейшем Бор отказался от представления о кольцах. Считали, что электроны движутся по эллиптическим орбитам, а по одному и тому же эллипсу не может происходить устойчивое движение более чем одного электрона. Кроме того, пришлось оставить представление о том, что орбиты всех электронов расположены в одной плоскости. В дальнейшем строились модели орбит, расположенных в различных плоскостях. Идея об "электронных кольцах" была заменена идеей об "электронных слоях".
В заключительных замечаниях ко всей работе Бор не рассматривает вопрос о кольцах. Он отмечает, что цель работы была "развить теорию строения атомов и молекул на основании представлении, введенных Планком для расчета излучения
черного тела, и теории строении атома, предложенной Резерфордом для объяснения рассеяния ![]() -частиц веществом."
-частиц веществом."
Он указывает, что вибратор Планка основан на предположении о квазиупругих силах и несовместим с теорией Резерфорда, согласно которой силы, действующие в атомной системе между частицами, обратно пропорциональны квадрату расстояния между ними. Совместить результаты Планка с теорией Резерфорда можно лишь на основе атомистических предположений об испускании и поглощении излучения.
Бор выдвигает пять предположений:
1) Испускание или поглощение энергии происходит не непрерывно, но лишь при переходе системы из одного стационарного состояния в другое.
2) В стационарных состояниях динамическое равновесие системы определяется обычными законами механики. Для перехода системы из одного стационарного состояния в другое законы обычной механики недействительны.
3) При
переходе системы из одного стационарного состояния в другое излучение монохроматично и имеет место соотношение ![]() .
.
- 24 -
4) Различные стационарные состояния простой системы, состоящей из вращающегося
вокруг положительного ядра электрона, определяются из условия, что отношение между общей энергией, испущенной при образовании данной конфигурации, и числом оборотов электронов является целым кратным h/2. Предположение о том, что орбита электрона круговая, равнозначна требованию, чтобы момент импульса вращающегося вокруг ядра электрона был бы целым кратным h/2![]() .
.
5) "Основное" состояние любой атомной системы, т.е. состояние, при котором излученная энергия максимальна, определяется из условия, чтобы момент импульса каждого электрона относительно центра его орбиты равнялся h : 2![]() .
.
Существенное значение в развитии теории Бора имели опыты Джеймса Франка и Густава Герца. В сосуде, заполненном парами ртути, при давлении 1 мм рт. ст. помещаются накаливаемый катод, сетка и анод. Между катодом и сеткой прикладывается разность потенциалов, ускоряющая электроны. Между сеткой и анодом создается небольшая разность потенциалов, ускоряющая электроны. Между сеткой и анодом создается небольшая разность потенциалов, тормозящая движение электронов. Ток на аноде регистрируется гальванометром. Разность потенциалов между сеткой и анодом сохраняется неизменной. При малом потенциале сетки скорости электронов невелики. Электроны испытывают упругие столкновения. Масса атома превышает массу электрона в тысячи раз, и при упругом соударении электронов с атомами кинетическая энергия электронов остается неизменной и лишь меняется направление движения электрона. Упругие столкновения затрудняют попадание электронов на анод, но не могут служить причиной отсутствия анодного тока. При возрастании потенциала сетки ток на аноде возрастает, и это происходит до тех пор, пока электроны, ускоряемые полем, не приобретут определенные энергии, и соударения электронов с атомами не станут неупругими. При этом электроны теряют свою энергию, передавая ее, атомам ртути. Ток на аноде резко падает. При дальнейшем росте ускоряющего потенциала анодный ток снова увеличивается. Затем вновь наблюдается резкое уменьшение анодного тока.
Франк и Герц наблюдали спектры испускания паров при их бомбардировке электронами. Было обнаружено, что как только энергия электронов достигает 4,9 эв, появляется большая вероятность потерять ее при соударении с атомом. В результате соударения атом испускает излучение. Это излучение состоит из ультрафиолетовой линии с длиной волны 2536 А. При умножении частоты этой линии на постоянную Планка, получают величину 4,9 эв.
В 1915 г. в работе "О квантовой теории излучения и структуре атома" Бор писал об опытах Франка и Герца: "Эти эксперименты ясно показывают, что электрон не теряет энергию при столкновении с атомом ртути, если его энергия меньше определенной величины, соответствующей 4,9 эв, но как только энергия достигает этой величины, электрон с большой вероятностью может потерять
- 25 -
всю свою энергию при соударении с атомом. Далее было показано, что в результате такого соударения атом испускает излучение, состоящее только из ультрафиолетовой линии ртути, с длиной волны 2536 А ..." Франк и Герц предположили, что 4,9 эв соответствуют энергии, необходимой для удаления электрона из атома ртути. Бор же считал, что их эксперименты можно трактовать так, что напряжение соответствует переходу атома из основного состояния в другое стационарное состояние нейтрального атома.
С точки зрения теории Бора, надо было ожидать, что, энергия необходимая для удаления электрона из атома ртути, должна совпадать с пределом серии Пашена 1850, 1403, 1269 А. Расчет приводит к потенциалу ионизации 10,5 в вместо 4,9 в. Бор писал, что если его рассуждения верны, то измерения Франка и Герца подтверждают его теорию. Если же потенциал ионизации ртути таков, как предполагают Франк и Герц, то возникают трудности при объяснении постоянной Ридберга. В дальнейшем опыты Дэвиса и Готье показали, что наблюдавшаяся в опытах Франка и Герца ионизация вызвана влиянием фотоэлектрического эффекта, возбуждаемого при освещении металлических частей светом, излучаемых при возвращении атомов ртути в нормальное состояние.
В 1961 г. в своих воспоминаниях о Резерфорде, Бор вспоминал о сложной ситуации, которая создалась в связи с опытами Франка и Герца. С одной стороны, эти опыты представляли "наиболее яркое доказательство скачкообразности энергетических переходов в атомных процессах", а с другой , энергия ионизации оказалась вдвое меньше, чем можно было ожидать на основании объяснения спектров ртути. Все разрешилось в 1918 г. после опытов Дэвиса и Готье.
Работа Бора "О строении атомов и молекул " стала широко известна среди физиков. Очень благоприятно отозвался о теории атома Бора Эйнштейн, включился в ее развитие Зомерфельд, признали ее безусловную ценность Лоренц, Планк, Резерфорд, Джинс.
Краткая хроника событий, связанных с ее развитием такова.
1913 г., июль, - опубликована первая часть статьи "О строении атомов и молекул".
Сентябрь - опубликована вторая часть статьи; опубликованы результаты опытов Эванса, подтвердившего вывод Бора о принадлежности серии Пикеринга ионизированному гелию; обсуждена теория Бора о принадлежности серии Пикеринга ионизированному гелию; обсуждена теория Бора на собрании Британской ассоциации развития науки (доклад Джинса); дискуссия с Фаулером о происхождении серии Пикеринга.
Октябрь - открытие эффекта Штарка.
Ноябрь - статья Варбура, рассмотревшего эффекты Штарка и Зеемана с точи зрения теории Бора; опубликована третья часть статьи Бора.
Декабрь - статья Мозли о спектре рентгеновского излучения, подтвердившая выводы Бора; доклад Бора на заседании Физического общества в Копенга-
- 26 -
гене; обзор по теории Бора сделанный К.Ф. Нестурхом на русском языке; письмо Резерфорда в "Nature" со ссылками на теорию Бора.
В дальнейшем продолжалось активное развитие теории атома Бора, на ее основе была объяснена периодическая система элементов Д.И. Менделеева, выдвижение Бором принципа соответствия, и другие работы, которые в конечном итоге привели к возникновению совершенно новой физики - квантовой механики.- 27 -
5. ЗАКЛЮЧЕНИЕ
В острый для физики период, когда был накоплен огромный экспериментальный материал, был нужен принципиально новый подход для создания физической картины атомных процессов. Важная заслуга Бора состоит в том, что он нашел такой подход. Он ориентировал физиков на исследование противоречивых сторон физической реальности микромира. Теория Бора позволила объяснить целый ряд сложных вопросов строения атома и фактов, чего была не в состоянии сделать классическая физика. За создание квантовой теории планетарного атома Бор в 1922 году был удостоен Нобелевской премии.
В честь Нильса Бора назван, открытый 18 февраля 1970 года в Объединенном институте ядерных исследований в Дубне, 105-й элемент периодической системы элементов - нильсборий (Ns).
В свое время П.Л. Капица писал о Боре : "Во всей мировой науке в наши дни не было человека с таким влиянием на естествознание, как Бор. Из всех теоретических троп тропа Бора была самой значительной."
В своей статье , "Слово о Нильсе Боре", Лев Давыдович Ландау говорит:
" Я думаю, что Бор был очень смелым человеком, потому что только очень смелый человек может совершить такой гигантский переворот в мире физических представлений, какой совершил он... (Задумайтесь на секунду: что же надо совершить физику в XX в., чтобы попасть в школьный учебник!)."
По образному выражению В.Л. Гинзбурга о Нильсе Боре:"... великий физик зажег маяк, которые долгие годы освещал дорогу физикам всего мира. Этот огонь будет источником света и тепла не только для нашего, но и для будущих поколений."
- 28 -
ЛИТЕРАТУРА1. Гернек Ф. Пионеры атомного века. Великие исследователи от Макс- велла до Гейзенберга. - М.: "Прогресс",1974.
2. Данин Д. Нильс Бор. - М.: "Молодая гвардия", 1978.
3. Капица П. Л. Памяти Нильса Бора. - Природа, 1963, #1, с. 67.
4. Клайн Б. В поисках. Физики и квантовая теория. - М.: "Атомиздат," 1971.
5. Кляус Е. М., Франкфурт У. И., Френк А.М. Нильс Бор. - М.: "Наука", 1977.
6. Ландау Л.Д. Слово о Нильсе Боре. - "Комсомольская правда", 1965, 6 октября.
7. Мур Р. Нильс Бор - человек и ученый. - М.: "Мир", 1969.
8. Нильс Бор. Жизнь и творчество. (Сборник статей). - М.:"Наука", 1967.
9. Франкфурт У. И. Френк А. М. У истоков квантовой теории. - М.: "На- ука", 1975.
10. Храмов Ю. А. Физики. Биографический справочник. - Киев.: "Наукова думка", 1977.
НИЖНЕТАГИЛЬСКИЙ ГОСУДАРСТВЕННЫЙ ПЕДАГОГИЧЕСКИЙ ИНСТИТУТ
КАФЕДРА ФИЗИКИ
РЕФЕРАТ
«ИСТОРИЯ СОЗДАНИЯ ТЕОРИИ АТОМА БОРА»
Выполнила: Жигунова Е. В. гр. 31-Ф
Руководитель: Фискинд Е.Э.
1999
Похожие работы
... сумки. Группа однокурсников Бора организовала кружок “Эклиптика”. В его состав входили братья Бор . На кружке студенты обсуждали проблемы философии и физики , и все очень быстро заметили, что Боры лучше всего выглядят тогда, когда выступают дуэтом. Уже в Университете Нильс Бор обнаружил в себе тягу к исследованию загадок атомарной структуры вещество , а Харальд Бор проявил в себе наклонности к ...
... квантовой механике оказало воздействие на решение вопроса о причинной обусловленности и о строгой предсказуемости всех природных процессов. Вместе с другими ведущими представителями квантовой теории Нильс Бор придерживался мнения, что исследование субатомных явлений в мельчайших подробностях невозможно, потому что любая попытка изучения этих процессов сопровождается нежелательным вмешательством ...
... , а с другой - к выяснению структуры отдельных атомов и установлению связи между ними. Однако оставалось еще много явлений в этой области, объяснить которые теория Бора не могла. Движение электронов в атомах Бор представлял как простое механическое, однако оно является сложным и своеобразным. Это своеобразие было объяснено новой квантовой теорией. Отсюда и пошло: “Карпускулярно-вролновой дуализм ...
... университет, который окончил в 1908 году. В 1911-1912 годах Нильс Бор работал под руководством английского физика Дж. Дж. Томсона в Кавендишской лаборатории Кембриджского университета. В 1912-1913 годы Нильс Хенрик Давид Бор работал в Манчестерском университетете, в лаборатории Э. Резерфорда. В 1913 году Нильс Бор создал первую квантовую теорию атома водорода, в которой он: 1) Показал, что ...
0 комментариев