Навигация
Тройные точки. Диаграммы состояния
1.6. Тройные точки. Диаграммы состояния.
Допустим, что число фаз химически однородного вещества, находящихся в равновесии друг с другом, равно трем. Примером может служить система, состоящая из твердой фазы, жидкости и пара. Для равновесия необходимо выполнение трех условий:
j1 (Р, Т) = j2 (Р, Т)
j2 (Р, Т) = ё3 (Р, Т)
j3 (Р, Т) = j1 ( Р, Т) (1)
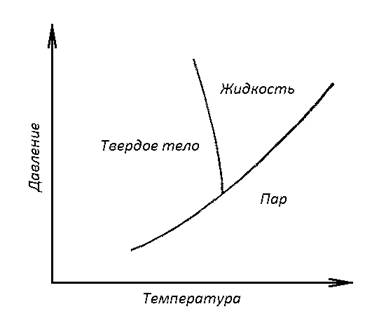
Первое есть условие равновесия между жидкостью и ее паром; второе - между жидкостью и твердой фазой; третье - между твердой фазой и паром. Эти три условия не независимы. Каждое из них является следствием двух остальных. Первое уравнение системы (1) изображает на плоскости кривую равновесия между газом и жидкостью, т.е. кривую испарения 12 (рис.5 ) .Второе изображает кривую равновесия твердой и жидкой фаз 23. Она называется кривой плавления. Кривая плавления пересекается с кривой испарения в точке А, называемой тройной точкой. Через тройную точку должна проходить и кривая возгонки 32, т.е. кривая равновесия между твердой и газообразной фазами. Это непосредственно следует из третьего уравнения (1). Таким образом, три фазы могут находиться в равновесии друг с другом, вообще говоря, лишь в одной, а именно тройной точке, т.е. при вполне определенных значениях температуры и давлениях.
В тройной точке кривая возгонки 31 поднимается круче кривой испарения 12. В самом деле, наклоны этих кривых определяется уравнениями Клайперона - Клаузиуса:
dP12 q12 dp13 q13
_____=______ , ________=__________
dT T (v1-v2) dT T (v1 - v3)
Знаменатели этих выражений практически совпадают, так как удельными объемами жидкой и твердой фаз можно пренебречь. Кроме того, в тройной точке, как это следует из первого начала термодинамики, q13 =q12+ q23.. Значит, q13 > q12, а потому dP13 / dT > /dT.

![]() Р 2 К
Р 2 К
(жидк.)
![]() В С
В С
![]() 3 А 1
3 А 1
![]() (тв.) (газ)
(тв.) (газ)
D
![]() Т рис. 5
Т рис. 5
Для воды тройная точка лежит примерно на 0,0080С выше точки плавления при нормальном атмосферном давлении. Давление в тройной точке составляет около 4, 58 мм рт. ст. Тройная точка воды является основной реперной точкой при построении абсолютной термодинамической шкале температуры Цельсия.
Кривые испарения, плавления и возгонки делят ТР на три области 1,2,3 (см. рис. ). Точками области 1 соответствует газообразное, области 2 - жидкое, области 3 - твердое состояние вещества. Плоскость ТР с указанными тремя кривыми равновесия называется диаграммой состояния. Диаграмма состояния позволяет судить, какие будут происходить фазовые превращения при том или ином процессе. Допустим, например, что производится нагревание при постоянном давлении. На диаграмме состояния такой процесс представляется горизонтальной прямой. Если эта прямая выше тройной, но ниже критической точки, то в точке В она пересечет кривую плавления, а в точке С - кривую испарения. Значит, при нагревании твердое тело сначала расплавится (точка В), а затем жидкость испарится (точка С). если же указанная прямая проходит ниже тройной точки, то она пересечет только кривую возгонки в некоторой точке D, в которой и произойдет непосредственное превращение твердого тела в газообразное состояние. Промежуточного состояния не будет.
Поставим теперь вопрос о возможности существования четырех или большего числа фаз химически однородного вещества. В случае четырех фаз для равновесия необходимо выполнение шести уравнений типа (1), из которых однако, независимы только три. Геометрически задача сводится к нахождению общей точки пересечения трех кривых равновесия фаз, выражаемых, например, уравнениями
j 1 (Р,Т) = j2 (Р, Т) = j 3 (Р, Т, = j 4 ( Р, Т)
Но три кривые пересекаются, вообще говоря, в трех, а не в одной точке. Пересечение в одной точке является исключительным случаем, с которым практически можно не считаться. Физически это означает, что четыре или больше число фаз химически однородного вещества не могут находиться в равновесии между собой ни при каких давлениях и температурах. Максимальное число фаз, находящихся в равновесии друг с другом, не может превышать трех.
Если число фаз, в которых может находиться химически однородное вещество при всевозможных значениях температуры и давлениях, превышает три, то все равновесные состояния системы можно также изобразить диаграммой на плоскости ТР, называемой по - прежнему диаграммой состояния. Плоскость ТР разбивается на ряд областей. Каждая точка плоскости ТР, если она лежит на границе области, изображает однофазное состояние вещества. Области граничат между собой вдоль кривых, каждая из которых является кривой равновесия соответствующих двух фаз. Всякая точка, лежавшая на кривой равновесия, изображает двухфазное состояние вещества, причем в этом состоянии фазы могут быть представлены в любых пропорциях. Кривые равновесия фаз могут пересекаться по три в отдельных точках. Это тройные точки, в которых находятся в равновесии три граничащие друг с другом фазы.

![]() Р F
Р F
![]() M` N` R
M` N` R

![]() Ромб
L K
Ромб
L K
![]() M N1 N2 Q
M N1 N2 Q
Moн. Р
S
![]() G T газ. Т рис. 6
G T газ. Т рис. 6
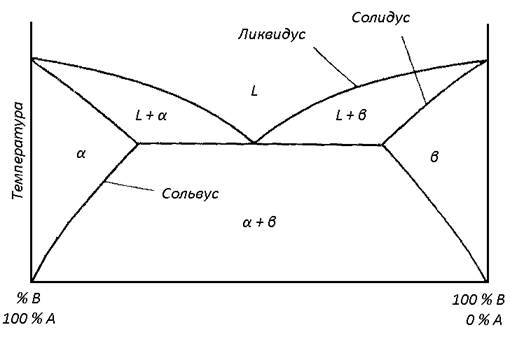
На диаграмме состояния сразу видно, в каких равновесных состояниях может находиться вещество при тех или иных значениях температуры и давлениях, а также когда и какие оно будет испытывать фазовые превращения при том или ином процессе. В качестве примера на рис.6 представлена в упрощенном виде диаграмма состояния серы. Сера может существовать в двух кристаллических модификациях - моноклинной и ромбической. В соответствии с этим на диаграмме состояния имеются три тройные точки, а именно S, T, L. Область моноклинной модификации ограничена треугольником STL. Область ромбической модификации ограничена кривой GSLF. Возьмем ромбические кристаллы серы при комнатной температуре и нормальном давлении и будем нагревать их, сохраняя давление постоянным. Этот процесс изобразится горизонтальной прямой MN1N2Q. В точке N1, где эта прямая пересекает кривую равновесия между двумя кристаллическими модификациями, ромбические кристаллы превращаются в моноклинные (при атмосферном давлении точке N1 соответствует температура 95, 50 С). в точке N2 (при температуре 119, 20 С) моноклинные кристаллы плавятся. В точке Р (при температуре 444, 600 С) жидкая сера закипает. При охлаждении вещества те же превращения будут происходить в обратном порядке. Если ромбические кристаллы взять в состоянии М` под давлением выше давления в тройной точке L (1280 атм), то изобара M`N` пройдет выше этой точки. Поэтому превращения ромбических кристаллов в моноклинные происходить не будут. Ромбические кристаллы в точке N` будут сразу плавиться.
Кривая испарения оканчивается на критической точке. Только благодаря этому возможен непрерывный переход вещества из жидкого состояния в газообразное и наоборот, т.е. такой переход, который не сопровождается фазовыми превращениями. Это связано с тем, что различие между газом и жидкостью является чисто количественными. Газ и жидкость отличаются друг от друга только большей или меньшей ролью взаимодействия между молекулами. Но оба эти состояния изотропны и характеризуются одинаковой симметрией внутреннего строения. Совсем другой характер имеет различие между двумя кристаллической и жидкой фазами или между двумя различными кристаллическими фазами. Эти фазы отличаются друг от друга не только количественно, но и качественно, а именно симметрией внутреннего строения. О всяком же свойстве симметрии можно сказать, что оно либо есть, либо его нет. То или иное свойство симметрии может появляться или исчезать только сразу, скачком, а не непрерывно. В каждом состоянии тело будет обладать либо одной, либо другой симметрией, а потому можно указать, к которой из двух фаз оно относится. Кривая равновесия таких фаз поэтому не может обрываться в изолированной точке. Она может либо заканчиваться в точке пересечения ее с другой кривой равновесия, либо уходить в бесконечность.
Похожие работы
... порядка 40%), имеет небольшую прочность и твердость (HB = 65 - I30, в зависимости от величины зерна). Феррит, в зависимости от характера протекающих фазовых превращений, в структуре железоуглеродистых сплавов может находиться в виде различных структурных состояний: феррит, как основа структуры сплава (Ф); феррит, как вторая (избыточная) фаза, располагающаяся по границам перлитных колоний, в виде ...
... как в азеотропных смесях коннода вертикальна, нода вырождается в точку. 3. Фазовые эффекты и уравнение Ван-дер-Ваальса для бинарных азеотропных смесей. Фазовые эффекты в бинарных азеотропных смесях. На рисунках 3.1 - 3.4 изображены диаграммы объем - состав фаз, и энтропия – состав фаз для азеотропа с минимумом температуры кипения. Если рассматриваемый состав равен составу ...
... эпоксидно-каучуковых систем определенным образом связана с конечной фазовой структурой отвержденных систем. Результаты термодинамического и кинетического анализа фазовых превращений, сопровождающих отверждение эпоксидного олигомера, позволяют предположить следующий механизм формирования фазовой структуры эпоксидно-каучуковой системы. Процесс фазового разделения системы включает в себя зарождение ...
... Si, поскольку эвтектическая температура этой системы крайне мала по сравнению с температурами плавления чистого золота или чистого кремния (рис 9). Растворимости золота в кремнии и кремния в золоте слишком малы, чтобы их отобразить на обычной фазовой диаграмме состояний. Из-за низкой эвтектической температуры оказывается выгодно устанавливать кристаллы микросхем на золотые подложки, держатели или ...
0 комментариев