Навигация
Исследование фазовых эффектов в бинарных азеотропных смесях
Министерство образования и науки Российской Федерации
МОСКОВСКАЯ ГОСУДАРСТВЕННАЯ АКАДЕМИЯ ТОНКОЙ ХИМИЧЕСКОЙ ТЕХНОЛОГИИ им. М.В. Ломоносова
Кафедра химии и технологии основного органического синтезаАттестационная работа по теме:
«Исследование фазовых эффектов в бинарных азеотропных смесях»
на соискание степени бакалавра по направлению 550800 «Химическая технология и биотехнология»
Москва 2004Оглавление
Введение………………………………………………………….……………….3
1. Литературный обзор…………………………………………………………...3
1.1.Диаграммы объем-состав пара; состав жидкости и энтропия-состав пара, состав жидкости…………………………………………………………………..3
1.2.Вид изотермо-изобар в бинарных смесях…………………………………..6
1.3.Некоторые понятия физико-химического анализа………………………....7
1.4.Определение ноды как вектора…………………………………………….11
1.5.Выбор направления ноды и реноды……………………………….……….12
1.6.Изменение концентрации фаз при фазовом обмене при постоянной температуре и давлении………………………………………………………...13
1.7.Общие фазовые эффекты…………………………………………………...16
1.8.Цель работы……………………………………………………….…………18
2. Частные фазовые эффекты и вывод уравнения Ван-дер-Ваальса………..19
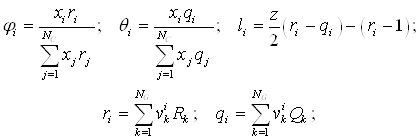
2.1.Вывод основных уравнений для частных фазовых эффектов жидкой и паровой фаз при постоянной температуре и давлении ……………………....19
2.2.Вывод уравнений Ван-дер-Ваальса для жидкой и паровой фаз…..……26
3. Фазовые эффекты и уравнение Ван-дер-Ваальса для бинарных азеотропных смесей………………………..…………………………………..30
3.1. Фазовые эффекты в бинарных азеотропных смесях……………………..30
3.2. Фазовые эффекты в гетероазеотропных смесях…………...………...45 3.3.Уравнение Ван-дер-Ваальса в терминах общих и частных фазовых эффектов…………………………………………………….…………………...51
4. Заключение……………………………………………………………………51
Список использованной литературы…………………………………………..52
Обозначения…………………………………………………………………......54
Введение.
Уравнение Ван-дер-Ваальса используется при исследовании процессов разделения и является базовым уравнением при качественном исследовании этих процессов. Распространение уравнения такого типа на многокомпонентные смеси осуществлено А.В. Сторонкиным. Вместе с тем, для понимания всех тонкостей уравнения Ван-дер-Ваальса-Сторонкина необходимо изучить уравнение Ван-дер-Ваальса, которое было получено для бинарных смесей.
Уравнение Ван-дер-Ваальса тесно связано с уравнениями так называемых фазовых эффектов. А. В. Сторонкиным рассмотрены фазовые эффекты, использующие химические потенциалы. В рукописных материалах Л. А. Серафимова введено понятие общих и частных фазовых эффектов. Данное исследование посвящено анализу в азеотропных смесях взаимосвязи фазовых эффектов с уравнением Ван-дер-Ваальса.
1. Литературный обзор.
1.1.Диаграммы объем-состав пара, состав жидкости и энтропия-состав пара, состав жидкости
В бинарных двухфазных системах в общем случае составы фаз неодинаковы. В связи с этим при взаимных превращениях фаз, т.е. в условиях массопереноса веществ из одной фазы в другую фазу происходит изменение их состава и других параметров как экстенсивных, так и интенсивных. К интенсивным параметрам относят температуру, давление и химические потенциалы компонентов. К экстенсивным – все термодинамические функции, такие как внутренняя энергия, энтальпия, функция Гиббса, а также количество вещества.
Для учета влияния изменения состава фаз в результате их взаимного превращения на их состояние А.В. Сторонкиным и М.И. Шульцем было введено понятие изобарно-изотермических фазовых эффектов [1]. Изобарно-изотермический фазовый эффект возникает каждый раз, когда массоперенос рассматривается при постоянной температуре и давлении. Осуществить массоперенос такого типа в двухфазной системе, например жидкость-пар или жидкость-жидкость практически невозможно. Эти процессы протекают обычно или при постоянном давлении или при постоянной температуре.
Как известно двухфазная многокомпонентная система имеет число степеней свободы определяемое уравнением:
f=n-Ф+2=n, Ф=2 1.1
Если закреплены давление и температура, т.е. P=const и T=const, то f=0, то есть, в параметрическом пространстве состояний такая система характеризуется точкой. Таким образом, закрепление давления и температуры однозначно определяет состав двухфазной бинарной смеси и, следовательно, в данном случае не может быть никаких изменений за счет фазовых процессов. Поэтому в бинарных смесях изобарно-изотермический фазовый эффект несовместим с фазовым равновесием. Рассмотрим вопрос подробней. Как известно, фазовое равновесие определяется следующим набором равенств, в случае бинарной смеси
Рп = Рж
Тп = Тж 1.2
µп1 = µж1
µп2 = µж2
Если закреплены давление и температура, то химические потенциалы первого и второго компонента должны быть постоянными, так как исчерпаны степени свободы. Следовательно, постоянными будут и составы равновесных фаз. Поэтому в рассматриваемом случае изобарно-изотермический фазовый эффект считается не процессом, а свойством двухфазной системы, которое выражается специфическим образом.
Состояние компонентов в фазах характеризуется при постоянном давлении и температуре их химическими потенциалами µ1 и µ2.
Будем различать фазовые эффекты общего типа, которые связаны с химическими потенциалами и фазовые эффекты частного типа, которые связаны с экстенсивными функциями. Обычно фазовые эффекты относят к той или иной фазе двухфазной системы.
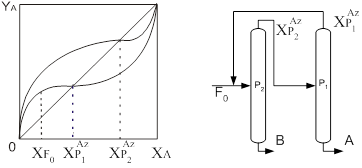
На рисунке 1.1 изображены исследуемые диаграммы зеотропных смесей при T=соnst и Р=соnst.
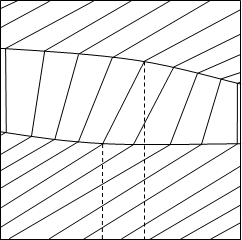
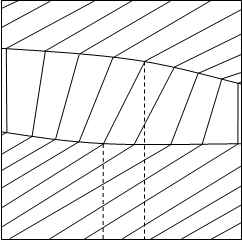 V S
V S
V2оп пар S2оп пар
V1оп S1оп
V2ож S2ож S1ож
V1ож
жидкость жидкость
х1 у1 х1,у1 х1 у1 х1,у1
a) б) Рис.1.1. Диаграммы а) V - х, у, Т=const и б) S - х, у, Р=constВся диаграмма в этом случае имеет три области: область перегретого пара, область гетерогенности и область переохлажденной жидкости. Область пара от гетерогенной области отделена линией насыщенного пара, гетерогенная область отделена от области жидкости линией кипящей жидкости. В гетерогенной области проведены конноды жидкость-пар — отрезки, соединяющие состояние жидкости и пара. При Т=соnst равновесные составы имеют одинаковое давление и химические потенциалы компонентов, при Р=соnst равновесные составы имеют одинаковую температуру и одинаковые химические потенциалы компонентов. Конноды, как изотермо-изобары гетерогенной части, имеют после точек излома продолжение в областях пара и жидкости. Вдоль конноды жидкость-пар химические потенциалы не изменяются, а изменяется (скачком) объем и энтропия от Vж к Vп и от Sж к Sп. Вдоль же изотермо-изобар, так как давление и температура постоянны, справедливо уравнение Гиббса-Дюгема:
x1 dμ1ж+ x2 dμ2ж=0, y1 dμ1п+ y2 dμ2п=0. 1.3
т.е. химические потенциалы не постоянны.
1.2.Вид изотермо-изобар в бинарных смесях.
Образование раствора при постоянном давлении и температуре сопровождается повышением энтропии Sм и понижением Gм потенциала, при этом [2, 3]:
Hм=T Sм + Gм 1.4
Так как величина G при смешении меньше по сравнению с величиной, определяемой по аддитивности, а величина S больше по значению с величиной, определяемой по аддитивности, то различие между ними есть тепловыделение |T Sм| < |Gм| 1.5или теплопоглощение
|T Sм| > |Gм| 1.6
Учитывая, что H - G >0, изотермо-изобара всегда обращена выпуклостью вверх, т.е. в бинарной смеси![]() 1.7 в то время как
1.7 в то время как ![]() 1.8
1.8
Это можно объяснить следующим образом. Так как температура кипения легколетучего компонента меньше температуры кипения тяжелолетучего компонента, то изотермо-изобара будет иметь на диаграмме S - x, y тангенс угла наклона положительный вдоль абсциссы x1. Эти свойства изотермо-изобары в бинарной смеси не зависят от того, рассматривается жидкая фаза или паровая. Однако эта кривизна изотермо-изобар очень мала, так как мала энтропия образования раствора. В качестве примера: энтропия образования 0,5 мольного раствора (х=0,5) идеальной смеси, т.е. максимальная энтропия образования равна:
-R(x1lnx1+x2lnx2)= - R lnx1= -1,98· ln 0,5 =1,3724 кал/(моль К).
Что касается объема, то объем вдоль изотермо-изобары может уменьшаться, увеличиваться или на одном участке увеличиваться, а на другом уменьшаться. Но это уменьшение или увеличение незначительно по сравнению с величиной объема пара. Поэтому в общем случае вдоль изотермо-изобар жидкости и пара, энтропию и объем можно принять линейно-зависимыми от состава.
Похожие работы
... С целью увеличения выхода и упрощения технологии процесса за счет исключения стадии щелочной промывки из процесса осушки 1,3-диоксолана и повышения экологической чистоты технологии разделения азеотропной смеси 1,3-диоксолан-вода, проводят экстрактивную ректификацию с использованием в качестве экстрагента этиленгликоль. Предлагаемое изобретение может быть использовано для получения 1,3-диоксолана, ...
... смеси на четыре продукта [17]. I – IV — продукты. 2. ПОСТАНОВКА ЗАДАЧИ ИССЛЕДОВАНИЯ. Целью настоящей работы является определение оптимальных рабочих параметров процесса экстрактивной ректификации смеси ацетон-хлороформ азеотропного состава в сложной колонне с боковой укрепляющей секцией. К таким параметрам относятся температура и расход разделяющего агента, тарелки подачи исходной смеси и ...
... резкое изменение температуры, обусловленное скачкообразным изменением концентрации РА. [12] Постановка задачи Целью данной работы является поиск оптимальной схемы экстрактивной ректификации смеси бензол-циклогексан-этилбензол-н-пропилбензол, содержащей один бинарный азеотроп. Для этого необходимо выполнить: · параметрическую оптимизацию традиционных схем экстрактивной ректификации; · ...
... 8,6961 6,6957 9,9694 - Энергозатраты по схемам ГДЖ/ч 10,0379 15,3918 9,9624 7. Выводы В результате проделанной работы решена задача разделения промышленной смеси продуктов синтеза хлорбензола. В качестве модели наиболее адекватно описывающей парожидкостное равновесие смеси была выбрана модель UNIFAC. Были синтезированы две схемы, состоящие из двух простых двухсекционных колонн ...

0 комментариев