Навигация
Под ми понимают органические соединения содержащие в составе своей структурной формулы одну или несколько гидроксильных групп (OH). Таковыми являются все спирты и фенолы.
АЦИКЛИЧЕСКИЕ ОКСИСОЕДИНЕНИЯ
Спирты.Спиртами называются соединения общей формулой ROH, где R - любая алкильная или замещённая алкильная группа. Эта группа может быть первичной, вторичной или третичной; она может быть как ациклической, так и циклической; она может содержать двойную связь, атом галогена или ароматическое кольцо, например:
CH3
![]()
![]() OH
OH
CH3-C-CH3 H2C=CH-CH2OH
![]() Аллиловый спирт
Аллиловый спирт
Трет-бутиловый
спирт
![]()
![]() CH2OH CH2 -CH2 CH2-CH-CH2
CH2OH CH2 -CH2 CH2-CH-CH2
![]()
![]()
![]()
![]()
![]()
Cl OH OH OH OH
Бензиловый спирт этиленхлоргидрин глцерин
(b-хлорэтиловый спирт)
все спирты содержат гидроксильную группу (-OH), которая является функциональной и определяет свойства, характерные для данного класса соединений. Строение R влияет на скорость, с которой спирт вступает в некоторые реакции, и иногда на характер реакции.
Одноатомные насыщенные спирты.
Классификация.
Спирты классифицируют на первичные, вторичные и третичные в зависимости оттого, с каким атомом углерода (связана гидроксильная группа). Атом углерода считается первичным, вторичным третичным в зависимости от числа связанных с ним других атомов углерода.
H R R
R-C-OH R-C-OH R-C-OH
H H H
Первичный вторичный третичный
Номенклатура.
Для названия спиртов по номенклатуре IUPAC выбирают наиболее длинную цепь, содержащую гидроксильную группу. Нумерацию начинают с того конца цепи к которому ближе находится эта группа. Принадлежность соединения к классу спиртов обозначается окончанием «ол». Между основой названия и окончанием ставят цифру, обозначающую атом углерода у которой стоит OH-группа. Если имеются алкильные заместители, то название спирта начинают с цыфр(ы), указывающих (указывающей) положение заместителя (заместителей) в цепи, далее идёт название заместителей как радикалов.
Простейшие спирты можно называть по карбинольной номенклатуре, беря за основу название первого представителя спиртов, CH3OH “карбинол”. Название начинают с перечисления радикалов, замещающих атомы водорда, стоящие у углеродного атома, в метиловом спирте CH3OH, например:
OH OH
![]()
![]()
CH3 CH2OH CH3 CH CH3 CH3 C CH2CH3
CH3
Диметилэтилкарбинол
Часто простейшие представители класса спиртов называют по рациоальной (радикальной) номенклатуре, по названию углеводородного радикала (см. таблицу).
Изомерия.
Изомерия спиртов аналогична изомерии галогенопроизводных. В случае спиртов кроме изменения строения углеродного скелета может изменяться положение -OH группы.Для соединения общей формулы C5H11OH=C5H12O существует семь изомеров:
OH OH
CH3CH2CH2CH2CH2OH CH3CHCH2CH2CH3 CH3CH2CHCH2CH3
Пентанол-1 пентанол-2 пентанол-3
![]()
![]() CH3 CH3
OH CH3 CH3
CH3 CH3
OH CH3 CH3
CH3CCH2CH3 CH3CHCHCH3 CH3CHCH2CH2OH CH3CH2CHCH2OH
![]()
OH
2-метилбутанол-2 3-метилбутанол-2 3-метилбутанол-1 2-метилбутанол-1
Физические свойства.
Спирты сильно отличаются по свойствам от углеводородов вследствие присутствия в их молекуле очень полярной гидроксильной группы. Спирты - бесцветные вещества с плотностью меньше единицы.
| Формула | Номенклатура | Т.пл.,°C | Т.кип.,°C | Растворимость Г/100г H2O | |
| IUPAC | радикальная | ||||
| CH3OH CH3CH2OH CH3CH2CH2OH CH3CH(OH)CH3 CH3(CH2)2CH2OH (CH3)2CHCH2OH CH3CH(OH)CH2CH3 (CH3)3COH CH3 (CH2)3CH2OH CH3 (CH2)4CH2OH CH3(CH2)5CH2OH CH3(CH2)6CH2OH CH3 (CH2)12CH2OH | Метанол Этанол Пропанол-1 Пропанол-2 Бутанол-1 2-метилпропанол-1 Бутанол-2 2-метилпропанол-2 Пентанол-1 Гексанол-1 Гептанол-1 Октанол-1 Тетрадеканол-1 | Метиловый Этиловый н-Пропиловый Изопропиловый н-Бутиловый Изобутиловый втор-Бутиловый трет-Бутиловый н-Амиловый н-Гексиловый н-Гептиловый н-Октиловый н-Тетрадециловый | -97 -115 -126 -86 -90 -108 -114 26 -79 -52 -34 -15 38 | 65 78 97 83 118 108 100 83 138 157 176 195 - | ¥ ¥ ¥ ¥ 7,9 10,2 12,5 2,3 0,6 0,2 0,05 - |
Такое отличие в физических свойствах между спиртами и многими другими классами органических соединений объясняется наличием в молекулах спиртов гидроксильной группы. В гидроксильной группе атом кислорода, проявляя электроакцепторные свойства, «стягивает на себя» электронную плотность от связанного с ним атома водорода, и у последнего образуется дефицит электронной плотности. В результате между атомом водорода гидроксильной группы и свободной электронной парой кислорода OH-группы другой молекулы спирта возникает водородная связь, за счёт которой происходит ассоциация молекул спиртов:
![]()
![]()
![]()
![]()
![]() H-O H-O H-O H-O
H-O H-O H-O H-O
Повышение температур кипения спиртов по сравнению с температурой кипения некоторых других классов органических соединений объясняется необходимостью введения дополнительной энергии на разрыв водородных связей перед переводом из жидкого в парообразное состояние. Энергия электростатической водородной связи около 5 ккал/моль (20,93*103 Дж/моль).[Для большинства ковалентных связей эта величина составляет 50-100 ккал/моль (209,34*103 - 418,68*103 Дж/моль)].
Образование водородных связей между молекулами спиртов и воды - причина хорошей растворимости первых представителей ряда спиртов в воде:
![]() R
R
![]()
![]()
![]()
![]()
![]()
![]() R H O H
R H O H
![]()
![]()
![]()
![]() H-O H-O H O
H-O H-O H O
R
С увеличением массы углеводородного радикала в молекуле спирта уменьшается растворимость спиртов в воде и увеличиваются их температуры кипения (температуры кипения уменьшаются пи наличии разветвлений). Температуры кипения спиртов значительно выше, чем температуры кипения соответствующих углеводородов (это объясняется ассоциацией молекул спиртов водородными связями).
Методы получения.
Гидролиз моногалогенопроизводных.
В лабораторных условиях, для получения спиртов часто используют реакцию гидролиза галогенопроизводных водными растворами щелочей. Щёлочь используют для ускорения реакции и для связывания выделяющегося при гидролизе галогеноводорода, подавляя обратимость процесса:
Где X:Cl, Br, I; например:
![]() CH3Br + HOH NaOH CH3OH + NaBr + H2O
CH3Br + HOH NaOH CH3OH + NaBr + H2O
Бромметан метанол
Реакция может протекать по механизмам SN2 или SN1 в зависимости от строения исходного галогенпроизводного. Реакционная способность различных соответствующих галогенпроизводных в реакциях гидролиза уменьшается в ряду :
RI > RBr > RCl >> RF Наиболее легко гидролизуется галоген у третичного атома углерода, труднее у вторичного и наиболее трудно у первичного. Если у атома углерода, соседнего с атомом несущим галоген, имеется хотя бы один атом водорода, то при взаимодействии с водными растворами щелочей на ряду с гидролизом может протекать реакция дегидрогалогенирования (отщепления галогеноводорода):OH
![]()
![]()
![]() CH3CHCH3
CH3CHCH3
Пропанол-2
NaOH
![]() CH3CHCH3
CH3CHCH3
![]() H2O
H2O
![]() Cl CH3 CH=CH2
Cl CH3 CH=CH2
2-хлорпропан пропен
Гидратация этиленовых углеводородов.
Присоединение воды к двойной связи этиленовых углеводородов с образованием спиртов можно осуществить в присутствии серной кислоты. К несимметричным олефинам вода присоединяется в соответствии с правилом Марковникова:
+
H-O-H
![]() + H2O H2O
+
+ H2O H2O
+
![]()
![]()
![]() RCH=CH2 + H+ RCHCH3 R-CH-CH3 RCHCH3 + H3O
RCH=CH2 + H+ RCHCH3 R-CH-CH3 RCHCH3 + H3O
![]()
OH
Спирты можно получить прямой перегонкой олефинов при 300-350 °C в присутствии оксида алюминия:
OH
![]() 300-350 °C
300-350 °C
![]() CH3CH=CH2 + H2O CH3CHCH3
CH3CH=CH2 + H2O CH3CHCH3
Пропен Al2O3 пропанол-2
Гидроборирование - окисление этиленовых углеводородов.
Это современный способ получения спиртов из олефинов. В результате присоединения диборана (BH3)2 к этиленовым углеводородам и последующего окисления образующихся триалкилборанов щелочным раствором пероксида водорода образуются спирты, в которых формально фрагменты воды присоединены к исходному олефину против правила Марковникова. H2O2
![]()
![]() 6RCH=CH2 + (BH3)2 2(RCH2CH2)3B 6 RCH2CH2OH + 2B(OH)3
6RCH=CH2 + (BH3)2 2(RCH2CH2)3B 6 RCH2CH2OH + 2B(OH)3
алкены диборан алкилбораны OH- спирты борная к-та
Эта реакция гидроборирования очень проста и удобна, выходы очень высоки, и её можно использовать для синтеза для синтеза соединений, которые трудно получить из алкенов каким-либо другим способом.
Диборан- димер гипотетического BH3 (борана), который в рассматриваемых реакциях реагирует как BH3.
![]()
![]()
![]()
![]()
![]()
![]() H H H H
H H H H
![]()
![]()
![]()
![]()
![]()
![]() H:B
B B
H:B
B B
H H H H
Боран диборан
Гидроборирование включает присоединение BH3 по двойной связи, водород направляется к одному из атомов углерода двойной связи, а бор - к другому. Алкилбораны могут затем подвергаться окислению, при котором бор заменяется на OH-группу.
![]()
![]()
![]()
![]()
![]()
![]()
![]() H2O2 OH-
H2O2 OH-
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() C=C + H-B - C-C- -C-C-
C=C + H-B - C-C- -C-C-
![]()
![]() Алкен
H B H OH
Алкен
H B H OH
![]()
![]() H-B = H-BH2, H-BR2
H-B = H-BH2, H-BR2
Таким образом, двухстадийная реакция гидроборирования - окисления в действительности представляет присоединение элементов воды H-OH по двойной углерод - углеродной связи.
CH3 CH3
![]()
![]() (BH3)3 H2O2, OH-
(BH3)3 H2O2, OH-
![]()
![]() CH3 -C- CH3 =CH2 CH3 -C-CH2-CH2OH
CH3 -C- CH3 =CH2 CH3 -C-CH2-CH2OH
![]()
![]()
CH3 CH3
3,3-диметилбутен-1 3,3-диметилбутанол-1
(первичный)
Реакция гидроборирования протекает против правила Марковникова. Что интересно, в реакциях гидроборирования не происходит перегруппировок (очевидно, потому, что в это случае не образуются карбониевые ионы), и, следовательно, метод может быть использован без осложнений, которые часто сопровождают другие реакции присоединения.
Благодаря этому реакция гидроборирования - окисления приобретает большое синтетическое значение: она позволяет получать из алкенов спирты, которые недоступны другими методами; эти спирты служат исходными для синтеза многих соединений других классов.
Синтезы спиртов с помощью металорганических соединений (синтезы Гриньяра).
Спирты получают взаимодействием реактивов Гриньяра RMgX (где R: алкил; X: Cl, Br, I) или литий органических соединений Rli с альдегидами или кетонами. Образующиеся при этом алкоголяты при при обработке водой или разбавленными кислотами превращаются в соответствующие спирты. В зависимости от строения исходного карбонильного соединения можно получить первичный, вторичный или третичный спирт:
![]()
![]()
![]() O +
O +
![]()
![]()
![]()
![]() RMgX + H-C RCH2O-MgX
RMgX + H-C RCH2O-MgX
H H2O
![]() RCH2OH
RCH2OH
![]() O + H+ первичный спирт
O + H+ первичный спирт
![]()
![]()
![]() RLi + H-C RCH2O-Li
RLi + H-C RCH2O-Li
H
Фрмальдегид
![]()
![]()
![]() O R
O R
![]()
![]()
![]()
![]()
![]() RMgX + R’C CHO-Mg+X
RMgX + R’C CHO-Mg+X
![]()
![]() O H+ R’
O H+ R’
Альдегиды (R’![]() H)
H)
![]()
![]() R’ R
R’ R
![]()
![]()
![]() RMgX + C=O R’- CO-Mg+X
RMgX + C=O R’- CO-Mg+X
![]() R’- C-OH
R’- C-OH
![]()
![]()
![]() R’ R H+ R”
R’ R H+ R”
![]()
![]()
![]()
![]() RLi + C=O R’- CO-Li+ третичный спирт
RLi + C=O R’- CO-Li+ третичный спирт
Кетоны
Примеры синтезов:
![]()
![]() O
O
![]()
![]()
![]() CH3CH2MgBr + H-C
CH3CH2CH2OH
CH3CH2MgBr + H-C
CH3CH2CH2OH
этилмагнийбромид H пропанол-1
метаналь (первичный спирт)
![]() OH
OH
![]()
![]() O
O
![]() CH3CH2MgI + CH3C CH3CH2CHCH3
CH3CH2MgI + CH3C CH3CH2CHCH3
этилмагнийиодид H бутанол-2
этаналь (вторичный спирт)
O OH
![]()
![]()
![]()
![]()
![]() CH3MgCl + CH3CCH3 CH3CCH3
CH3MgCl + CH3CCH3 CH3CCH3
CH3
Метилмагний- пропанон 2-метилпропанол-2
хлорид (третичный спирт)
Связь углерод- магний в реактиве Гриньяра сильно полярна, причём углерод яляется отрицательным относительно электроположительного магния. Поэтому не удивительно, что в результате присоединения к карбонильному соединению органическая группа образует связь с углеродом, а магний - с кислородом. Продукт представляет собой магниевую соль слабо кислого спирта и легко превращается в спирт при прибавлении более сильной кислоты - воды.
![]()
![]() Cd+=Od-
Cd+=Od-
![]()
![]()
![]()
![]()
![]() H2O
H2O
![]()
![]() -C-OMgX - C- OH + Mg(OH)X
-C-OMgX - C- OH + Mg(OH)X
![]() R: MgX
R: MgX
d-d+ R R H+
спирт
Mg2+ + X- + H2O
Поскольку образовавшийся в процессе реакции Mg(OH)X представляет собой желатинообразное вещество, с которым трудно работать, поэтому вместо воды обычно используют разбавленную минеральную кислоту (HCl, H2SO4), так что образуются растворимые в воде соли магния.
В аналогичном синтезе для получения первичных спиртов, содержащих на два атома углерода больше, чем исходный реактив Гриньяра, используют окись этилена.
![]()
![]() H2C -CH2
+ RMgX RCH2CH2HMgX RCH2CH2OH
H2C -CH2
+ RMgX RCH2CH2HMgX RCH2CH2OH
![]()
![]() H2O первичный спирт
H2O первичный спирт
O + 2 атома углерода
Окись этилена
Органическая группа опять связывается с углеродом, а магний - с кислородом, но при этом разрушается углерод - кислородная s-связь в сильно напряжённом трёхчленном кольце.
Промышленные способы получения спиртов.
Метиловый спирт в промышленности получают из оксида углерода и водорода в присутствии катализаторов. В разных условиях можно получить как чистый метиловый спирт
350-400 °C , 21,27 Мпа
![]() СО + 2Н2 СН3ОН
СО + 2Н2 СН3ОН
катализатор
так и смесь его первичных гомологов, начиная с этилового спирта (синтол).
Метанол в больших масштабах получают гидрированием СО водородом примерно при 400°С и давлении 200 кгс/см2 над катализатором, представляющим собой смесь окиси хрома и окиси цинка.
В производстве синтола в качестве катализатора применяют железо и кобальт и процесс ведут при давлении в несколько десятков атмосфер и повышенной температуре.
4. Общим методом синтеза спиртов с небольшим молекулярным весом (этиловый, изопропиловый, втор-бутиловый, трет-бутиловый) является гидратация олефинов в присутствии серной кислоты. В зависимости от строения олефина образуются вторичные и третичные спирты (из первичных спиртов таким путём можно получить только этиловый, R = H):
H2O
![]()
![]() R─CH=CH2 + H2SO4 R─CH─CH3 RCHCH3 + H2SO4
R─CH=CH2 + H2SO4 R─CH─CH3 RCHCH3 + H2SO4
| |
OSO3H OH
R R
| H+ |
![]() C=CH2 + H2O C─CH3
C=CH2 + H2O C─CH3
| / |
R’ R ’OH
Реакция начинается с атаки ионом водорода того углеродного атома, который связан с бóльшим числом водородных атомов и является поэтому более электроотрицательным, чем соседний углерод (правило Марковникова). После этого к соседнему углероду присоединяется вода с выбросом Н+.
Важный способ получения этилового спирта, известный с древнейших времён, заключается в ферментативном гидролизе некоторых углеводов, содержащихся в различных природных источниках (фрукты, картофель, кукуруза, пшеница и др.), например:
![]() С6Н12О6 2С2Н5ОН + 2СО2
С6Н12О6 2С2Н5ОН + 2СО2
глюкоза
Химические свойства спиртов
Ряд химических свойств спиртов является общим для всех спиртов; имеются также и реакции, по-разному протекающие для первичных, вторичных и третичных спиртов.
Похожие работы
... синтетическим красителям и цели работы. Новые материалы требуют новых красителей, а потому тема по синтезу красителей всегда остаётся актуальной. Цель данной работы – синтез 4-окси-3-карбоксиазобензола, который является представителем большого класса азокрасителей. На примере его получения изучить условия проведения реакций диазотирования 4-окси-3-карбоксиазобензола и реакции. 2. Современная ...
... , причем преобладают кислые. Количество отдельных групп аминокислот в белках зависит от зоотехнических факторов, что и обуславливает их физико-химический состав. Молоко по содержанию незаменимых аминокислот является полноценным. Состав незаменимых АК в некоторых белках % Аминокислоты Идеальный белок Казеин Сывороточные белки молока Белок яйца Белок пшеницы Белок ...
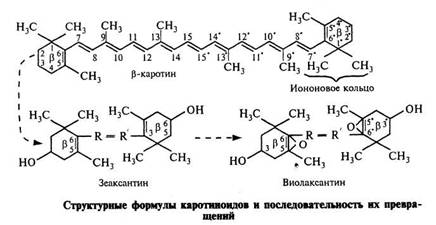
... витамина А - с 22 углеродными атомами и 6 конъюгированными двойными связями. Наличие этого гомолога названного витамином А2, отмечено в жирах пресноводных рыб. БИОЛОГИЧЕСКАЯ АКТИВНОСТЬ КАРОТИНА И КАРОТИНОИДОВ Биологическая активность каротина, т.е. степень способности его оказывать на организм такое же действие, как и витамин А, зависит эффективность процесса его усвоения и ...
... ксантофилл зеаксантин. В независимой от света реакции благодаря включению кислорода происходит обратное превращение зеаксантина в виолаксантин. Возможно, этот цикл служит для удаления излишков кислорода, образующихся при фотолизе воды. В верхушках побегов растений каротиноиды обеспечивают определение направления света и их ориентацию к световому потоку за счет фототропизма. 1.4 Карот


0 комментариев