Навигация
При увеличении давления химическое равновесие сместится в сторону образования водорода и кислорода
10. При увеличении давления химическое равновесие сместится в сторону образования водорода и кислорода.
Вариант 2 ЗадачиПервый уровень
1.
| Дано: CaCO3 |
1. Определяем массовую долю кальция
| |
| W(Ca) — ? | ||
| Ответ: | массовая доля кальция в кальций карбонате 40%. | |
2.
| Дано: N(H2)=24∙1023 молекул | 1. Определяем количество вещества водорода
| |
| ν(H2) — ? | ||
| Ответ: | количество вещества водорода – 4моль. | |
3.
| Дано: Д(Н2)=8 | 1. Определяем Mr(в-ва)
Mr(в-ва)=Д(Н2)∙Mr(H2) Mr(в-ва)=8∙2=16 | |
| Mr(в-ва) — ? | ||
| Ответ: | относительная молекулярная масса вещества – 16. | |
4 2Br – два атома брома
Br – один атом брома
3HBr – три молекулы сложного вещества, каждая из которых
Второй уровень5.
| Дано: ν(AgNO3)=3моль | 3моль хг AgNO3 + NaCl = AgCl + NaNO3 1моль 1моль 143,5г/моль 143,5г 1. Определяем массу аргентум хлорида 3моль:1моль=х:143,5г
| |
| m(AgCl) — ? | ||
| Ответ: | масса аргентум хлорида 430,5г. | |
6.
| Дано: S V(O2)=44,8л | 44,8л х S + O2 = SO2 1моль 1моль 22,4л/моль 22,4л/моль 22,4л 22,4л 1. Определяем объем сульфур (IV) оксида 44,8л:22,4л=х:22,4л
| |
| V(SO2) — ? | ||
| Ответ: | объем сульфур (IV) оксида – 44,8л. | |
7. С повышением температуры химическое равновесие сместится в сторону исходных веществ.
Третий уровень8. 2Pb+O2=2PbO
PbO+2HCl=PbCl2+H2O
PbCl2+2AgNO3=Pb(NO3)2+2AgCl↓
9. а) CuO+2HNO3=Cu(NO3)2+H2O
10.
| Дано: m(H2SO4)=4,9г NaOH | 4,9г хг 2NaOH + H2SO4 = Na2SO4 + 2H2O 1моль 1моль 98г/моль 142г/моль 98г 142г 1. Определяем массу натрий сульфата 4,9г:98г=х:142г
| |
| m(Na2SO4) — ? | ||
| Ответ: | в результате взаимодействия 4,9г сульфатной кислоты с натрий гидроксидом образуется 7,1г натрий сульфата. | |
Задачи
Первый уровень
1.
| Дано: CuSO4 | 1. Определяем массовую долю купрума
| |
| W(Cu) — ? | ||
| Ответ: | массовая доля купрума в купрум (II) сульфате – 40% | |
2.
| Дано: ν(О2)=3моль | 1. Определяем число молекул кислорода
N=3моль∙6∙1023молекул/моль=18∙1023молекул | |
| N(O2) — ? | ||
| Ответ: | в 3 моль кислорода содержится 18∙1023молекул. | |
3. N2 – одна молекула простого вещества азота каждая из которых состоит из двух атомов нитрогена.
5N – пять атомов нитрогена.
N2O – одна молекула сложного вещества, состоящая из двух атомов нитрогена и одного атома оксигена.
4HNO3 – четыре молекулы сложного вещества, каждая из которых состоит из одного атома гидрогена, одного атома нитрогена и трех атомов оксигена.
7H2 – семь молекул простого вещества водорода, каждая из которых состоит из двух атомов гидрогена.
4.
| Дано: ν(Н2)=2моль | 1. Определяем объем водорода
V(H2)=2моль∙22,4л/моль=44,8л | |
| V(H2) — ? | ||
| Ответ: | объем 2 моль водорода составляет 44,8л. | |
5.
| Дано: υ(NaOH)=4моль | 4моль хг 2NaOH + H2SO4 = Na2SO4 + 2H2O 2моль 1моль 98г/моль 98г 1. Определяем массу сульфатной кислоты 4моль:2моль=х:98г
| |
| m(H2SO4) — ? | ||
| Ответ: | на нейтрализацию 4 моль натрий гидроксида пойдет 196г сульфатной кислоты. | |
6.
| Дано: m(CuO)=16г | хг 16г 2Cu + O2 = 2CuO 2моль 2моль 64г/моль 80г/моль 64г 160г | |
| m(Cu) — ? | ||
| 1. Определяем массу меди х:64г=16г:160г
| ||
| Ответ: | для получения 16г купрум (II) оксида надо взять 6,4г меди. | |
7. С повышением температуры равновесие сместится в сторону исходных веществ.
Третий уровень8. 2Cu+O2=2CuO
CuO+2HCl=CuCl2+H2O
CuCl2+2NaOH=Cu(OH)2↓+2NaCl
9. а) Fe(OH)2+H2SO4=FeSO4+2H2O
10.
| Дано: Д(Н2)=16 | 1. Определяем относительную молекулярную массу кислорода.
2. Определяем формулу
| |
| Формула — ? | ||
| Ответ: | О2. | |
Первый уровень
1.
| Дано: Fe2O3 | 1. Определяем массовую долю феррума
| |
| W(Fe) — ? | ||
| Ответ: | массовая доля феррума в феррум (III) оксиде – 70%. | |
2.
| Дано: О2 | 1. Определяем относительную плотность кислорода по водороду
| |
| Д(Н2) — ? | ||
| Ответ: | относительная плотность кислорода по водороду – 16. | |
3. 7Н2О – семь молекул сложного вещества, каждая из которых состоит из двух атомов гидрогена и одного атома оксигена.
Н2 – молекула простого вещества, состоящая из двух атомов гидрогена.
5MgO – пять молекул сложного вещества, каждая из которых состоит из одного атома магния и одного атома оксигена.
4Cu – четыре атома купрума.
3О – три атома оксигена.
Похожие работы
... пособие по прикладной химии «Задачи по теоретическим основам химической технологии», составленное по материалам представленной работы. 3. Методика решения задач по теоретическим основам химической технологии Одна из главных задач химической науки и промышленности - получение необходимых человеку веществ (продуктов, материалов). Поэтому большинство учебных химических задач снизано с ...
... . Работа предназначена учителям химии, а также может быть полезна студентам педагогических вузов и колледжей. 2.2.ПОЯСНИТЕЛЬНАЯ ЗАПИСКА Необходимость разработки элективного курса для учащихся 10-х классов «Решение задач по органической химии повышенного уровня сложности» обусловлена несколькими причинами. В соответствии с базисным учебным планом полной средней школы на изучение химии за 2 ...
... Сюда можно отнести и методы, называемые физико-химическими. Физические методы основаны на физических явлениях и процессах, биологические – на явлении жизни. Основные требования к методам аналитической химии: правильность и хорошая воспроизводимости результатов, низкий предел обнаружения нужных компонентов, избирательность, экспрессность, простота анализа, возможность его автоматизации. Выбирая ...
... разовая) – 0,01%. 4 Содержание Введение......................................................................................................................4 Глава 1. Межпредметные связи в курсе школьного предмета химии на примере углерода и его соединений.......................................................................5 1.1 Использование межпредметных связей для формирования у учащихся ...


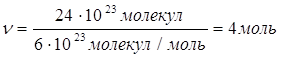
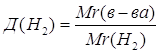
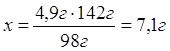
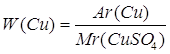
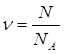 ;
; 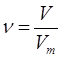 ;
; 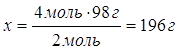
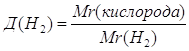
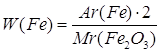
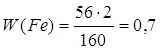 или 70%
или 70%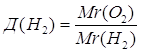
0 комментариев