РЕГУЛЯЦІЯ СЕКРЕЦІЇ ПІДШЛУНКОВОЇ ЗАЛОЗИ
Зовнішня, екзокринна, секреція підшлункової залози виконує важливу роль в конвеєрі травлення, маючи складні механізми регуляції. В процесі своєї екзокринної діяльності підшлункова залоза забезпечує часткову нейтралізацію кислого харчового шлункового вмісту, що потрапив до дванадцятипалої кишки, і переведення шлункового травлення в кишкове, реалізацію порожнинного і початкових етапів пристінкового кишкового травлення.
Перша функція забезпечується в основному секреторною діяльністю дуктальних і центроацинарних панкреатичних гландулоцитів, які виділяють електроліти і особливо гідрокарбонати у складі водних розчинів; друга – гландулацитами панкреатичних ацинусів, що синтезують і виділяють у складі своїх секретів гідролітичні ферменти, які деполімеризують травні білки, вуглеводи та ліпіди.
Кількість і спектр неорганічних та органічних компонентів панкреатичного секрету змінюються в широких межах в залежності від виду і складу їжі, властивостями шлункового і кишкового вмісту. Це забезпечується складними багаторівневими організованими механізмами регуляції секреторної діяльності підшлункової залози. Вона включає в себе мембраноконтактну інтеграцію клітин та їх ансамблів, ауто-, пара- і телегуморальну, центральну і периферичну, в тому числі місцеву, рефлекторну регуляцію і саморегуляцію. В ході цих впливів панкреоцити та їх ансамблі різних регіонів органа отримують сигнали термінової стимуляції, гальмування і модуляції діяльності та пролонгований трофічний, включаючи морфокінетичний, вплив на залозу.
Іннервація підшлункової залози, парасимпатичні і симпатичні секреторні ефекти. Підшлункова залоза отримує парасимпатичну іннервацію в основному у складі заднього вагусного стовпа. Еферентні волокна закінчуються в інтрапанкреатичних гангліях, які організовані за принципом ентеральної або метасимпатичної частини автономної нервової системи. Основним ефектом подразнення блукаючого нерва є посилення секреції ферментів, особливо протеїназ та ліпази, у значно меншій мірі – гідрокарбонатів.
Симпатична іннервація підшлункової залози проходить через черевний та брижовий ганглій. Постгангліонарні нейрони закінчуються на ацинарних клітинах, нейронах метасимпатичної системи. Більш виражена на ендокринних клітинах та кровоносних судинах.
Таблиця 1. Медіатори панкреатичного ганглію.
| Ацетилхолін: м1-холінорецептори Норадреналін: α- і β-адренорецептори Пептидергічні: вазоактивний інтестинальний пептид холецистокінін енкефалін субстанція Р гастринрелізінгпептид нейротензин нейропептид У пептид гистидин ізолейцин оксид азоту кальцитонін-ген-релізінгпептид галанін |
Адренаргічні впливи на екзосекреторну діяльність підшлункової залози – це впливи, в основному адаптаційно-трофічні, у більшій мірі поширюються на ацинарні клітини, ніж на дуктальні панкрецити, через α-адренорецептори реалізуються гальмівні впливи шляхом вазоконстрикції, через β-адренорецептори спільно з іншими стимуляторами посилюється секреція ферментів.
Місцева іннервація підшлункової залози дуже щільна. Практично кожен ацинус оточений елементами периацинарного сплетення. Морфологи підкреслюють спільність іннервації та васкуляризації ацинарних та острівцевих компонентів підшлункової залози. Причому у венозному відтоці екзокринні елементи слідують за ендокринними.
Еферентні нейрони відносяться до холінергічних, норадренаргічних та пептидергічних. В панкреатичних гангліях виявлений набір нейромедіаторів, в тому числі регуляторні пептиди. Інтраорганній системі підшлункової залози відводиться не тільки роль ланки екстрапанкреатичної іннервації, але і важливого інтраорганного компонента функціональної інтеграції ендо- та екзокринних елементів, дольок, сегментів та відділів підшлункової залози. Аферентація підшлункової залози здійснюється у складі блукаючого та черевного нервів.
ГОСТРИЙ ПАНКРЕАТИТ
З повною впевненістю можна стверджувати, що в гастроентерології не залишилось розділу, який би не був розглянутий сучасними уявленнями про медіатори запалення. Загальна концепція запалення залишається недоторканою. Але нові дані про речовини, що відіграють ключову роль у міжклітинних взаємодіях, дозволили не лише висвітлити багато з раніше невідомих етапів запального процесу, але і почати впровадження антагоністів цих субстанцій в терапевтичну практику.
Викладене в значній мірі можна віднести і до панкреатології. Багато ланок патогенезу гострого і хронічного пошкодження підшлункової залози залишається не до кінця з’ясованими, тому побудова чіткої схеми взаємодії медіаторів запалення поки що ускладнена. В той же час роль деяких із них вивчена в достатній мірі, що в першу чергу проливає світло на механізми розвитку системних запальних процесів, що в багатьох випадках визначають прогноз захворювання.
Роль медіаторів запалення в патогенезі гострого пошкодження підшлункової залози вивчається з початку 90-х років. Але лише в останні 2-3 роки стали прояснюватись складні взаємостосунки прозапальних цитокінів. Безпосередня деструкція тканини залози здійснюється активними формами кисню та оксидом азоту, але ці медіатори можна визначити як третинні, адже їх продукція знаходиться під контролем ряду прозапальних цитокінів, до яких відносяться інтерлейкін-1 (ІЛ-1), ІЛ-6, ІЛ-8, фактор некрозу пухлин (TNF-α), фактор активації тромбоцитів (PAF).
Розглядаючи взаємодії цитокінів, необхідно підкреслити два принципових положення:
1) медіатори запалення синтезуються одночасно в багатьох органах і тканинах;
2) медіатори запалення здійснюють не лише місцеві, але й системні ефекти. тобто річ йде про системний запальний синдром.
Загальна характеристика цитокінів, які приймають участь в патогенезі гострого панкреатиту:
- виробляються як в підшлунковій залозі, так і в інших органах (печінці, селезінці, легенях);
- панкреатична продукція передує непанкреатичній;
- продукція не залежить від етіології панкреатиту;
- накопичуються в панкреатичній тканині в токсичних концентраціях;
- секреція передує гістологічним змінам;
- тканинні рівні корелюють зі складністю протікання панкреатиту.
Останнє твердження найбільшою мірою стосується ІЛ-6, ІЛ-8. За даними багатьох дослідників, визначення сироваткового ІЛ-6 в перші 24 години після початку панкреатиту має більше значення для прогнозу летальності і тривалості перебування у стаціонарі, ніж широко застосовувані критерії Ranson та APACHE-II. Також встановлено, що при ранньому підвищенні концентрації ІЛ-8 в сироватці крові з високим ступенем достовірності можна прогнозувати мультиорганну дисфункцію.
Роль ІЛ-6 та ІЛ-8 в патогенезі системного запалення при гострому панкреатиті визначається їх біологічною функцією.
Іл-6 індукує продукцію білків гострої фази (С-реактивний білок, С3, фібриноген, α2-макроглобулін, церулоплазмін, α1-антитрипсин та ін.), найбільше значення серед яких мають такі прозапальні субстанції, як С-реактивний білок і С3-компонент комплемента, що здійснюють опсонізацію відмерлих клітин та активацію їх фагоцитозу.
ІЛ-8 виступає в ролі потужного хемоатрактанта поліморфно-ядерних лейкоцитів, стимулює продукцію активних форм кисню та NO, що безпосередньо вражають клітинні мембрани. Відповідно, підвищеня концентрації вказаних цитокінів відображає активність деструкції тканин. Крім того, встановлений кореляційний зв’язок між вираженістю лейкоцитозу і рівнем сироваткових ендотилінів 1 і 2.
Надлишкова продукція перерахованих медіаторів обумовлює порушення місцевої і системної мікроциркуляції, що призводить до мікротромбозів та дисемінованого внутрішньосудинного згортання.
Хоча прогностичне значення гіперпродукції ІЛ-6 та ІЛ-8 не підлягає сумніву, вони можуть бути віднесені до групи вторинних цитокінів, бо їх секреція контролюється первинними медіаторами запалення, до яких відносять ІЛ-1 та TNF-α. Ці медіатори виявлені як в сироватці, так і в асцитичній рідині хворих з важким протіканням панкреатиту. Але вони виявляються далеко не у всіх випадках, а їх рівні не корелюють з концентрацією інших цитокінів.
Продукція ІЛ-1 та TNF-α знаходиться під контролем ряду регуляторних механізмів, а виявлення їх у біологічних рідинах можливе лише протягом незначного періоду. Тривала їх присутність у системі циркуляції при гострому панкреатиті асоціюється з украй несприятливим прогнозом.
Дещо відокремлене місце в ланцюгу взаємодій медіаторів запалення займає PAF. Окрім індукції дегрануляції тромбоцитів і лейкоцитів він володіє вираженим вазодилятуючим ефектом, який значною мірою зумовлює дисфункцію місцевого та системного кровообігу, що призводить до колапсу та погіршує мультиорганну недостатність.
Активації цитокінового каскаду сприяє також підвищена проникливість кишкової стінки для ендотоксину грам-негативних бактерій та власне мікроорганізмів. Ендотоксин індукує вироблення зірчастими ретикулоендотеліоцитами печінки ІЛ-1, ІЛ-6, TNF-α, а проникнення бактерій у вогнище запалення призводить до інфікування некрозу і формування абсцесу підшлункової залози.
Основні ефекти медіаторів запалення при гострому панкреатиті ілюструються схемою 1.


|
|
|
|
|
|
|
|
|
 | |||||||||||||||||||||||||
 | |||||||||||||||||||||||||
 | |||||||||||||||||||||||||
Внутрішньопанкреатична активація ферментів призводить як до безпосередньої загибелі ацинарної клітини, так і до запуску механізмів місцевого запалення, що індукує внутрішньо- та позапанкреатичну продукцію первинних медіаторів (ІЛ-1, TNF-α), які зумовлюють розвиток системного запального синдрому. Первинні цитокіни запускають секрецію вторинних і третинних (які здійснюють безпосередню деструкцію тканин) медіаторів. У процесі системного запалення, в свою чергу, також виробляються прозапальні цитокіни, що індукують розвиток мультиорганної дисфункції.
Крім того, активація ферментів викликає підвищення проникливості стінки кишки, що обумовлює додаткове посилення продукції первинних цитокінів за рахунок ендотоксинемії та інфікування ділянок некрозу підшлункової залози, що призводить до абсцедування.
ХРОНІЧНИЙ ПАНКРЕАТИТ
Хронічному запаленню підшлункової залози не властивий настільки драматичний розвиток подій з системною активацією цитокінового каскаду, який спостерігається при гострому панкреатиті. У цій ситуації основна роль належить процесам фіброгенезу, що призводить у результаті до заміщення секретуючого епітелію залози сполучною тканиною. При цьому основного значення набувають вже не системні запальні ефекти, а місцеві процеси.
Деструкція панкреатичної тканини веде до зміни її антигенних властивостей, що служить тригерним механізмам запуску імунних процесів. Необхідно відзначити, що ці процеси не можна віднести до аутоімунних, бо мішенню імунної відповіді слугують первинно змінені в антигенному відношенні тканини. Доведена провідна роль порушенням клітинної цитотоксичності в імуноопосередкованому пошкодженні тканини підшлункової залози.
Проведені дослідження виявили зниження субпопуляції лімфоцитів CD8+ (Т-цитотоксичні) та CD56+ (NK-клітини) з підвищенням відношення CD4/CD8, що взагалі властиво хронічному запаленню. Більше того, не дивлячись на відсутність літературних даних про співвідношення субпопуляції CD4+-лімфоцитів (Т-хелперів) при хронічному панкреатиті, у хворих спостерігається підвищення сироваткового рівня секреторного IgА, що побічно вказує на переважання активності Т-хелперів 2-го типу. Варто враховувати, що Т-хелпери 2-го типу не тільки є стимуляторами гуморальної імунної відповіді, але і продукують ряд цитокінів з протизапальними властивостями, зокрема ІЛ-10.
Таким чином, проводячи аналогію з хронічним гепатитом, можна очікувати, що недостатня активність клітинної ланки імунного захисту слугує причиною хронізації запалення з переважанням процесів проліферації.
Фіброгенез в тканині підшлункової залози значною мірою зумовлений активацією зірчастих панкреатичних клітин. Ця субпопуляція резидентних тканинних макрофагів синтезує і секретує TGF-α і TGF-β1 (трансформуючі фактори росту), а також PDGF, які в свою чергу стимулюють синтез колагену і фібронектину міофібробластами.
Ланцюг подій в цьому разі представлений таким чином: гостре пошкодження чи атрофія ацинарної паренхіми призводить до підвищення продукції факторів росту зірчастими клітинами (в першу чергу TGF-β1, панкреатична експресія якого розглядається в якості ключової ланки фіброгенезу), що сприяє синтезу екстрацелюлярного матриксу (колагену, фібронектину) міофібробластами і обумовлює в результаті аномальну проліферацію і фіброзну трансформацію тканини залози.
Необхідно відзначити, що ця спрощена схема патогенезу є загальною для всіх форм хронічного панкреатиту не залежно від етіології. Але зміна акцентів в патогенезі пошкодження підшлункової залози при хронічному запаленні не повністю відкидає роль медіаторів гострого панкреатиту. Зокрема, при хронічному панкреатиті встановлена підвищена експресія ІЛ-8 у тканині залозі, що може вказувати на значення продуктів поліморфно-ядерних лейкоцитів у патогенезі визначених етапів хронічного запалення.
СПАДКОВИЙ ПАНКРЕАТИТ
Вперше спадковий панкреатит описали M.W.Comfort та A.G.Steinberg у 1952 році. Вони відзначили, що спадковий панкреатит має аутосомно-домінантний тип успадкування з неповною пенетрантністю. В подальшому було встановлено, що пенетрантність складає близько 80 %, тобто клінічні прояви виникають у 80 % осіб із зміненою спадковістю.
До цього часу описано близько 100 сімей і більше 600 пацієнтів, що страждають спадковим панкреатитом. Більшість із них проживають в країнах Північної Америки та Європи, але сім’ї зі спадковим панкреатитом описані на всіх континентах.
Цьому можна знайти два пояснення. З одного боку, в Північній Америці та Європі значно ліпше поставлена діагностика спадкового панкреатиту. З іншого – існують дані про расові особливості захворювання спадковим панкреатитом. Зокрема, дослідження американських вчених свідчать, що переважна більшість пацієнтів відносяться до білої раси, тоді як представники чорної раси та корінні жителі Америки хворіли спадковим панкреатитом дуже рідко.
Початок захворювання у 80 % хворих припадає на вік до 20 років. Спостерігається два піка виникнення спадкового панкреатиту: в 10-12 років та близько 17 років. Другий пік, імовірно, пов’язаний з початком вживання алкоголю. Тим не менше, початок спадкового панкреатиту коливається в дуже широких межах – від дитячого до старечого віку.
В більшості сімей спостерігається рівне співвідношення хворих чоловічої та жіночої статі. Найбільш частими клінічними ознаками хвороби є біль у животі (практично у 100 % пацієнтів), нудота і блювота, які зустрічаються приблизно у 80 % випадків нападів гострого спадкового панкреатиту.
Тривалість нападу складає близько 3-5 днів, інтервал між рецидивами – від кількох місяців до кількох років. Клінічна картина не відрізняється від гострого панкреатиту іншої етіології. Часто при спадковому панкреатиті в панкреатичних протоках знаходять камені (близько 50 % хворих). Крім того, при спадковому панкреатиті нерідко виявляють амінокислоти в сечі – аміноацидурію. Частіше всього виявляють цистин, лізин та аргінін.
Найбільш типовими ускладненнями спадкового панкреатиту є мальабсорбція, яка спостерігається в 10-15 % хворих (розвивається пізно, в середньому через 33 роки від початку хворобу), а також цукровий діабет, який зустрічається у 10-25 % пацієнтів. Набагато частіше зустрічаються порушення толерантності до вуглеводів (40 %), псевдокісти, які виникають значно частіше, ніж при панкреатиті іншої етіології (5-10 %), а також рак підшлункової залози.
Традиційно діагноз спадкового панкреатиту базувався перш за все на виключенні основних етіологічних факторів, зокрема, зловживання алкоголем та наявність жовчних каменів, а також на виключенні гіперліпідемії, в першу чергу І, ІІ і ІV типів, при яких панкреатит виникає в 15-40 % випадків, гіперпаратиреоїдизму, при якому у 10-15 % хворих спостерігається пошкодження підшлункової залози, дефіциту α1-антитрипсину або іншого спадкового захворювання підшлункової залози. Крім того, має значення ранній початок хвороби (в дитячому віці), обтяжений сімейний анамнез і наявність крупних округлих каменів у протоках підшлункової залози.
Те, що при цьому захворюванні дуже часто знаходять кальцифікати в протоках підшлункової залози та зміни самих протоків, визначив одну з найбільш ранніх теорій спадкового панкреатиту – теорію спадкової патології протоків. Більш пізньою теорією є думка про те, що причина спадкового панкреатиту полягає в дефіциті антиоксидантів. Зокрема, у хворих спадковим панкреатитом відзначене зниження рівня вітаміну Е, селену й активності глутатіонпероксидази і підвищення активності супероксиддисмутази, що може призводити до накопичення вільних радикалів кисню в клітинах. Найбільш пізнім підходом є думка про те, що спадковий панкреатит пов’язаний з генною мутацією одного з панкреатичних ферментів.
Кардинальна зміна у розумінні суті виникненні спадкового панкреатиту виникла у 1996 році, коли одночасно в США D.C.Whitcomb і Франції L.Le Bodic провели ретельне генетичне дослідження, яке було засноване на виявленні зчеплення між успадкуванням панкреатиту і тих чи інших маркерів відомих локусів хромосом або мікросателітів. Таким чином, була виявлена ділянка в довгому плечі 7-ї хромосоми, в якому мікросателіт успадковувався так само, як і сама хвороба. Це стало підставою для припущення того, що в цій ділянці хромосоми знаходиться ген, мутація якого приводить до виникнення спадкового панкреатиту.
Наступним кроком було встановлення нуклеотидної послідовності в цій ділянці 7-ї хромосоми. В цій зоні знаходиться ген регулятора трансмембранної проникливості, при мутації якого виникає муковісцидоз. В цій ділянці знаходиться ген, що кодує рецептори Т-клітин. Було висловлено припущення, що тут-таки знаходиться ще якийсь ген, зміна якого викликає появу спадкового панкреатиту, а потім встановлено, що експресія цього гену відбувається в підшлунковій залозі. З використанням великої бази даних Інституту людського геному було виявлено, що в цій зоні знаходиться ген, що кодує трипсиногени.
![]() Існує два основних різновиди трипсиногенів: катіонний та аніонний. Цей ген складається з п’яти окремих фрагментів – екзонів, які збираються разом лише в процесі експресії гену. Була виявлена мутація в 3-му екзоні гена катіонного трипсиногена. Суть мутації полягала в заміні гуанінової основи на аденін (CGC САС), що призводило до заміни амінокислоти аргініна на гістидин в молекулі трипсиногену і відповідно трипсину в положенні 117.
Існує два основних різновиди трипсиногенів: катіонний та аніонний. Цей ген складається з п’яти окремих фрагментів – екзонів, які збираються разом лише в процесі експресії гену. Була виявлена мутація в 3-му екзоні гена катіонного трипсиногена. Суть мутації полягала в заміні гуанінової основи на аденін (CGC САС), що призводило до заміни амінокислоти аргініна на гістидин в молекулі трипсиногену і відповідно трипсину в положенні 117.
Трипсин займає особливе положення у великому спектрі панкреатичних ферментів. Справа в тім, що трипсин людин володіє унікальною здатністю до аутоактивації та до активації практично всіх протеолітичних ферментів. На мал. 1 показана відома схема – каскад активації ферментів підшлункової залози. В цьому каскаді у якості ендопептидази, яка викликає відщеплення олігопептиду від трипсиногену і перетворення його в трипсин, що запускає цей каскад, може виступати або ентерокіназа щіткової облямівки тонкої кишки, як це проходить в нормі, або сам трипсин.
Мал 1. Каскад активації панкреатичних реакцій.
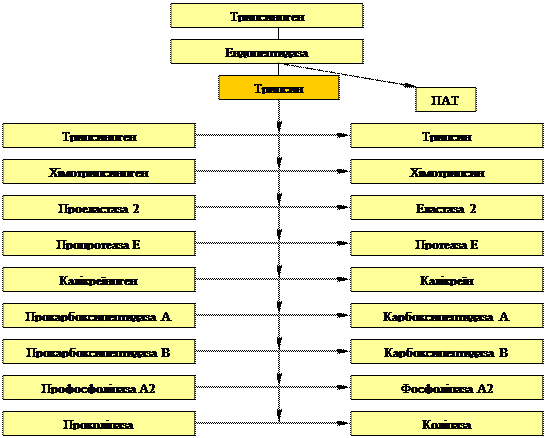 | ||||
| ||||
них ферментів в цитоплазму клітини або протоки підшлункової залози. В ацинарній клітині є низька концентрація іонів Са2+, який відіграє велику роль у стабілізації активного трипсину.
У підшлунковій залозі синтезується секреторний панкреатичний інгібітор трипсину. Дуже важливим захисним механізмом є здатність панкреатичних ферментів до аутолізу, самоперетравлення. Справа в тім, що багато ферментів підшлункової залози, перш за все трипсин, здатні розщеплювати самі себе, обмежуючи процес власної активації. Крім того, в печінці утворюються білки: α1-антитрипсин і β2-макроглобулін, які зв’язують активні панкреатичні ферменти, якщо вони потрапляють в кров або в перитонеальну рідину.
Трипсини є досить складною молекулою, що складається з двох субодиниць. Сполучаючись одна з одною, ці субодиниці утворюють центр розпізнавання амінокислот, який знаходиться у вузькій щілині між субодиницями. Центр розпізнає дві амінокислоти: аргінін та лізин в молекулі субстрату, і в цьому місці трипсин розщеплює поліпептидний ланцюг.
Дві субодиниці трипсину зв’язуються між собою за допомогою одного амінокислотного ланцюга, який знаходиться на протилежній від центру розпізнавання стороні молекули. Панкреатичний інгібітор трипсину проникає між двома субодиницями трипсину і блокує активний центр молекули. Встановлено, що на амінокислотному ланцюгу, який з’єднує субодиниці в положенні 117, знаходиться аргінін. При аутолізі саме ця амінокислота піддається розчепленню самим трипсином та іншими трипсиноподібними ферментами. В результаті відбувається роз’єднання субодиниць і руйнування активного центру.
Таким чином, можна визначити два основних механізми, що стримують активацію трипсину (мал. 4). Перший – інгібітор трипсину, що блокує активний центр, але він здатний нейтралізувати лише 20 % від всієї кількості трипсину, який може утворюватись в ацинарній клітині. Другий механізм – сам трипсин та інші протеолітичні ферменти, що здатні розщеплювати молекулу трипсину в положенні 117, що призводить до втрати активності цього ферменту.
При спадковому панкреатиті аргінін в положенні 117 замінюється на гістидин, тобто на амінокислоту, яку не здатен розпізнавати і, відповідно, розщепляти активний центр молекули трипсину. Це призводить до того, що трипсин та подібні до нього ферменти втрачають контроль над власною активацією. Вони вже не здатні пригнічувати трипсиноген, активний трипсин, і єдиною ланкою захисту залишається панкреатичний інгібітор трипсину.
Таким чином, якщо при спадковому панкреатиті одночасно відбувається активація великої кількості трипсину, кількості більшої, ніж здатен заблокувати панкреатичний інгібітор, це призводить до неконтрольованої активації трипсину. В свою чергу він активує інші ферменти панкреатичного каскаду, і це буде виявлятися у вигляді нападу гострого панкреатиту.
В останні роки вивчалася частота генетичних мутацій при захворюваннях підшлункової залози. Так, була досліджена велика група пацієнтів, яким проводилась ендоскопічна ретроградна холангіопанкреатографія. Із 102 хворих у 55 (54 %) встановлений діагноз так званого ідіопатичного панкреатиту, тобто етіологія хвороби не була з’ясована. У цих хворих досліджувались основні відомі генетичні мутації, як могли привести до пошкодження підшлункової залози: мутація регулятора трансмембранної проникливості, що зумовлювала виникнення муковісцидозу, мутація, що призводила до виникнення дефіциту α1-антитрипсину, і мутація спадкового панкреатиту із зміною молекули трипсиногену в положенні 117.
Встановлено, що у 15 (14,7 %) із 102 хворих були наявні генетичні мутації: у 2 виявлено мутацію спадкового панкреатиту, у 6 – гетерозиготна мутація гену муковісцидозу, у 1 – гомозиготна мутація, що призводила до дефіциту α1-антитрипсину, та у 6 – гетерозиготність по цій мутації.
Подальше вивчення сім’ї S., в якій D.C.Whitcomb виявив мутацію R117, показало, що 12,5 % хворих спадковим панкреатитом, в яких є усі класичні діагностичні його ознаки, чіткі ознаки самого панкреатиту та спадковий характер цієї хвороби, не мають мутації R117.
Дослідження показали, що існують і інші мутації, які призводять до виникнення цього захворювання. Так, французькі автори, які вивчали 14 родин, хворих на спадковий панкреатит, виявили мутацію R117 в 4 родинах, в той час як у 3 сім’ях була виявлена мутація в іншому, 2-му екзоні: мутація К18R (заміна лізину на аргінін в положенні 18) і N241. Сам D.C.Whitcomb виявив ще одну мутацію в положенні N211, за якої спостерігався більш пізній початок захворювання та м’яке протікання панкреатиту.
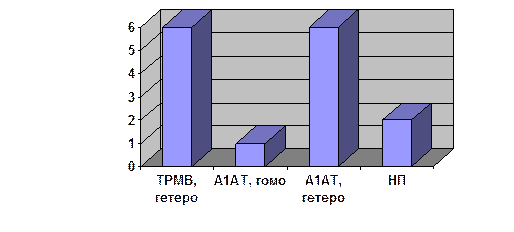
Мал 2. Частотність генетичних мутацій у хворих панкреатитом: генетичні мутації виявлені в 14,7 % хворих (за C.P. Choudari et al., 1998)
У чому ж полягає клінічне значення нових даних про патогенез спадкового панкреатиту? Якщо говорити про власне спадковий панкреатит, то отримані результати пояснюють аутосомно-домінантний характер успадкування цього захворювання. Тобто для виникнення спадкового панкреатиту досить, щоб хоча б половини молекули трипсину була стійкою до гідролізу. З іншого боку, ця теорії пояснює різну експресивність спадкового панкреатиту та інтермітуюче протікання цієї патології, тобто напад гострого панкреатиту виникатиме тоді, коли проходить внутрішньоклітинна активація великої кількості молекул трипсину.
Подальші дослідження сім’ї S. виявили цікаву закономірність. Згідно класичним діагностичним ознакам спадкового панкреатиту, діагноз встановлювався значною мірою на основі виключення інших причин панкреатиту — перш за все зловживання алкоголем і жовчнокам’яної хвороби. В цей же час при дослідженні цієї сім’ї (однієї з найбільш крупних) було виявлено, що серед хворих спадковим панкреатитом достовірно вищий відсоток осіб, які зловживали алкоголем, і достовірно вища частота проведення холецистектомій, ніж серед здорових членів цієї родини (мал. 3).

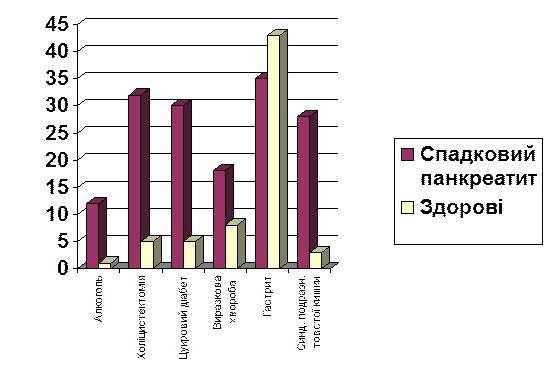
Мал 3. Порівняльна характеристика хворих спадковим панкреатитом і здорових в сім’ї S.
Це говорить про те, що зміна трипсину є лише тлом. Мутація призводить не до посилення активації трипсину, а лише порушує один із захисних механізмів ацинарних клітин. Для виникнення захворювання, появи клінічних симптомів необхідні преципітуючі фактори, які викликали б цю посилену активацію.
Таким чином, не можна вважати зловживання алкоголем і наявність холелітіаза факторами, що виключають спадковий панкреатит. Для верифікації діагноза необхідне виявлення катіонного трипсиногену за допомогою полімеразної ланцюгової реакції.
Генна теорія якоюсь мірою пояснює патогенез гострого панкреатиту в цілому. Зокрема, вона відкриває новий захисний механізм: аутоліз молекули трипсину. Генна теорія показує, що раннім пусковим механізмом гострого панкреатиту може бути внутрішньоклітинна активація трипсину. Це повертає нас до теорії самоперетравлювання підшлункової залози, яку висунув Chiari більше 100 років тому, що показує основну роль трипсину в пошкодженні підшлункової залози. Згідно теорії, гострий панкреатит принаймні в частині випадків може починатися всередині ацинарної клітини.
Спадковий панкреатит при тривалому лікуванні (більше 10-15 років) призводить до виникнення хронічного панкреатиту. Морфологічні дослідження тканини підшлункової залози показали, що гістологічна картина при цьому захворювання нічим не відрізняється від гістологічної картини хронічного алкогольного панкреатиту. Це дозволяє припустити, що рецидивуючий гострий панкреатит може призводити до виникнення хронічного панкреатиту.
Запалення підшлункової залози може протікати субклінічно, якщо надлишкова активація трипсину проходить одночасно лише в невеликій кількості ацинарних клітин. Це може призвести до того, що не виявляються фізикальні, лабораторні чи інструментальні ознаки запалення підшлункової залози. Зміни протоків, які спостерігаються при хронічному спадковому панкреатиті, можуть бути проявами цього захворювання, а не причиною його.
Відомо, що спадковий панкреатит різко підвищує ризик розвитку раку підшлункової залози. При дослідженні хворих спадковим панкреатитом з 21 родини рак підшлункової залози був виявлений у 15 %. У 9 % хворих виявлені пухлини черевної порожнини позапанкреатичної локалізації. Встановлено, що у хворих спадковим панкреатитом до 70 років ризик виникнення раку складає 40 %.
У той же час при генетичних дослідженнях хворих спадковим панкреатитом змін онкогенів чи генів-супресорів пухлинного росту не виявлено. Це дозволяє припустити, що причина вищої частоти раку при спадковому панкреатиті полягає у вищому рівні активності запального процесу в підшлунковій залозі при спадковому панкреатиті й більшою тривалістю запального процесу. Це зайвий доказ на користь того, що хронічне запалення є фактором, що сприяє розвитку раку підшлункової залози.
СПИСОК ВИКОРИСТАНОЇ ЛІТЕРАТУРИ
1. Острый панкреатит // Международный медицинский журнал. – Т.5. - № 2. – 1999. – С. 87-91.
2. Иннервация поджелудочной железы // Российский журнал гастроэнтерологии, гепатологии, колопроктологии. – Т.6. - № 1. – 1996. – С. 35-39.
3. Коротько Г.Ф. Регуляция секреции поджелудочной железы // Российский журнал гастроэнтерологии, гепатологии, колопроктологии. – Т.9. - № 4. – 1996. – С. 6-9.
4. Буеверов А.О. Медиаторы воспаления и поражение поджелудочной железы // Российский журнал гастроэнтерологии, гепатологии, колопроктологии. – Т.9. - № 4. – 1996. – С. 15-18.
5. Охлобыстин А.В. Новые данные о патогенезе наследственного панкреатита // Российский журнал гастроэнтерологии, гепатологии, колопроктологии. – Т.9. - № 4. – 1996. – С. 18-23.
6. Учебно-методическая разработка для студентов VI курса по теме: «Острый панкреатит» / Сост. Почечуев Е.А. и др. – М.: Изд-во МГМУ, 1995.
7. Розин Д.Г. Ферментовыделительная деятельность поджелудочной железы. – Ташкент: Медицина, 1981. – С. 164.
Похожие работы
... развивается фиброз и обтурация просвета протоков, а также появляются очаги обызвествления в паренхиме поджелудочной железы и формируются камни в её протоках (кальцифицирующий хронический панкреатит). Основные факторы патогенеза хронического алкогольного панкреатита: Ø Токсико-метаболическое и повреждающее действие алкоголя на поджелудочную железу. Даже после разового приёма большого ...
... зростає до 10—15×109/л. Підвищення його вище 25×109/л є однією з ознак некрозу підшлункової залози. Одночасно відмічається лімфопенія та підвищення ШОЕ. Але не у всіх хворих на гострий панкреатит спостерігається високий лейкоцитоз. Гіпокальціємія проявляється з 2—3-го дня захворювання, максимальне зниження кальцію виявляється на 6-й день, а на 12—13-ту добу його вміст доходить до норми ...
... самостійно вивчено критерії важкості СПОН, їх оцінку та вплив на системи, підготувлено статтю до друку). АНОТАЦІЯ Коробко Л.Р. Вибір лікувальної тактики та об’єму оперативного втручання у хворих на гострий панкреатит із супровідною серцево-судинною патологією. – Рукопис. Дисертація на здобуття наукового ступеня кандидата медичних наук за спеціальністю – 14.01.03 – хірургія. Вінницький ...
... так наз. сосочковый признак, который объясняется наличием отека фатерова соска. Большое значение имеет томографическое исследование. В неясных случаях приходится делать холангиографию и пиелографию. Хронический панкреатит приходится дифференцировать со многими заболеваниями органов брюшной полости - желчного пузыря (холецистит) и желчных путей (дискинезия желчных путей), язвенной болезнью с ...
0 комментариев