Белки (протеины), класс сложных азотсодержащих соединений, наиболее характерных и важных (наряду с нуклеиновыми кислотами) компонентов живого вещества. Белки выполняют многочисленные и разнообразные функции. Большинство белков – ферменты, катализирующие химические реакции. Многие гормоны, регулирующие физиологические процессы, тоже являются белками. Такие структурные белки, как коллаген и кератин, служат главными компонентами костной ткани, волос и ногтей. Сократительные белки мышц обладают способностью изменять свою длину, используя химическую энергию для выполнения механической работы. К белкам относятся антитела, которые связывают и нейтрализуют токсичные вещества. Некоторые белки, способные реагировать на внешние воздействия (свет, запах), служат в органах чувств рецепторами, воспринимающими раздражение. Многие белки, расположенные внутри клетки и на клеточной мембране, выполняют регуляторные функции.
В первой половине 19 в. многие химики, и среди них в первую очередь Ю.фон Либих, постепенно пришли к выводу, что белки представляют собой особый класс азотистых соединений. Название «протеины» (от греч. protos – первый) предложил в 1840 голландский химик Г.Мульдер.
Физические свойства
Белки в твердом состоянии белого цвета, а в растворе бесцветны, если только они не несут какой-нибудь хромофорной (окрашенной) группы, как, например, гемоглобин. Растворимость в воде у разных белков сильно варьирует. Она изменяется также в зависимости от рН и от концентрации солей в растворе, так что можно подобрать условия, при которых один какой-нибудь белок будет избирательно осаждаться в присутствии других белков. Этот метод «высаливания» широко используется для выделения и очистки белков. Очищенный белок часто выпадает в осадок из раствора в виде кристаллов.
В сравнении с другими соединениями молекулярная масса белков очень велика – от нескольких тысяч до многих миллионов дальтон. Поэтому при ультрацентрифугировании белки осаждаются, и притом с разной скоростью. Благодаря присутствию в молекулах белков положительно и отрицательно заряженных групп они движутся с разной скоростью и в электрическом поле. На этом основан электрофорез – метод, применяемый для выделения индивидуальных белков из сложных смесей. Очистку белков проводят и методом хроматографии.
Химические свойства
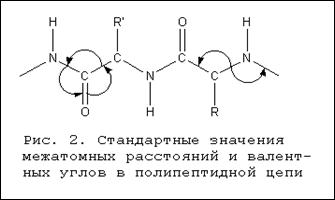
Строение. Белки – это полимеры, т.е. молекулы, построенные, как цепи, из повторяющихся мономерных звеньев, или субъединиц, роль которых играют у них -аминокислоты. Общая формула аминокислот
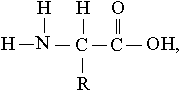
где R – атом водорода или какая-нибудь органическая группа.
Белковая молекула (полипептидная цепь) может состоять всего лишь из относительно небольшого числа аминокислот или из нескольких тысяч мономерных звеньев. Соединение аминокислот в цепи возможно потому, что у каждой из них имеются две разные химические группы: обладающая основными свойствами аминогруппа, NH2, и кислотная карбоксильная группа, СООН. Обе эти группы присоединены к -атому углерода. Карбоксильная группа одной аминокислоты может образовать амидную (пептидную) связь с аминогруппой другой аминокислоты:
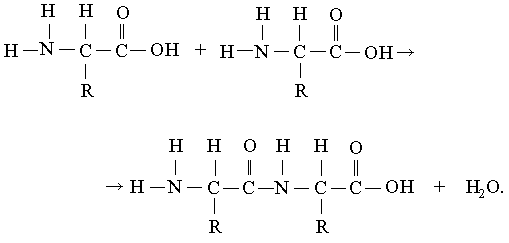
После того как две аминокислоты таким образом соединились, цепь может наращиваться путем добавления ко второй аминокислоте третьей и т.д. Как видно из приведенного выше уравнения, при образовании пептидной связи выделяется молекула воды. В присутствии кислот, щелочей или протеолитических ферментов реакция идет в обратном направлении: полипептидная цепь расщепляется на аминокислоты с присоединением воды. Такая реакция называется гидролизом. Гидролиз протекает спонтанно, а для соединения аминокислот в полипептидную цепь требуется энергия.
Карбоксильная группа и амидная группа (или сходная с ней имидная – в случае аминокислоты пролина) имеются у всех аминокислот, различия же между аминокислотами определяются природой той группы, или «боковой цепи», которая обозначена выше буквой R. Роль боковой цепи может играть и один атом водорода, как у аминокислоты глицина, и какая-нибудь объемистая группировка, как у гистидина и триптофана. Некоторые боковые цепи в химическом смысле инертны, тогда как другие обладают заметной реакционной способностью.
Синтезировать можно многие тысячи различных аминокислот, и множество различных аминокислот встречается в природе, но для синтеза белков используется только 20 видов аминокислот: аланин, аргинин, аспарагин, аспарагиновая кислота, валин, гистидин, глицин, глутамин, глутаминовая кислота, изолейцин, лейцин, лизин, метионин, пролин, серин, тирозин, треонин, триптофан, фенилаланин и цистеин (в белках цистеин может присутствовать в виде димера – цистина). Правда, в некоторых белках присутствуют и другие аминокислоты, помимо регулярно встречающихся двадцати, но они образуются в результате модификации какой-нибудь из двадцати перечисленных уже после того, как она включилась в белок.
Оптическая активность. У всех аминокислот, за исключением глицина, к -атому углерода присоединены четыре разные группы. С точки зрения геометрии, четыре разные группы могут быть присоединены двумя способами, и соответственно есть две возможные конфигурации, или два изомера, относящиеся друг к другу, как предмет к своему зеркальному отражению, т.е. как левая рука к правой. Одну конфигурацию называют левой, или левовращающей (L), а другую – правой, или правовращающей (D), поскольку два таких изомера различаются направлением вращения плоскости поляризованного света. В белках встречаются только L-аминокислоты (исключение составляет глицин; он может быть представлен лишь одной формой, поскольку у него две из четырех групп одинаковы), и все они обладают оптической активностью (поскольку имеется только один изомер). D-аминокислоты в природе редки; они встречаются в некоторых антибиотиках и клеточной оболочке бактерий.
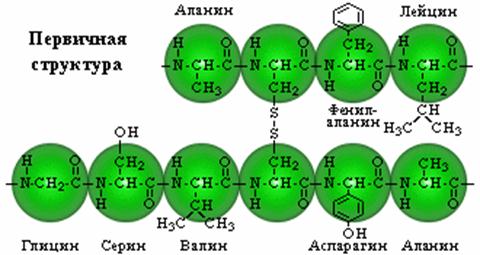
Последовательность аминокислот. Аминокислоты в полипептидной цепи располагаются не случайным образом, а в определенном фиксированном порядке, и именно этот порядок определяет функции и свойства белка. Варьируя порядок расположения 20 видов аминокислот, можно получить огромное число разных белков, точно так же, как из букв алфавита можно составить множество разных текстов.
В прошлом на определение аминокислотной последовательности какого-нибудь белка уходило нередко несколько лет. Прямое определение и теперь достаточно трудоемкое дело, хотя созданы приборы, позволяющие вести его автоматически. Обычно проще бывает определить нуклеотидную последовательность соответствующего гена и вывести из нее аминокислотную последовательность белка. К настоящему времени уже определены аминокислотные последовательности многих сотен белков. Функции расшифрованных белков, как правило, известны, и это помогает представить себе возможные функции сходных белков, образующихся, например, при злокачественных новообразованиях.
Сложные белки. Белки, состоящие из одних только аминокислот, называют простыми. Часто, однако, к полипептидной цепи бывают присоединены атом металла или какое-нибудь химическое соединение, не являющееся аминокислотой. Такие белки называются сложными. Примером может служить гемоглобин: он содержит железопорфирин, который определяет его красный цвет и позволяет ему играть роль переносчика кислорода.
В названиях большинства сложных белков содержится указание на природу присоединенных групп: в гликопротеинах присутствуют сахара, в липопротеинах – жиры. Если от присоединенной группы зависит каталитическая активность фермента, то ее называют простетической группой. Нередко какой-нибудь витамин играет роль простетической группы или входит в ее состав. Витамин А, например, присоединенный к одному из белков сетчатки, определяет ее чувствительность к свету.
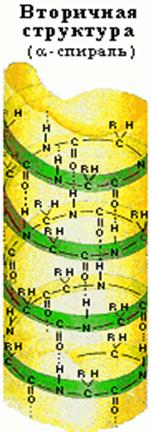
Третичная структура. Важна не столько сама аминокислотная последовательность белка (первичная структура), сколько способ ее укладки в пространстве. По всей длине полипептидной цепи ионы водорода образуют регулярные водородные связи, которые придают ей форму спирали либо слоя (вторичная структура). Из комбинации таких спиралей и слоев возникает компактная форма следующего порядка – третичная структура белка. Вокруг связей, удерживающих мономерные звенья цепи, возможны повороты на небольшие углы. Поэтому с чисто геометрической точки зрения число возможных конфигураций для любой полипептидной цепи бесконечно велико. В действительности же каждый белок существует в норме только в одной конфигурации, определяемой его аминокислотной последовательностью. Структура эта не жесткая, она как бы «дышит» – колеблется вокруг некой средней конфигурации. Цепь складывается в такую конфигурацию, при которой свободная энергия (способность производить работу) минимальна, подобно тому как отпущенная пружина сжимается лишь до состояния, соответствующего минимуму свободной энергии. Нередко одна часть цепи бывает жестко сцеплена с другой дисульфидными (–S–S–) связями между двумя остатками цистеина. Отчасти именно поэтому цистеин среди аминокислот играет особо важную роль.
Сложность строения белков столь велика, что пока еще невозможно вычислить третичную структуру белка, если даже известна его аминокислотная последовательность. Но если удается получить кристаллы белка, то его третичную структуру можно определить по дифракции рентгеновских лучей.
У структурных, сократительных и некоторых других белков цепи вытянуты и несколько лежащих рядом слегка свернутых цепей образуют фибриллы; фибриллы, в свою очередь, складываются в более крупные образования – волокна. Однако большинство белков в растворе имеет глобулярную форму: цепи свернуты в глобуле, как пряжа в клубке. Свободная энергия при такой конфигурации минимальна, поскольку гидрофобные («отталкивающие воду») аминокислоты скрыты внутри глобулы, а гидрофильные («притягивающие воду») находятся на ее поверхности.
Многие белки – это комплексы из нескольких полипептидных цепей. Такое строение называется четвертичной структурой белка. Молекула гемоглобина, например, состоит из четырех субъединиц, каждая из которых представляет собой глобулярный белок.
Структурные белки благодаря своей линейной конфигурации образуют волокна, у которых предел прочности на разрыв очень высок, глобулярная же конфигурация позволяет белкам вступать в специфические взаимодействия с другими соединениями. На поверхности глобулы при правильной укладке цепей возникают определенной формы полости, в которых размещены реакционноспособные химические группы. Если данный белок – фермент, то другая, обычно меньшая, молекула какого-то вещества входит в такую полость подобно тому, как ключ входит в замок; при этом меняется конфигурация электронного облака молекулы под влиянием находящихся в полости химических групп, и это вынуждает ее определенным образом реагировать. Таким способом фермент катализирует реакцию. В молекулах антител тоже имеются полости, в которых различные чужеродные вещества связываются и тем самым обезвреживаются. Модель «ключа и замка», объясняющая взаимодействие белков с другими соединениями, позволяет понять специфичность ферментов и антител, т.е. их способность реагировать только с определенными соединениями.
Белки у разных видов организмов. Белки, выполняющие одну и ту же функцию у разных видов растений и животных и потому носящие одно и то же название, имеют и сходную конфигурацию. Они, однако, несколько различаются по своей аминокислотной последовательности. По мере того как виды дивергируют от общего предка, некоторые аминокислоты в определенных положениях замещаются в результате мутаций другими. Вредные мутации, являющиеся причиной наследственных болезней, выбраковываются естественным отбором, но полезные или по крайней мере нейтральные могут сохраняться. Чем ближе друг к другу два каких-нибудь биологических вида, тем меньше различий обнаруживается в их белках.
Некоторые белки меняются относительно быстро, другие весьма консервативны. К последним принадлежит, например, цитохром с – дыхательный фермент, имеющийся у большинства живых организмов. У человека и шимпанзе его аминокислотные последовательности идентичны, а в цитохроме с пшеницы иными оказались лишь 38% аминокислот. Даже сравнивая человека и бактерии, сходство цитохромов с (различия затрагивают здесь 65% аминокислот) все еще можно заметить, хотя общий предок бактерии и человека жил на Земле около двух миллиардов лет назад. В наше время сравнение аминокислотных последовательностей часто используют для построения филогенетического (генеалогического) древа, отражающего эволюционные связи между разными организмами.
Денатурация. Синтезированная молекула белка, складываясь, приобретает свойственную ей конфигурацию. Эта конфигурация, однако, может разрушиться при нагревании, при изменении рН, под действием органических растворителей и даже при простом взбалтывании раствора до появления на его поверхности пузырьков. Измененный таким образом белок называют денатурированным; он утрачивает свою биологическую активность и обычно становится нерастворимым. Хорошо знакомые всем примеры денатурированного белка – вареные яйца или взбитые сливки. Небольшие белки, содержащие всего лишь около сотни аминокислот, способны ренатурировать, т.е. вновь приобретать исходную конфигурацию. Но большинство белков превращается при этом просто в массу спутанных полипептидных цепей и прежнюю конфигурацию не восстанавливает.
Одна из главных трудностей при выделении активных белков связана с их крайней чувствительностью к денатурации. Полезное применение это свойство белков находит при консервировании пищевых продуктов: высокая температура необратимо денатурирует ферменты микроорганизмов, и микроорганизмы погибают.
Синтез белков
Для синтеза белка живой организм должен располагать системой ферментов, способных присоединять одну аминокислоту к другой. Необходим также источник информации, которая бы определяла, какие именно аминокислоты следует соединять. Поскольку в организме имеются тысячи видов белков и каждый из них состоит в среднем из нескольких сотен аминокислот, необходимая информация должна быть поистине огромной. Хранится она (подобно тому, как хранится запись на магнитной ленте) в молекулах нуклеиновых кислот, из которых состоят гены.
Активация ферментов. Синтезированная из аминокислот полипептидная цепь – это далеко не всегда белок в его окончательной форме. Многие ферменты синтезируются сначала в виде неактивных предшественников и переходят в активную форму лишь после того, как другой фермент удалит на одном из концов цепи несколько аминокислот. В такой неактивной форме синтезируются некоторые из пищеварительных ферментов, например трипсин; эти ферменты активируются в пищеварительном тракте в результате удаления концевого фрагмента цепи. Гормон инсулин, молекула которого в активной форме состоит из двух коротких цепей, синтезируется в виде одной цепи, т.н. проинсулина. Затем средняя часть этой цепи удаляется, а оставшиеся фрагменты связываются друг с другом, образуя активную молекулу гормона. Сложные белки образуются лишь после того, как к белку будет присоединена определенная химическая группа, а для этого присоединения часто тоже требуется фермент.
Метаболический кругооборот. После скармливания животному аминокислот, меченных радиоактивными изотопами углерода, азота или водорода, метка быстро включается в его белки. Если меченые аминокислоты перестают поступать в организм, то количество метки в белках начинает снижаться. Эти эксперименты показывают, что образовавшиеся белки не сохраняются в организме до конца жизни. Все они, за немногими исключениями, находятся в динамичном состоянии, постоянно распадаются до аминокислот, а затем вновь синтезируются.
Некоторые белки распадаются, когда гибнут и разрушаются клетки. Это постоянно происходит, например, с эритроцитами и клетками эпителия, выстилающего внутреннюю поверхность кишечника. Кроме того, распад и ресинтез белков протекают и в живых клетках. Как ни странно, о распаде белков известно меньше, чем об их синтезе. Ясно, однако, что в распаде участвуют протеолитические ферменты, сходные с теми, которые расщепляют белки до аминокислот в пищеварительном тракте.
Период полураспада у разных белков различен – от нескольких часов до многих месяцев. Единственное исключение – молекулы коллагена. Однажды образовавшись, они остаются стабильными, не обновляются и не замещаются. Со временем, однако, меняются некоторые их свойства, в частности эластичность, а поскольку они не обновляются, следствием этого оказываются определенные возрастные изменения, например появление морщин на коже.
Синтетические белки. Химики давно уже научились полимеризовать аминокислоты, но аминокислоты соединяются при этом неупорядоченно, так что продукты такой полимеризации мало похожи на природные. Правда, имеется возможность соединять аминокислоты в заданном порядке, что позволяет получать некоторые биологически активные белки, в частности инсулин. Процесс достаточно сложен, и таким способом удается получать лишь те белки, в молекулах которых содержится около сотни аминокислот. Предпочтительнее вместо этого синтезировать или выделить нуклеотидную последовательность гена, соответствующую желаемой аминокислотной последовательности, а затем ввести этот ген в бактерию, которая и будет вырабатывать путем репликации большое количество нужного продукта. У этого метода, впрочем, тоже есть свои недостатки.
Белки и питание
Когда белки в организме распадаются до аминокислот, эти аминокислоты могут быть снова использованы для синтеза белков. В то же время и сами аминокислоты подвержены распаду, так что они реутилизируются не полностью. Ясно также, что в период роста, при беременности и заживлении ран синтез белков должен превышать распад. Некоторые же белки организм непрерывно теряет; это белки волос, ногтей и поверхностного слоя кожи. Поэтому для синтеза белков каждый организм должен получать аминокислоты с пищей.
Источники аминокислот. Зеленые растения синтезируют из СО2, воды и аммиака или нитратов все 20 аминокислот, встречающихся в белках. Многие бактерии тоже способны синтезировать аминокислоты при наличии сахара (или какого-нибудь его эквивалента) и фиксированного азота, но и сахар, в конечном счете, поставляется зелеными растениями. У животных способность к синтезу аминокислот ограниченна; они получают аминокислоты, поедая зеленые растения или других животных. В пищеварительном тракте поглощенные белки расщепляются до аминокислот, последние всасываются, и уже из них строятся белки, характерные для данного организма. Ни один поглощенный белок не включается в структуры тела как таковой. Единственное исключение заключается в том, что у многих млекопитающих часть материнских антител может в интактном виде попасть через плаценту в кровоток плода, а через материнское молоко (особенно у жвачных) быть передано новорожденному сразу же после его появления на свет.
Потребность в белках. Ясно, что для поддержания жизни организм должен получать с пищей некоторое количество белков. Однако размеры этой потребности зависят от ряда факторов. Организму необходима пища и как источник энергии (калорий), и как материал для построения его структур. На первом месте стоит потребность в энергии. Это значит, что, когда углеводов и жиров в рационе мало, пищевые белки используются не для синтеза собственных белков, а в качестве источника калорий. При длительном голодании даже собственные белки расходуются на удовлетворение энергетических нужд. Если же углеводов в рационе достаточно, то потребление белков может быть снижено.
Азотистый баланс. В среднем ок. 16% всей массы белка составляет азот. Когда входившие в состав белков аминокислоты расщепляются, содержавшийся в них азот выводится из организма с мочой и (в меньшей мере) с калом в виде различных азотистых соединений. Удобно поэтому для оценки качества белкового питания использовать такой показатель, как азотистый баланс, т.е. разность (в граммах) между количеством азота, поступившего в организм, и количеством выведенного азота за сутки. При нормальном питании у взрослого эти количества равны. У растущего организма количество выведенного азота меньше количества поступившего, т.е. баланс положителен. При нехватке белков в рационе баланс отрицателен. Если калорий в рационе достаточно, но белки в нем полностью отсутствуют, организм сберегает белки. Белковый обмен при этом замедляется, и повторная утилизация аминокислот в синтезе белка идет с максимально возможной эффективностью. Однако потери неизбежны, и азотистые соединения все же выводятся с мочой и частично с калом. Количество азота, выведенного из организма за сутки при белковом голодании, может служить мерой суточной нехватки белка. Естественно предположить, что, введя в рацион количество белка, эквивалентное этому дефициту, можно восстановить азотистый баланс. Однако это не так. Получив такое количество белка, организм начинает использовать аминокислоты менее эффективно, так что для восстановления азотистого баланса требуется некоторое дополнительное количество белка.
Если количество белка в рационе превышает необходимое для поддержания азотистого баланса, то вреда от этого, по-видимому, нет. Избыток аминокислот просто используется как источник энергии. В качестве особенно яркого примера можно сослаться на эскимосов, которые потребляют мало углеводов и примерно в десять раз больше белка, чем требуется для поддержания азотистого баланса. В большинстве случаев, однако, использование белка в качестве источника энергии невыгодно, поскольку из определенного количества углеводов можно получить намного больше калорий, чем из такого же количества белка. В бедных странах население получает необходимые калории за счет углеводов и потребляет минимальное количество белка.
Если необходимое число калорий организм получает в форме небелковых продуктов, то минимальное количество белка, обеспечивающее поддержание азотистого баланса, составляет для взрослого человека ок. 30 г в день. Примерно столько белка содержится в четырех ломтиках хлеба или 0,5 л молока. Оптимальным считают обычно несколько большее количество; рекомендуется от 50 до 70 г.
Незаменимые аминокислоты. До сих пор белок рассматривался как нечто целое. Между тем для того, чтобы мог идти синтез белка, в организме должны присутствовать все необходимые аминокислоты. Некоторые из аминокислот организм животного сам способен синтезировать. Их называют заменимыми, поскольку они не обязательно должны присутствовать в рационе, – важно лишь, чтобы в целом поступление белка как источника азота было достаточным; тогда при нехватке заменимых аминокислот организм может синтезировать их за счет тех, что присутствуют в избытке. Остальные, «незаменимые», аминокислоты не могут быть синтезированы и должны поступать в организм с пищей. Для человека незаменимыми являются валин, лейцин, изолейцин, треонин, метионин, фенилаланин, триптофан, гистидин, лизин и аргинин. (Хотя аргинин и может синтезироваться в организме, его относят к незаменимым аминокислотам, поскольку у новорожденных и растущих детей он образуется в недостаточном количестве. С другой стороны, для человека зрелого возраста поступление некоторых из этих аминокислот с пищей может стать необязательным.)
Этот список незаменимых аминокислот приблизительно одинаков также и у других позвоночных и даже у насекомых. Питательную ценность белков обычно определяют, скармливая их растущим крысам и следя за прибавкой веса животных.
Питательная ценность белков. Питательную ценность белка определяют по той незаменимой аминокислоте, которой более всего не хватает. Проиллюстрируем это на примере. В белках нашего тела содержится в среднем ок. 2% триптофана (по весу). Допустим, что в рацион входит 10 г белка, содержащего 1% триптофана, и что других незаменимых аминокислот в нем достаточно. В нашем случае 10 г этого неполноценного белка по сути эквивалентны 5 г полноценного; остальные 5 г могут послужить только источником энергии. Отметим, что, поскольку аминокислоты в организме практически не запасаются, а для того чтобы мог идти синтез белка, должны одновременно присутствовать все аминокислоты, эффект от поступления незаменимых аминокислот можно обнаружить лишь в том случае, если все они поступят в организм одновременно.
Усредненный состав большей части животных белков близок к усредненному составу белков человеческого тела, так что аминокислотная недостаточность нам вряд ли грозит, если наш рацион богат такими продуктами, как мясо, яйца, молоко и сыр. Однако есть белки, например желатин (продукт денатурации коллагена), которые содержат очень мало незаменимых аминокислот. Растительные белки, хотя они в этом смысле и лучше желатина, тоже бедны незаменимыми аминокислотами; особенно мало в них лизина и триптофана. Тем не менее и чисто вегетарианскую диету вовсе нельзя считать вредной, если только при этом потребляется несколько большее количество растительных белков, достаточное для того, чтобы обеспечить организм незаменимыми аминокислотами. Больше всего белка содержится у растений в семенах, особенно в семенах пшеницы и различных бобовых культур. Богаты белком также и молодые побеги, например у спаржи.
Синтетические белки в рационе. Добавляя небольшие количества синтетических незаменимых аминокислот или богатых ими белков к неполноценным белкам, например к белкам кукурузы, можно значительно повысить питательную ценность последних, т.е. тем самым как бы увеличить количество потребляемого белка. Другая возможность состоит в выращивании бактерий или дрожжей на углеводородах нефти с добавлением нитратов или аммиака в качестве источника азота. Полученный таким путем микробный белок может служить кормом для домашней птицы или скота, а может и непосредственно потребляться человеком. Третий, широко применяющийся, метод использует особенности физиологии жвачных животных. У жвачных в начальном отделе желудка, т.н. рубце, обитают особые формы бактерий и простейших, которые превращают неполноценные растительные белки в более полноценные микробные белки, а эти, в свою очередь, – после переваривания и всасывания – превращаются в животные белки. К корму скота можно добавить мочевину – дешевое синтетическое азотсодержащее соединение. Обитающие в рубце микроорганизмы используют азот мочевины для превращения углеводов (которых в корме значительно больше) в белок. Около трети всего азота в корме скота может поступать в виде мочевины, что по сути и означает в определенной мере химический синтез белка. В США этот метод играет важную роль как один из способов получения белка.
Список литературыМарри Р., Греннер Д., Мейес П., Родуэлл В. Биохимия человека, тт. 1–2. М., 1993
Албертс Б., Брей Д., Льюс Дж. и др. Молекулярная биология клетки, тт. 1–3. М., 1
Похожие работы
... или нескольких аминокислот образуется более сложное соединение - полипептид. Полипептиды, соединяясь, образуют еще более сложные и крупные частицы и в итоге - сложную молекулу белка. Роль белков в организме. Функции белков в организме разнообразны. Они в значительной мере обусловлены сложностью и разнообразием форм и состава самих белков. Белки - незаменимый строительный материал. Одной из ...
... , вызывает уменьшение количества синтезируемых ферментов. Это последнее явление получило название репрессии синтеза ферментов. Оба явления — индукция и репрессия — взаимосвязаны. Согласно теории Жакоба и Моно в биосинтезе белка у бактерий участвуют по крайней мере три типа генов: структурные гены, ген-регулятор и ген-оператор. Структурные гены определяют первичную структуру синтезируемого белка. ...
... + щелочная ср. NH2 R R R COOH COO – COO – Катион Амфион Анион Таким образом, фактором, определяющим поведение белка как катиона или аниона, является реакция среды, которая определяется концентрацией водородных ионов и выражается величиной рН. Однако ...
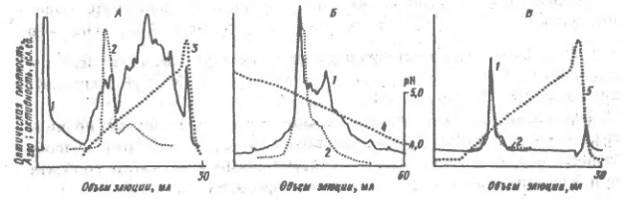
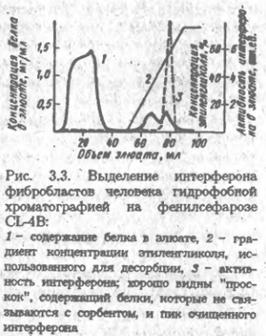
... удовлетворительного фракционирования белков объем наносимого раствора не должен превышать 3-5% общего объема колонки. Ввиду этого к гель-хроматографии обычно прибегают в середине или на завершающих этапах выделения белка. Разумеется, при отделении низкомолекулярных примесей, в частности при обессоливании, объем образца может быть значительно большим, поскольку не требуется высокого разрешения. В ...



0 комментариев