Навигация
Нитрование ароматических углеводородов. Производство нитро-бензола
Министерство образования Российской Федерации
Ангарская Государственная Техническая академия
Кафедра Химической технологии топлива
Курсовая работа
По Технологии нефтехимического синтеза
Тема работы: “Нитрование ароматических углеводородов. Производство нитро-бензола”
Выполнил: ст-нт гр.ТТ-99-1
Семёнов И. А.
Проверил: доцент, к.х.н.
Чернецкая Н.В.
Ангарск 2003
План
Введение 3
1. Теоретические основы нитрования 4
1.1. Общее представление об нитровании 4
1.2. Кинетика процесса нитрования 6
1.3. Фактор нитрующей активности 9
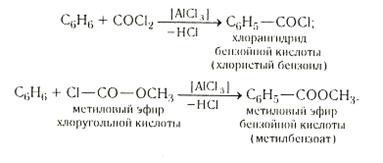
1.4. Механизм нитрования ароматических углеводородов 10
2. Промышленное производство нитробензола 17
2.1. Общие сведения об нитробензоле 17
2.2. Процесс получения нитробензола 17
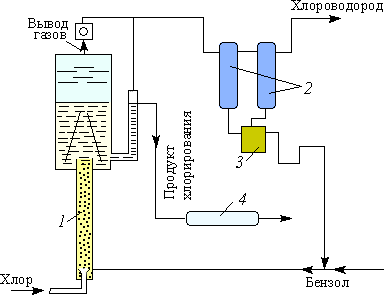
2.3. Аппараты для проведения процесса нитрования бензола 21
2.4. Техника безопасности при производстве нитробензола 22
2.5. Экология 22
2.6. Разработка новых технологий нитрования 23
Заключение 24
Приложение 1 25
Приложение 2 26
Список литературы 27
Введение
Нитрования – один из важнейших процессов в химической промышленности. Продукты, получаемые за счёт нитрования, являются полуфабрикатами для производства многих товаров различных назначений от взрывчатых веществ до продукции фармацептической промышленности. В данной работе рассмотрен наиболее распространённый процесс нитрования, а именно нитрования ароматических углеводородов и в частности нитрование бензола для получения нитробензола.
Из ароматических нитросоединений производные бензола выпускаются промышленностью в наибольшем масштабе. Объем производства нитробензола в мире составил в 1985 г. 1700 тыс. т, моно- и динитротолуолов, монохлорбензолов - сотни тысяч тонн. Нитробензол используется как полупродукт в анилинокрасочной, фармацептической, парфюмерной промышленности. Исходя из нитробензола, получают анилин, бензидин, м-нитроанилин, м-фенилендиамин, п-аминосалициловую кислоту (ПАСК). Нитробензол растворяет многие органические соединения, в том числе нитрат целлюлозы, образуя с ним желатинообразную массу, благодаря чему он используется во многих отраслях промышленности как растворитель. В нефтяной промышленности нитробензол используют как растворитель для очистки смазочных масел.
В работе достаточно подробно рассмотрен механизм и кинетика процесса нитрования ароматических углеводородов, описаны различные нитрующие агенты, а так же описаны их свойства. Т.к. для промышленных исполнений процесса нитрования присущи такие проблемы, как техника безопасности при производстве (в частности нитробензола), проблемы селективности и выхода целевого продукта, развития технологии, экологии производства, поэтому в данной работе они тоже были затронуты в общих чертах.
1. Теоретические основы нитрования
1.1. Общее представление об нитровании
Нитрование - введение нитрогруппы – NO2 в молекулы органических соединений. Может проходить по электрофильному, нуклеофильному и радикальному механизмам; активные частицы в этих реакциях - соответственно катион нитрония NO2, нитрит - ион NO2 и радикал NO2. нитрование может осуществляться по атомам С, N, О замещением атома водорода (прямое нитрование) или других функциональных групп (заместительное нитрование) либо в результате присоединения группы NO2; по кратной связи.
Нитрогруппу в молекулу ароматического углеводорода можно вводить различными путями; главным из них является нитрование углеводородов смесью азотной и серной кислот (нитрующая смесь) в жидкой фазе, последняя одновременно является катализатором процесса, водоотнимающим средством и веществом, способствующим более полному использованию азотной кислоты и препятствующим окислительным процессам. Но по механизму все способы нитрования ароматических углеводородов идут по электрофильному замещению.
Нитрования как процесс принято называть взаимодействие органического соединения с азотной кислотой или её производными, в результате которого атом водорода при одном или нескольких атомах углерода замещается нитрогруппой. В общем случае для процесса нитрования ароматических углеводородов (в ароматическое кольцо) можно написать уравнение:
![]() ArH + NO2+ Ar-NO2 +H+
ArH + NO2+ Ar-NO2 +H+
При нитровании только азотной кислотой реакция может быть выражена уравнением:
![]() ArH + HONO2 Ar-NO2 +H2O
ArH + HONO2 Ar-NO2 +H2O
Это уравнение даёт лишь общее представление о ходе реакции, но не характеризует всего сложного процесса нитрования, протекающего в несколько стадий; в действительности в реакцию с ароматическими углеводородами вступает не сама азотная кислота, а продукты её превращения.
Как видно из приведённого уравнения, при нитровании азотной кислотой введение каждой нитрогруппы в молекулу углеводорода сопровождается образованием молекулы воды. Это значительно уменьшает концентрацию азотной кислоты и понижает её нитрующую способность, а образующаяся слабая азотная кислота увеличивает степень окисления углеводородов. Поэтому нитрование углеводородов только азотной кислотой осуществляют крайне редко; в том случае необходим избыток азотной кислоты по сравнению с теоретически требуемым, а реакцию надо проводить при низких температурах, чтобы ослабить протекание нежелательных окислительных процессов.
Для связывания воды, выделяющейся в процессе нитрования, применяют водоотнимающие вещества – серную кислоту, полифосфорные кислоты, уксусных ангидрид, трёхфтористый бор. Серная кислота – наиболее доступное и дешёвое вещество для этих целей. Она эффективно связывает воду и переводит азотную кислот в активную нитрующую форму; это позволяет резко снизить расход азотной кислоты почти до теоретического.
Роль серной кислоты заключается не только в связывании реакционной воды. Ещё в 1889 г. В. В. Марковников установил, что наличие в реакционной среде серной кислоты ускоряет реакцию нитрования. Следовательно, серную кислоту можно рассматривать как катализатор этой реакции. Заводская практика подтвердила, что нитрование ароматических углеводородов смесью азотной и серной кислот протекает значительно быстрее, чем при действии безводной азотной кислоты, даже взято в большом избытке.
Для промышленных процессов нитрования (и сульфирования) в качестве водоотнимающего средства предложен трёхфтористый бор BF3 . при добавлении достаточного количества трёхфтористого бора реакции сульфирования и нитрования можно проводить стехиометрическими количествами соответствующих кислот (серной и азотной). Полагают, что реакции протекают по следующим схемам:
![]() ArH + HNO3 + BF3 Ar-NO2 + BF3·H2O
ArH + HNO3 + BF3 Ar-NO2 + BF3·H2O
![]() ArH + H2SO4 + BF3 Ar-SO3H + BF3·H2O
ArH + H2SO4 + BF3 Ar-SO3H + BF3·H2O
По окончании реакции добавляют воду; при этом моногидрат фтористого бора превращается в дигидрат BF3·2H2O, который можно отогнать в вакууме. Далее его обрабатывают фтористым кальцием
![]() 2BF3·2H2O + CaF2 Ca(BF4)2 + 4H2O
2BF3·2H2O + CaF2 Ca(BF4)2 + 4H2O
и при нагревании регенерируют BF3:
![]() Ca(BF4)2 2BF3 + CaF2
Ca(BF4)2 2BF3 + CaF2
Особенности проведения нитрования зависят как от использующихся реагентов, так и от субстрата реакции.
Реагенты для проведения реакции нитрования:
1. HNO3 (63-65%, d 1.35 г/мл, товарный продукт) + H2SO4 (96%). Наиболее распространенный.
2. HNO3 (98%, d 1.5 г/мл, также товарный продукт) + H2SO4 (96%-100 %). Для мало реакционноспособных соединений.
3. HNO3 (98%) + SO3 (4-63%), олеум. Для очень мало реакционноспособных соединений.
4. К(Na)NO3 или NH4NO3 + H2SO4 (96%). Распространенный реагент для получения полинитропроизводных.
5. HNO3 (98%, d 1.5 г/мл) + (CH3CO)2O (или СН3СООН). Для реакционноспособных соединений, селективный реагент. Реагент дорогой, поэтому необходимо обосновать экономическую целесообразность его использовании.
6. HNO3 (d 1,3 - 1,5). Для реакционноспособных соединений. Осложнение – побочная реакция окисления.
Похожие работы
... ) В ряду ароматических углеводородов часто применяют тривиальные названия, например, метилбензол иначе называют толуолом. По международной номенклатуре (правила ИЮПАК) все ароматические углеводороды объединяют названием – арены. Соответственно, их одновалентные остатки, образованные отнятием водорода от углеродных атомов ядра (одновалентные ароматические радикалы), называют арилами и обозначают - ...
... продуктов. Сложные эфиры Б. к. (от метилового до амилового), обладающие сильным запахом, применяют в парфюмерной промышленности. Различные производные Б. к., например хлор- и нитробензойные кислоты, широко применяют для синтеза красителей. Эталон в калориметрии; основное вещество для установки титра щелочей; для бензилирования в органическом анализе; растворитель при определении молекулярного ...
... в реакторе регулируется за счет испарения циклогексана. Гидрирование проводится при 200 °С и давлении 4 МПа (парциальное давление водорода ~0,3 МПа). Рис. 3. Технологическая схема процесса производства циклогексана: 1 — основной реактор гидрирования; 2 — вспомогательный реактор гидрирования; 3 — 5, 8 — теплообменники; 6 — сепаратор высокого давления; 7 — колонна стабилизации; 9 — сепаратор; ...
... нитрования с участием нитроний-катиона NO+2 представляет собой замещение водорода: 2. Нитросоединения с нитрогруппой в боковой цепи получают теми же методами, что и нитросоединения алифатического ряда: 1. Нитрование гомологов бензола разбавленной азотной кислотой (реакция Коновалова). Ar-CH3 + HONO2 ® Ar-CH2NO2 + H2O Реакция галогенпроизводных с галогеном в боковой цепи с нитритом ...


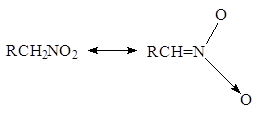
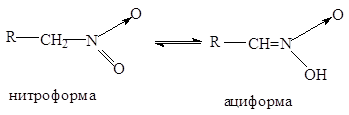
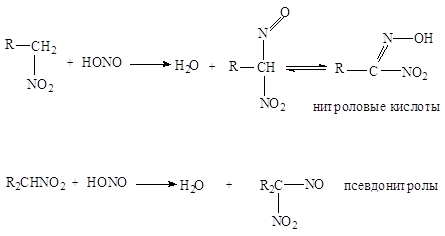
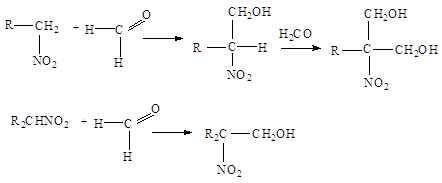
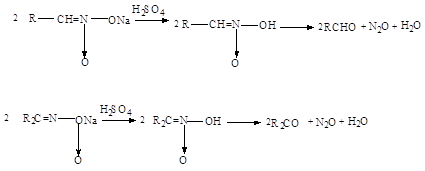
0 комментариев