Навигация
2.2 Свойства.
Фторид натрия представляет собой белое кристаллическое вещество.
Тпл = 997°С, Ткип = 1785°С.
DfH°298 = -569 кДж/моль [9].
Хорошо растворим в воде (41,3 г/л воды [10]). Взаимодействует почти со всеми фторидами металлов III – VII групп и Be с образованием фторметаллатов натрия, например:
3NaF
+ AlF3![]() Na3AlF6.
Na3AlF6.
При растворении в HF, а также при взаимодействии с газообразным фтороводородом образует бифторид натрия NaHF2:
NaF + HF = NaHF2.
В природе NaF встречается в виде минерала виллиомита.
2.3 Получение.
а) Нейтрализация плавиковой кислотой растворов NaOH или Na2CO3до слабокислой реакции:
Na2CO3 + 2HF = 2NaF + CO2 + H2O.
При упаривании выделяется безводный NaF.
б) Термическое
разложение
бифторида
натрия при
температуре
выше 270°С [10]: NaHF2![]() NaF
+ HF.
NaF
+ HF.
NaHF2 разлагается без плавления, в отличие от KHF2.
Для получения чистого NaF продажный препарат достаточно выдержать в течение нескольких часов в сушильном шкафу при температуре 150 – 200°С [11].
Рис. 2. Структура NaCl.
3. Оксид висмута (III).
3.1 Свойства.
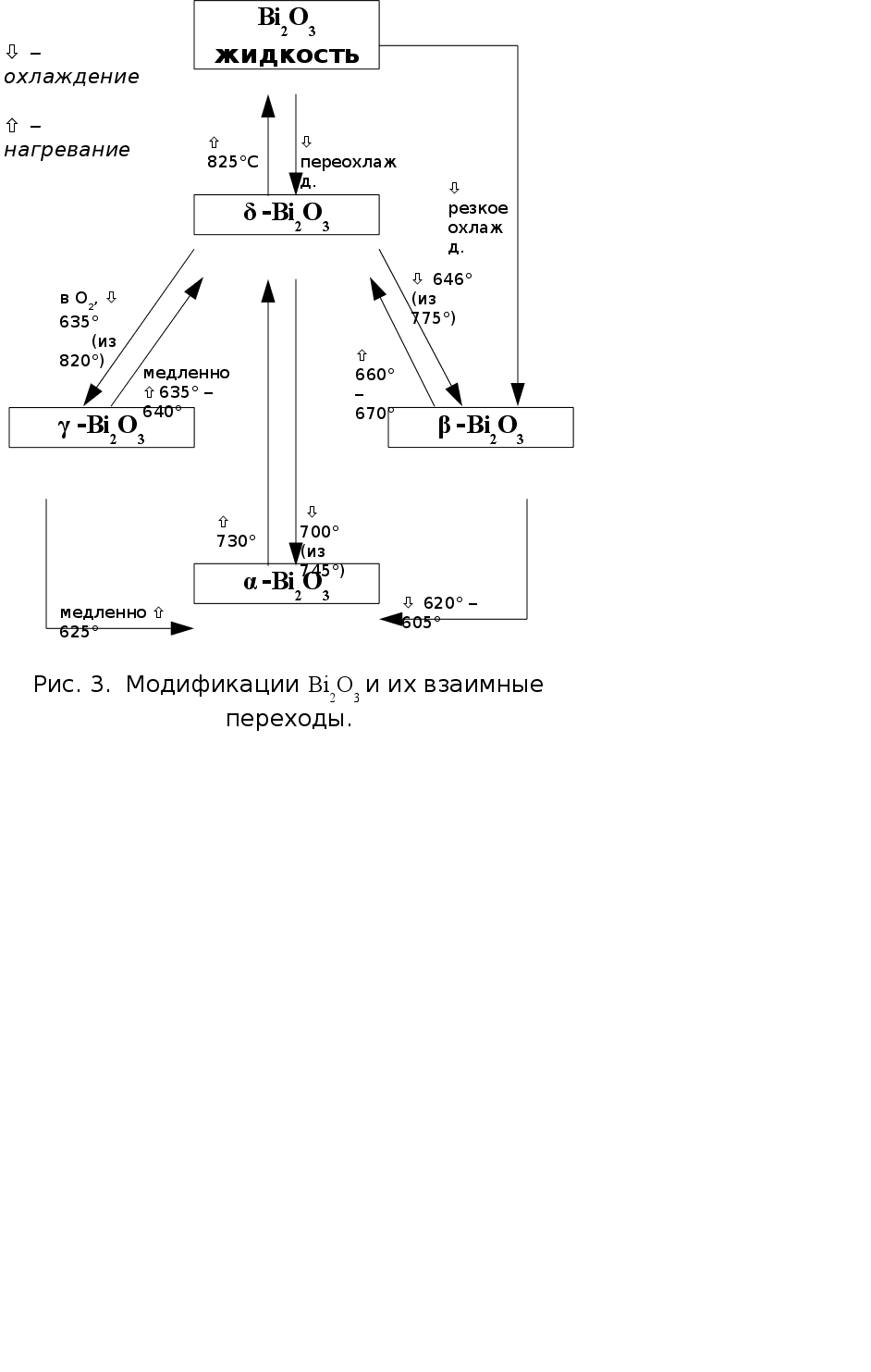
Для оксида висмута (III) известны две стабильные (a и d) и две метастабильные (b и g) модификации (рис. 3) [12].
Стехиометрическая a-форма бледно-желтого цвета устойчива при стандартных условиях и вплоть до температуры 730°С. Имеет моноклинную решетку; пр. гр. Р21/с, параметры элементарной ячейки а = 5,848 �, b = 8,166 �, c = 7,510 �, b = 113° [12].
При постепенном нагревании до 730°С a-Bi2O3 претерпевает полиморфный переход, теряя часть кислорода, и превращается в d-форму (формула Bi2O3-x, где х = 0,045-0,37). Эта модификация оранжевого цвета характеризуется кубической решеткой с параметром а = 5,66 �, пр. гр. Pn3m.
Ярко-желтая g-форма отличается избытком кислорода (формула Bi2O3+x) и представляет собой твердый раствор кислорода в оксиде висмута. Решетка его также кубическая, но по сравнению с d-Bi2O3 элементарная ячейка увеличена вдвое по всем трем направлениям. а = 10,76 � [12] (10,2501(5) � в [13]), пр. гр. I23. Наиболее устойчива g-форма при высоких давлениях кислорода. Ее можно также стабилизировать легированием оксидами кремния или свинца в форме соединений M2Bi24O39, где М = Si, Pb [12]. Получить ее можно при охлаждении d-модификации под давлением О2.
b-Bi2O3, также желтого цвета, можно получить нагреванием висмутита (BiO)2CO3 или охлаждением d-формы до температуры около 640°С. При дальнейшем охлаждении она легко переходит в a-модификацию. b-Bi2O3 кристаллизуется в тетрагональной сингонии, параметры элементарной ячейки: а = 3,85 �, с = 12,25 �. Пр. гр. I4/mm. b-форма является аниондефицитной по отношению к формуле Bi2O3.
В работе [14] масс-спектральным методом исследована область гомогенности оксида висмута (III) при 1070 К. Изучением равновесия "газ – твердая фаза" в платиновой ячейке установлено, что при этой температуре оксид висмута может иметь состав от Bi2O2,8 до Bi2O3,11. Конгруэнтной сублимации при этой температуре отвечает состав Bi2O2,92±0,04.
3.2 Свойства.
d-Bi2O3 плавится при 825°С [12]. Для температуры кипения в [9] приводится значение 1890°С.
DfH°298 (a-Bi2O3) = – 577 кДж/моль [9].
Оксид висмута (III) нерастворим в воде и растворах щелочей. Кислотами переводится в соли висмута (III):
Bi2O3 (тв) + 6HCl (р) = 2BiCl3 (p) + 3H2O.
b-, g- и d-модификации оксида висмута являются анионными проводниками с незначительным вкладом электронной проводимости, тогда как a-Bi2O3 – полупроводник [11].
3.3 Получение.
Наилучшим способом получения оксида висмута считается взаимодействие растворов солей висмута (III), например нитрата Bi(NO3)3 или сульфата Bi2(SO4)3, с избытком раствора щелочи:
Bi(NO3)3 + 3NaOH = Bi(OH)3Ї +3NaNO3.
В осадок выпадает гидроксид висмута, который затем обезвоживают прокаливанием:
2Bi(OH)3![]() Bi2O3
+ 3H2O.
Bi2O3
+ 3H2O.
4. Фторид висмута (III).
4.1 Строение.
Трифторид
висмута существует
в виде двух
полиморфных
модификаций.
Устойчивой
при стандартных
условиях является
ромбическая
модификация
R-BiF3,
при давлении
15±3
кбар переходящая
в тисонитоподобную
(Т-BiF3).
При атмосферном
давлении Т-BiF3
неустойчив
и при отжиге
легко переходит
в R-BiF3
[16].
Параметры элементарной ячейки для первой из модификаций (по [15]): а = 6,565(7) �, b = 7,016(7) �, c = 4,841(5) �. R-BiF3 изоструктурен фториду иттрия (пр. гр. Pnma, Z = 4).
Атом Bi в R-BiF3 окружен восемью ближайшими атомами фтора на расстояниях 2,217 – 2,502 Г, девятый атом фтора находится на расстоянии 3,100 Г (рис. 3). Такое искажение координационной сферы атома висмута объясняется наличием стереохимически активной пары электронов на атоме висмута.
Рис. 4. Окружение атома Bi в R-BiF3.
0 комментариев