Навигация
1. Принцип непрерывности
2. Принцип соответствия
1) При непрерывном изменении параметров определяющих состояние системы, свойства ее отдельных фаз меняются непрерывно до тех пор, пока не изменится число или характер фаз. При появлении новых фаз или исчезновении старых свойства меняются скачком
2) Каждой фазе на диаграмме соответствует определенный геометрический образ: точка, линия или плоскость.
Рассмотрим
Часть плоскости, где фаза существует в определенном агрегатном состоянии, называется полем фазы. Линия пересечения плоскостей характеризует гетерогенное равновесие
OB ® Ж®Г
СО ® Т®Г
АО ® Ж®Т
Точка Фигуративная на диаграмме показывает значение параметров, характеризующих данное состояние системы.
Применим правило Гиббса к данной однокомпонентной системе во всех образах
Т.M ® Ф=1 С=2
Система бивариантна (М)
В пределах поля фазы можно произвольно менять температуру и давление, число и агрегатное состояние не изменяется
Т.N ® Ф=2 С=1
Система моновариантна (N)
Для системы с указанной точкой на любой прямой произвольно можно менять только один параметр (p или T)
Второй меняется в соответствии с первым
Точка О при пересечении линий диаграммы характеризует одновременное существование всех трех фаз системы
Т.О. Ф=3, С=0
Система нон- или инвариантна ® все фазы данной системы могут находиться в равновесии только при единственном сочетании Т и р.
О – тройная точка
Термич анализ
Позволяет по харрактеру изменения тем-ры во времени делать выводы об изменении состояния системы при ее охлаждении. В основе лежит наблюдение за скоростью охлаждения расплавленных чистых в-в и смеси различного состава и построении кривых охлаждения в координатах тем-ра и время.
Растворимость в-в в расплавленном и твердом состоянии различна. Существуют системы:
1) с неограниченной взаимной растворимостью компонентов в жидком состоянии и нерастворимостью в твердом.
2) с неограниченной взаимной растворимостью компонентов в жидком состоянии и непрерывно рядом в твердых р-рах
3) с неограниченной взаимной растворимостью компонентов в жидком состоянии и с ограниченной в твердом
Рассмотрим 1):
№1 А-100%
[ab] – охлаждение жидкого расплава
b – начало кристаллизации
[bc] - кристаллизация
[cd] – охлаждение тв фазы
№2 A-80% B-20%
[ab] – охлаждение жидкого расплава
b – начало кристаллизации компоненты А
[bc] – охлаждение гетерогенной системы, состоящей из 2 компонент расплава и тв фазы, представленной компонентой А, на протяжении [bc] масса А увеличивается
c начало кристаллизации компоненты В
[cd] – характеризует одновременную кристаллизацию 2 компонентов из расплава
d – тем-ра конца кристаллизации данной системы
[de] - охлаждение тв системы
№3 A-60% B-40%
Системы, имеющие наиболее низкую тем-ру нач кристаллизации для данной смеси компонентов, назыв эвтектическим.
№4 A-30% B-70%
№5 B-100%
Линия, отвечающая постоянному составу, наз изоклетой.
Линия (t(A)-E-t(B)), соединяющая точки нач тем-ры кристаллизации, наз ликвидус
Линия (L-E-N), соединяющая точки конца кристаллизации, наз солидус.
Рассмотрим точки, к-ые принадлежат изоклете №2
Т.1 – Ф=1 с=к-Ф+1=3-Ф=2
Оба компонента в жидком состоянии.
Т.2 – отвечает началу кристаллизации заданного состава.
Ф=2 с=1 (какой компонент кристаллизуется первым?) через Т2 проводим конноду в поле существования гетерогенной системы. Т2 и Т2’ отвечает составу фаз, находящихся в равновесии при данной температуре
Т2 – А-80%, В – 20%
Т2’ – А-100%
[от 60% до 100% комп. А]
комп А кристаллизуется быстрее чем В
Т3 – охлаждение твёрдого тела Ф=2, с=1
Состав равновесных фаз определяется точками 3’ и 3’’
Т. 3’ – А-100%
Т. 3’’ – А-65%, В-35%
Правило рычага:
Отношени масс равновесных фаз обр. проп. Отношению длин отрезков ,на которые коннода делится точкой общего состава системы.
mж/mтв=(3’-3)/(3”-3)
Т4 – при температуре кон кристаллизации характеризует одновременно кристаллизацию обоих компанентов. В конце крист каннода совпадает с солидусом. Ф=3, с=0
Состав равновесных фаз определяется точками L,N,E
Т-ки L,N отвечают за составы тв фаз, т-ка Е за состав жид фазы
Т.L – 1-ая тв фаза – 100%А
Т.N – 2-ая тв фаза – 100%В
Т.E – 40%В и 60% А
Т5 – характеризует гетерогеное состояние ф=2 с=1
Т.К – 1-ая тв фаза – 100% А
Т.Р – 2-ая тв фаза – 100%В
Диаграммы состояния бинарной системы с неограниченной взаимной растворимостью компонентов в жид состоянии и непрерывном рядом тв растворах
Для опр состава равновесных фаз через т-ку О (в гетерогенной области) проводим конноду.
Т.К – отвечает за состав тв фазы 15%В и 85%А
Т.L - отвечает за состав жид фазы 45%В и 55%А
mтв/mж =OL/OK
Т.Р – нач кристал
Т.N – кон кристал
Определение состава жид фазы в кон кристал?
Ответ: через Т.М проведем конноду до пересечения с ликвидусом
Q – 32%A, 68%B
Неограниченно растворимыми называются жидкости, которые могут растворяться друг в друге в любых соотношениях, образуя одну жидкую фазу.
От состава образующегося раствора зависит температура кипения, давление насыщенного пара, состав паровой фазы.
По характеру зависимости давления насыщенного пара от состава раствора различают:
· Идеальные растворы (подчиняются закону Рауля)
· С положительным или отрицательным отклонением от закона Рауля, но без экстремальных точек
· С положительным или отрицательным отклонением от закона Рауля и наличием экстремальных точек
1) Идеальные растворы образуются из веществ, молекулы которых сходны по химическому составу, строению и полярности.
Порциальное давление насыщенного пара компонента в растворе линейно подчиняется закону Рауля
![]() pA=pA0NA
pA=pA0NA
pA=pB0NB=PB0(1-NA)
Суммарное давление подчиняется закону Дальтона
pобщ=pA+pB
Изучая соотношения между равновесными составами жидкости и пара, Коновалов сформулировал 2 закона, описывающих равновесие жидкость – пар.
I) В паре содержится больше того компонента, добавление которого в исходный раствор понижает его температуру кипения или повышает общее давление пара над раствором.
Вывод: содержание в равновесных компонентов в паре и жидкости не одинаково.
Реальные растворы отличаются от идеальных, их образование сопровождается ненулевым тепловым эффектом и для них не соблюдается закон Рауля.
Отклонение давления насыщенного пара от линейной зависимости в сторону большего значения называется положительным, а в сторону меньшего – отрицательным.
Растворы с положительным отклонением образуются:
· С поглощением тепла (ph+)
· Химический потенциал компонентов больше, чем в случае простейшего идеального раствора и образуется с увеличением объема
Причина: уменьшение величины частиц вследствие полной или частичной диссоциации комплексов, которые могли быть в одном из чистых компонентов, что вызывает поглощение тепла, облегчает испарение и приводит к положительному отклонению
Растворы с отрицательным отклонением образуются:
· с выделением тепла
· потенциал меньше чем в чистой жидкости с уменьшением объема
Причина: увеличение размера частиц вследствие соединения.
II) Закон КоноваловаДля некоторых систем отклонение от закона Рауля так велики, что на кривой общего давления пара появляются точки, в которых давление пара смеси больше, чем давление чистого более летучего компонента в случаях положительных отклонений или меньше в случаях отрицательных отклонений (менее летучие компоненты)
Максимум на кривой общего давления соответствует минимуму на кривой температур кипения и отвечает такому равновесию раствора и его насыщенного пара, при котором составы обеих фаз одинаковы – это азеотропные точки
Электрохимия
Электрод-гетерогенная эл-хим система состоящая из электронно-проводящей фазы (металл или полупроводник), к-ая находится в контакте с ионным проводником. На границе раздела фаз происходит электродный процесс
Электродный процесс - реакция между компонентами фаз, в результате к-ой происходит переход электрических зарядов из одной фазы в др. Каждая фаза при этом приобретает заряд и на границе их раздела двойной электрический слой, к-ому соответствует электродный пот-л.
Пот-л определяющий процессы – окис-вос реакции, протекающие на электродах Ох+ne=Red
Различают обратимые и необратимые элеткроды
Обратимые – на поверхности к-х происходит одна и та же реакция, но в различных направлениях при пропуске тока в различных направлениях.
Необратимые – на поверх-сти к-х при пропускании тока в различных направлениях происходят процессы, не являющиеся обратными друг другу.
Из обратимых электродов составляются обратимые эл-хим пары, к-ые наз гальваническими элементами. Несколько гальвонич элементов, соединенных последовательно наз цепью (электрохимической).
В-ва, находящ в р-ре, указываются слева от вертикальной черты, справа указыв в-ва, образующ др фазу или электрический пот-л.
Если в р-ре находится несколько ионов, участвующих в процессе, их символы разделяются запятой
У-ия электродных реакций записываются таким образом, чтобы слева располагались в-ва в окислительн форме и электроны, справа в восстановит форме. Для эл-хим элементов
Слева – эелемент, имеющий больший отриц пот-л
Справа – элемент, имеющ больший полож пот-л
Растворы двух электродов разделяются 2 вертикальными чертами, если при создании гальванического элемента используют солевой мостик.
Электрической характеристикой электрода является электродный пот-л, а эл-хим цепи ЭДС
Уравнение Нернста
Рассмотрим обратимый электрод, работающий при постоянной температуре и давлении.
Для обратимого изотермического процесса справедливо уравнение изотермы реакции – ΔG=-RT·lnK+RT·lnK
Изменение изобарно-изотермического пот-ла=максимальной положительной работе.
При Т=const активность твёрдой фазы величина=const близкая к 1
Уравнение Нернста из расчёта пот-ла электрода меньше обратимого относ катиона.
Уравнение расчёта пот-ла электрода обратимого относ аниона.
ЭДС гальванического элемента опр предельное значение разности пот-лов, когда ток через него стремится к 0
Классификация электродов(2 типа)
1 рода:
~ металл или неметалл, погруженные в раствор, содержащий его ионы
к ним относятся:
- электроды обратимые относительно катиона(металлы, погруженные в раствор собственных солей)
- электорды обратимые относительно аниона (неметалл, погруженные в раствор собственных солей)
- амальгамные электроды(раствор металла ртути)
амальгамы металла, которые находятся в контакте с растворами с ионами данного металла
- газовые электроды н/р водородный
стандартный пот-л водородного электрода при любой температуре = 0
2 рода:
~ сложные системы, состоящие из металлов, покрытые слоем его труднорастворимого соединения и погружённого в раствор электролита, содержащего тот же анион, что и труднорастворимое соединение
к ним относятся:
– калонейные
– ионоселективные электроды (н/р стеклянные)
для приготовления хлорсеребряного электрода обычно используют одно-молярный раствор хлорида калия
т.к. пот-л таких электродов не зависит от концентрации измеряемых ионов, то он хорошо воспроизводится в различных растворах, поэтому ф-ия данного электрода – служить электродом сравнения.
Для электродов с водородозависимой ф-ией, н/р для водородного, назначение – индикаторный или измерительный электрод.
Для практических целей используют условные вел-ны, характеризующие пот-лы различных электродов относительно пот-ла электрода, выбранного за стандартный. Таким эталоном явл стандартный водородный электрод. Из стандартного водородного электрода и электрода, пот-л к-ого нужно опр составляют гальвонич элемент так, чтобы водородный электрод был левым. Тогда ЭДС такого гальвонич элемента будет = пот-лу исследуемого электрода. ![]()
![]() ®0
®0
Если при работе такого гальвонич элемента электрод заряжается отриц по отношению к водородному электроду, то его пот-л будет иметь знак «-» и металл переходит в р-р ввиде ионов. Полож пот-л означает, что ионы металла при работе гальвонич элемента из р-ра переходят на электрод и он заряжается полож относит стандартного.
Располагая металлы в ряд по возраст их стандартн пот-лов получен ряд напряжения металлов.
Классификация эл-хим цепей
Два основных вида:
1) химические
2) концентрационные
1) химические состоят из электродов, пот-лы, определяющие реакции к-х различны
а) простые: в них оба эл-да погружены в р-р одного и того же электролита и в них отсутствует диффузионный пот-л.
Н/р водородный и хлорсеребряный электроды погружены в р-р соляно кислоты (Pt)H2½H+½Ag, AgCl
(Pt)H2½HCl½Ag, AgCl
б) сложные: имеют границу раздела между двумя растворами , в которые погружаются электроды. На границе раздела растворов возникает диффузионный пот-л. Н/р цинковый и медный электроды погружены в растворы своих солей. Zn½Zn2+½½Cu2+½Cu
Zn½ZnCl2½½CuSO4½Cu
ЭДС всех перечисленных элементов определяется как разность пот-лов правого и левого электродов Хим цепи используются при создании хим источников тока
2) концентрационные состоят из электродов с одинаковыми пот-лами определяющими реакциями, которые отличаются друг от друга активностью участвующих в них вещ-в
а) 1 рода: состоят из 2 одинаковых по природе электродов, которые различаются активностью, но погруженных в один и тот же раствор электролита. Н/р концентрационные амальгамные цепи
(Hg)Zn½ZnSO4½Zn(Hg)
(Hg)Zn½Zn2+½Zn(Hg)
a1 > a2
в электродах такого типа, чем больше активность металла в амальгаме тем отрицательнее пт-л.
суммарный процесс вводится к переносу металла из амальгама более концен-ой в менее конц-ую
б) 2 рода: состоят из двух одинаковых электродов, но погруженных в 2 раствора одного и того же электролита с различной активностью ионов. Н/р серебряная концентрационная цепь
Ag½AgNO3½½AgNO3½Ag
чем больше активность ионов, тем больше пот-л
суммарный процесс сводится к переносу ионов из более конц растворов в менее.
Преимущества химические источников тока· Портативность
· Бесшумность работы
· Процессы идут при температуре окружающей среды
· Без выделения веществ
В случаях, когда требуется получение большого количества энергии за короткое время, используют аккумуляторы, когда требуется ток малой величины и малое время, используют батарейки.
Химические источники тока подразделяются:
-- По назначению:
- Первичные (1 раз)® батарейки
- Вторичные (много)® аккумуляторы
-- По конструкции
- Элементы с загущенным электролитом (непролив.)
- Элементы с жидким электролитом (наливные)
-- По особенностям работы
- С твердыми окислителями
- Элементы воздушных систем
- Смешанные
Сухой элемент предложен Леклонше (1876г.) марганцево-цинковый элемент. Используется электролит в загущенном виде (загуститель крахмал вещества). Применяется для питания аппаратуры связи и бытовых приборов.
Анод – цинк
Катод – графитовый стержень с оксидом 4-х валентного марганца MnO2.
Электролитом является паста (хлорид аммония с добавлением муки или крахмала)
ZnúNH4ClúMnO2
A: Zn®Zn2++2e
2Zn2++NH4Cl®[Zn(NH3)4]Cl2+ZnCl2+4H+
K: Восстановление Mn4+ к Mn3+
MnO2+H++e®MnOOH
Суммарное уравнение токообразующей реакции
2Zn0+4MnO2+4NH4Cl®4MnOOH+ZnCl+[Zn(NH2)]Cl2
A K E=1,5B
Сухой кислородно-цинковый элемент
ZnúNH4ClúO2
Катодным деполяризатором является кислород воздуха, током отвода – активированный уголь, пропитанный водоотталкивающим веществом.
Катод – полый угольный цилиндр, внутренняя полость которого обеспечивает доступ кислорода. Снаружи он соприкасается с загущенным электролитом.
O2+2Zn+4NH4Cl®ZnCl2+[Zn(NH3)4]Cl2+2H2O
E=1,4B
Ртутно-цинковый
Катод – оксид ртути с графитом и запрессованный в отдельный корпус
Анод – цинковый порошок с добавкой 1% ртути, который запрессовывается в крошку электролита
Электролит – 40% гидроксид калия с добавкой 5% оксида цинка. Им пропитывают фильтрованную бумагу, которую помещают между электродами.
HgO+2KOH+Zn®K2ZnO2+H2O+Hg
E=1,34B
Элементы хранятся много лет и работают при температуре до 1300 и используется в приемниках, слуховых аппаратах и кардиостимуляторах.
НаливныеМожно увеличивать напряжение так как на аноде металл с более электроотрицательным потенциалом (Mg). Однако такие аноды в водных растворах окисляются, выделяя водород, что ведет к саморазряду аккумулятора при хранении. Поэтому разработаны элементы, которые хранятся в сухом виде и электролит заливают перед началом работы.
Свинцово-кадмиевый
CdúH2SO4úPbO2
PbO2+H2SO4+Cd®PbSO4+CdSO4+2H2O
E=2,2B
Аккумулятор – устройство, в котором происходит взаимные превращения электрической энергии в химическую и наоборот.
В них под действием внешнего источника тока накапливается химическая энергия, которая затем переходит в электрическую. Процесс накопления химической энергии называется зарядкой аккумулятора, процесс превращения химической энергии в электрическую – разрядкой.
При зарядке он работает как электролизер, при разрядке – гальванический элемент
Свинцовый
Электроды создаются заполнением решеток свинцовой решетки пастой из оксида 2-х валентного свинца. Электролит – 32% H2SO4 при погружении электродов в раствор H2SO4 происходит реакция
PbO+H2SO4®PbSO4¯+H2O
В этом состоянии оба электрода имеют один состав, окислительно-восстановительное взаимодействие невозможно, значит аккумулятор разряжен.
При зарядке через аккумулятор пропускают постоянный ток, и при этом протекает процессы электролиза. На катоде идет процесс восстановления свинца от +2 до 0
K: PbSO4+2H2++2e®Pb+H2SO4
Pb2++2e®Pb0
A: PbSO4+SO42+®Pb(SO4)2+2e
Pb2+®Pb4++2e
Pb(SO4)2+2H2O®PbO2+H2SO4
Таким образом, после разрядки один электрод представляет собой губчатый свинец (PbO2).
При работе аккумулятора (разрядке) процесс протекает в другом направлении
K: Pb4+O2+H2SO4®Pb(SO4)2+H2O
Pb4+(SO4)2+2H++2e®Pb2+SO4+H2SO4
Pb4++2e®Pb2+
A: Pb+SO42–®PbSO4+2e
Pb0®Pb2++2e
Pb+PbO2+2H2SO4«2PbSO4+2H2O
![]() E=2,04B
E=2,04B
![]()
В конце заряда напряжение достигает значения диссоциации воды
K: 2H++2e®H20
A: 2H2O®O2+4H++4e
Разряжать аккумулятор следует до 1,7В, так как при этом на электродах образуется сульфат свинца (PbSO4) особой кристаллической структуры, которая изолирует активную массу электрода от электролита.
Похожие работы
... и осуществлялись им с исключительной строгостью Экспериментальных данных Вюрца впоследствии никто не опровергал, они были безукоризненны. С первыми теоретическими работами Вюрц выступил в 40-е годы XIX в.— время становления теоретических основ химии, когда подрывались принципы дуалистической системы и теории сложных радикалов, когда трудами французских химиков Дюма, Лорана и Жерара закладывались ...
... г. для химической лаборатории построено отдельное здание. При чтении лекций в это время профессора придерживаются большей частью руководств Теннара, Пайена, Розе, Пфаффа и Берцелиуса. Следовательно, новое направление химии в России было усвоено весьма скоро. К этому же времени относится и появление, кроме переводных, также и первых оригинальных руководств по химии на русском языке. В 1810 - 1813 ...
... свежесорванных растениях массовая доля сухого вещества составляет (100–82,5)=17,5%. Тогда 100 г сырья – 17,5 г сух. раст. матер. х г сырья – 17,7 г сух. раст. матер. Отсюда х = 100•17,7/17,5 = 100,1 г. химия медицина курс Поскольку в настоях и отварах трав абсолютно точно дозировать содержание лекарственного вещества невозможно, с достаточной степенью точности можно принять, что необходимое ...
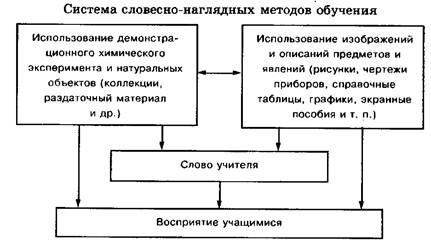
... экономики» и др. Семинар - это метод, сближающий школьные формы работы с вузовскими, и для старшеклассников он полезен [5-7]. 4. СИСТЕМА СЛОВЕСНО-НАГЛЯДНЫХ МЕТОДОВ ОБУЧЕНИЯ ХИМИИ И ИХ ВЗАИМОСВЯЗЬ СО СРЕДСТВАМИ НАГЛЯДНОСТИ Словесно-наглядные методы обучения определяют использование в учебном процессе различных средств наглядности в сочетании со словом учителя. Они непосредственно связаны со ...
0 комментариев