Навигация
Курсовая работа по дисциплине «Основы общей экологии»
Носкова Анна Евгеньевна 1 курс, гр. 05 ГЭБ
Таврический национальный университет им. В.И. Вернадского
Керчь. 2006
Данная курсовая работа состоит из трех глав. В нее включены 6 таблиц и 4 рисунка. При написании курсовой работы были использованы 15 источников литературы.
В данной работе рассмотрены водные ресурсы земли, влияние воды на здоровье населения ее благоприятное и неблагоприятное воздействие, требования потребителей и пользователей к качеству воды, а также показатели качества воды. Изучена вода как вещество, ресурс и необходимое условие жизни. Выяснено влияние химических примесей в воде на ее состав, свойства и качество. А также предложены экологически рациональные пути использования водных объектов; в частности основные тенденции использования водных ресурсов, охрана вод и предотвращение ее пагубного воздействия.
ВООЗ, ДСан ПиН, водообеспечение, водопользователи, водопотребление, водоснабжение, Мировой Океан, питьевая вода, растворы, минерализация, сточные воды, удельное водопотребление, качество воды, истощение вод, загрязнение вод, внутриклеточная жидкость, внеклеточная жидкость, рациональное использование природных вод.
ВведениеНельзя сказать что ты необходима для жизни: ты сама жизнь…
Ты наибольшее богатство в мире…
Антуан де Сент-Экзюпери.
Вода – весьма распространенное на Земле вещество. Она обеспечивает жизнь всем организмам, и является единственным источником кислорода в главном жизненном процесса на Земле – фотосинтезе. Все живые существа на 80-90 % состоят из воды. Потеря 10-20 % Согласно современным представлениям само происхождение жизни связывается с морем. Во всяком организме вода представляет собой среду, в которой протекают химические процессы, обеспечивающие жизнедеятельность организма; кроме того, она сама принимает участие в целом ряде биохимических реакций.
Ни одна сфера человеческой деятельности не обходится без использования воды, ведь она – это сама жизнь. Человек использует воду для питья, приготовления воды, и удовлетворения различных жизненных потребностей. Доля воды в теле человека близка к 60 %, но в отдельных органах и тканях она варьирует от 1 до 96 %.
Масса пресной воды на земном шаре составляет 31 млн. км3, основное количество которой (96%) сосредоточена в ледниках Гренландии, Антарктиды, горных массивов, в айсбергах и зоне вечной мерзлоты. Из всего количества пресной воды только около 1 % используется человечеством для удовлетворения своих потребностей.
Каждый житель Земли в среднем потребляет 650 м3 воды в год (1780 л в сутки). Однако для удовлетворения физиологических потребностей достаточно 2,5 л в день, т. е. около 1 м3 в год. Большое количество воды требуется сельскому хозяйству (69 %) главным образом для орошения; 23 % воды потребляет промышленность; 6 % расходуется в быту.
Цель данной курсовой работы – познакомиться с водой как уникальным веществом и ресурсом, а также влиянием ее на здоровье населения. Существенное внимание при этом уделяется причинам, экологическим следствиям и возможным путям решения экологических проблем.
Теперь возникает вопрос: почему же человеку так необходима качественная вода?
Когда-то люди довольствовались водой, которую они находили в реках, озерах, ручьях и колодцах. Но с развитием промышленности и ростом населения появилась необходимость гораздо тщательнее управлять водоснабжением, чтобы избежать вреда для здоровья человека и ущерба окружающей среды. Загрязнению подвержены все категории вод: океанические, континентальные, подземные, хотя и в разной степени.
Качество вод (это совокупность физических, химических, биологических и бактериологических показателей, которые удовлетворяют требования потребителей[15]), особенно пресных, стало одним из важнейших факторов здоровья населения. Всемирная организация охраны здоровья (ВООЗ) отмечает, что на планете от низкого качества воды ежегодно умирает около 5 млн. человек (в основном детей), а получают различной степени отравления или заболевания от 500 миллионов до 1 миллиарда человек, что 80% заболеваний на планете вызваны потреблением некачественной питьевой воды. Проблема чистой воды стоит перед многими странами.
Истощая или загрязняя воды, человек не только лишает себя данного ресурса, но и разрушает среды жизни многих организмов, нарушает свойственные им связи.
1. Вода и её свойства.Физические свойства воды.
Чистая вода представляет собой бесцветную прозрачную жидкость, без запаха и вкуса. Однако в толстом слое водоёма она приобретает голубой цвет. После сильного охлаждения вода замерзает, превращаясь в лёд. Основные величины, которые характеризируют физико-химические свойства воды, приведены в таблице 1.1.[14]
Таблица 1.1 Физико-химические константы воды
| Показатель | Значение |
| Температура, °С кипения замерзания, Критическая (ий) температура, °С давление, МПа вязкость, г/см Теплота плавления за 0,101 МПа(1 атм.), Дж/г сублимации льда за 0°С, Дж/г Удельная теплоёмкость льда за 0°С.Дж/(г · град) теплопроводность, Дж/(см · с · град) льда жидкости при 0° пара при 100°С электропроводность, См/см (Ом · см) льда при 0°С жидкости при 0°С жидкости при 50°С Диэлектрическая проницаемость жидкости при 20°С пара при 145°С и 0,101 МПа (1 атм.) Показатель заломления для линии Na при 20°С и 0,101 МПа (760 мм рт. ст.) Скорость распространения звука при 25°С, м/с Термодинамические величины: энтропия (S, газ, 101325 Па, 25 С), Дж/(моль К) теплоёмкость при 25°С, Дж/(моль К) Теплота электролитической диссоциации при 20°С, кДж/моль | 100 0 374,15 22,07(218,53 атм.) 0,325 332,43 2334,46 2,74 23,45 · 10-3 5,987 · 10-3 0,231 · 10-3 0,4 · 10 -8 1,47 · 10-8 18,9 · 10-8 81,0 1,007 1,33299 1496,3 188,846 76,07 -57,15 |
Плотность воды при переходе ее из твёрдого состояния в жидкое не уменьшается, как почти у всех других веществ, а возрастает. При нагревании воды от 0 до 4°С плотность её также увеличивается. При 4°C вода имеет максимальную плотность, и лишь при дальнейшем нагревании её плотность уменьшается.
Если бы понижение температуры и при переходе из жидкого состояния в твердое плотность воды изменялась так же, как это происходит у подавляющего большинства веществ, то при приближении зимы поверхностные слои природных вод охлаждались бы до 0°C и опускались на дно, освобождая место более теплым слоям, итак продолжалось бы до тех пор, пока вся масса водоема не приобрела бы температуру 0°C.Далее вода начинала бы замерзать, образующиеся льдины погружались бы на дно и водоем промерзал бы на всю его глубину. При этом многие формы жизни в воде были бы не возможны. Но так как наибольшей плотности вода достигает при 4°C, то перемещение ее слоев, вызываемое охлаждением, заканчивается при достижении этой температуры. При дальнейшем понижении температуры охлажденный слой, обладающий меньшей плотностью, остается на поверхности, замерзает и тем самым защищает лежащие ниже слои от дальнейшего охлаждения и замерзания.
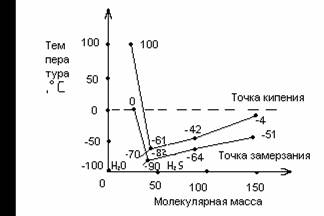
Аномальными для воды являются так же такие фундаментальные физические качества, как температура кипения и замерзания. Вода- гидрид кислорода своим молекулярным составом подобна гидридам элементов главной подгруппы шестой группы периодической системы элементов Д. И. Менделеева (H2S, H2Se, H2Te). Заряд ядра атома элемента, который их образует, определяет физические свойства веществ этого ряда.
![]() Исходя из определенных закономерностей для ряда H2Te - H2S, следовало бы ожидать, что вода должна кипеть при температуре -70°C, а замерзать – при -90°C. На самом деле при обычных условиях вода замерзает при температуре 0°C и закипает при температуре 100°C, то есть кривые поднимаются резко вверх вместо того, что бы опускаться (рисунок 1.1)[7].
Исходя из определенных закономерностей для ряда H2Te - H2S, следовало бы ожидать, что вода должна кипеть при температуре -70°C, а замерзать – при -90°C. На самом деле при обычных условиях вода замерзает при температуре 0°C и закипает при температуре 100°C, то есть кривые поднимаются резко вверх вместо того, что бы опускаться (рисунок 1.1)[7].
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() Почему же так происходит? Возможно, вода – уникальное исключение из правил. Причины этого явления пока еще до конца не установлены, хотя и предвидят, что это, очевидно, зависит от строения ее молекул и межмолекулярной структуры.
Почему же так происходит? Возможно, вода – уникальное исключение из правил. Причины этого явления пока еще до конца не установлены, хотя и предвидят, что это, очевидно, зависит от строения ее молекул и межмолекулярной структуры.
Молекула воды имеет угловое строение: входящие в ее состав ядра образуют равнобедренный треугольник, в основании которого находятся два протона, а в вершине ядро атома кислорода. Угол при
(рис. 1.1)
вершине равен примерно 106°, а стороны треугольника имеют длину 0,96 Å (ангстрема), т. е. 10 -10 м; расстояние между ядрами водорода HH =1,5 Å. Треугольник HOH находится внутри сферы, по которой движутся электроны. Центр инерции сферы С не совпадает с центром атома кислорода O и находится от него на расстоянии 0,13 Å[2].
В твердой воде (лед) атом кислорода каждой молекулы участвует в образовании двух водородных связей с соседними молекулами воды. Схема объемной структуры льда изображена на рисунке 1.2[4].
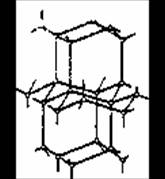 Образование водородных связей приводит к такому расположению молекул воды, при котором они соприкасаются друг с другом своими разноименными полюсами. Молекулы образуют слои, причем каждая из них связана с тремя молекулами, принадлежащими к тому же слою, и с одной из соседнего слоя. Структура льда принадлежит к наименее плотным структурам, в ней существуют пустоты, размеры которых несколько превышают размеры молекулы H2O.
Образование водородных связей приводит к такому расположению молекул воды, при котором они соприкасаются друг с другом своими разноименными полюсами. Молекулы образуют слои, причем каждая из них связана с тремя молекулами, принадлежащими к тому же слою, и с одной из соседнего слоя. Структура льда принадлежит к наименее плотным структурам, в ней существуют пустоты, размеры которых несколько превышают размеры молекулы H2O.
(рис. 1.2)
Итак, аномальность температур плавления льда и кипения воды связана с тем, что существование ее в условиях Земли в твердом и жидком состоянии также аномально. Нормальным было бы пребывание воды только в газообразном виде.
Ассоциированость воды обуславливает очень высокую теплоту ее парообразования. Например, для того чтобы выпарить 1 г воды, нагретой до 100ºC, требуется в шесть раз больше теплоты, чем для нагревания точно такого же количества воды от 0 до 80ºC. Благодаря этому вода является мощным энергоносителем на нашей планете. Способность воды накоплять большие запасы тепловой энергии дает возможность нивелировать резкие температурные колебания на земной поверхности в разные времена года и суток, т. е. Вода является регулятором температуры воздуха.
Среди физических свойств воды следует отметить ее высокое поверхностное натяжение – 72,7 ·10-7 Дж/см2 (при 20ºC). В этом отношении среди всех жидкостей вода уступает только ртути. Эта особенность воды проявляется в постоянном стремлении ее стягивать свою поверхность, несмотря на способность свободно размещать свой объем по форме занимаемого объекта. Высокое поверхностное натяжение воды приводит к тому, что она во время свободного падения или в состоянии невесомости приобретает форму шара, т. е. Геометрической формы с наименьшей поверхностью для этого объема.
Особенно наглядно выявляется поверхностное натяжение в смачивании – «прилипании» воды ко многим поверхностям. Установлено, что все вещества, например песок, стекло, глина, бумага, ткани и др., которые легко смачиваются водой, обязательно имеют в своем составе молекулы с атомами кислорода. Эта особенность воды дала возможность пояснить природу процесса смачивания: энергетически неуравновешенные молекулы поверхностного слоя воды получают способность образовывать дополнительные водородные связи с атомами кислорода указанных выше веществ.
Смачивание и поверхностное натяжение являются основой явления капиллярности. Последнее заключается в том, в узких каналах (капиллярах) вода может подниматься на высоту значительно большую, нежели та, которая допускается силой гравитации для столбика этого пересечения.
Итак, модифицируя структуру воды, можно достичь желаемых ее качеств. Это дает возможность эффективно использовать воду во многих сферах техники и хозяйственной деятельности.
После добавления в воду небольших количеств (части процента) полимерных соединений с большой полимерной массой, например полиакриламида, получают «скользкую» воду. Стеклянный шарик, погруженный в такую воду, падает в 2 – 2,5 раза быстрее, нежели в обычной, и быстро двигается в трубопроводах. Образование ассоциатов молекул воды с макромолекулами полимерных добавок способствует разрушению гидратных оболочек вокруг взвесей и ускоряет выпадение их в осадок.
Добавление небольших доз кремнесодержащих веществ придает воде резиноподобного вида. В этом случае вода из наклоненного сосуда не выливается, а вытягивается в виде эластичного жгута. При введении в воду небольших доз (сотые миллиграмма) металлов, например серебра, вода приобретает высокие бактерицидные и лекарственные качества и является прекрасным консервантом. «Серебряная вода» сохраняется в течении долгого времени, не утрачивая своих качеств питьевой воды.
Химические свойства воды.
Взаимодействие водорода с кислородом в газообразном виде при отсутствие катализатора медленно происходит только при 3000ºC по схеме[4]:
2H2 + O2 = 2H2O.
При повышении температуры скорость реакции возрастает и при 550ºC она происходит со взрывом. При наявности катализатора, например платины, ход реакции ускоряется.
Молекулы воды отличаются большой устойчивостью к нагреванию. Однако при температурах выше 1000ºC водяной пар начинает разлагаться на водород и кислород[4]:
2H2O ↔ 2H2 + O2.
Термическая диссоциация воды протекает с поглощением теплоты. Поэтому, согласно принципу Ле Шателье, чем выше температура, тем в большей степени разлагается вода. Однако даже при 2000ºC степень термической диссоциации не превышает 2%, т.е. равновесие между газообразной водой и продуктами ее диссоциации – водородом и кислородом - все еще остается сдвинутым в сторону воды. При охлаждении же ниже 1000ºC равновесие практически полностью сдвигается в этом направлении.
Кроме термической диссоциации вода способна также к электролитической, фитохимической и радиолитической диссоциации.
Электролитическая диссоциация воды в жидком виде происходит по схеме[4]:
H2O = H+ + OH¯
Вода – весьма реакционноспособное вещество. Оксиды многих металлов и неметаллов соединяются с водой, образуя основания и кислоты; некоторые соли образуют с водой кристаллогидраты; наиболее активные металлы взаимодействуют с водой с выделением водорода.
С инертными газами вода образует гидраты, которые стойки при очень низких температурах. Вода окисляет кислородом в атомарном виде по схеме:
H2O + O2 = H2O2.
При обычных температурах вода реагирует с фтором с выделением атомарного кислорода[4]:
H2O + F2 = 2HF + O.
Кроме того, могут образовываться O2, O3, H2O2, F2O, которые являются продуктами взаимодействия атомов кислорода друг с другом и с F2, H2O.
Во время растворения в воде хлора происходит реакция гидролиза хлора по схеме[4]:
H2O + Cl2 = HCl + HOCl.
Вода обладает также каталитической способностью. В отсутствие следов влаги практически не протекают некоторые обычные реакции; например, хлор не взаимодействует с металлами, фтороводород не разъедает стекло, натрий не окисляется в атмосфере воздуха.
Вода способна соединятся с рядом веществ, находящихся при обычных условиях в газообразном состоянии, образуя при этом так называемые гидраты газов. Примерами могут служить соединения Xe · 6H2O, Cl2 · 8H2O, C2H6 · 6H2O, C3H8 · 17H2O, которые выпадают в виде кристаллов при температурах от 0 до 24ºC (обычно при повышенном давлении соответствующего газа). Подобные соединения возникают в результате заполнения молекулами газа («гостя») межмолекулярных полостей, имеющихся в структуре воды («хозяина»); они называются соединениями включения или клатратами[4].
Клатраты используют для разделения углеводородов и природных газов. В последнее время образование и разрушение клатратов газов (пропана и некоторых других) успешно применяется для обессоливания воды. Высокая экономичность и сравнительно мягкие условия осуществления этого процесса делают его перспективным в качестве промышленного метода опреснения воды.
Воде присущи слабые окислительные качества за счет атомов водорода с высшей степенью окисления ионов H+. При высоких температурах и наличии катализаторов вода окисляет метан, оксид углерода (ІІ) , углерод, железо, фосфор, при обычных условиях - щелочные и щелочноземельные и их гидриды[4]:
CO + H2O = CO2 + H2 ↑ (катализатор Fe);
3Fe + H2O=Fe3O4 + 4H2↑;
CH4 + H2O = CO + 3H2↑ (1200 – 1400 °C без катализатора и при катализаторе – Ni или Co при 700 – 800 °C);
CaH2 + 2H2O = Ca (OH) 2 + 2H2↑;
2Na + 2H2O = 2NaOH + H2↑;
Ca + 2H2O = Ca(OH)2 + H2↑.
При растворении в воде кислотных и щелочных оксидов образуются соответственно кислоты и щелочи, а при растворении солей, кислот, оснований происходит их гидратация, т. е. присоединение молекул воды к молекулам растворенного вещества.
Природные воды почти никогда не бывают химически чистыми, так как содержат различные вещества в растворенном и взвешенном состоянии. В процессе взаимодействия гидросферы с атмосферой, литосферой и биосферой вода оказывает влияние на различные вещества, образуя истинные и коллоидные растворы. Истинные растворы – это такие, в которых растворенные вещества находятся в виде молекул и ионов с размерами частиц, не превышающими 10-7 мм. Коллоидные же растворы включают в себя не отдельные молекулы, а группы молекул и ионов с размерами растворенных частиц от 10-1 до 10-5 мм. Коллоидные растворы более устойчивы, но в природных водах они встречаются в незначительных количествах[6].
Природные воды различаются между собой по химическому составу, концентрации, соотношению в форме соединений между химическими элементами, находящимися в растворе.
Похожие работы
... часть городского населения была ограждена от опасности водного пути её распространения благодаря нормальному централизованному водоснабжению. 3 Влияние химического состава воды на здоровье населения Химический состав воды. Факторы, определяющие химический состав воды, - химические вещества, которые условно можно разделить на: 1.биоэлементы (йод, фтор, медь, кобальт) 2.химические элементы ...
... . Отметим, что кроме алкоголя и никотина нарастает тенденция использования наркотиков, способных еще больше обострить ситуацию со здоровьем россиян, в том числе и жителей российского Севера. 9.4. Влияние на здоровье населения загрязнений воздушной и водной сред (по материалам Государственного доклада за 1994 г.) Воздействие на здоровье населения промышленных комплексов, загрязняющих атмосферу, ...
... расчеты свидетельствуют, что в целом по России ежегодно в водно-болотные угодья попадает до 1400 т свинца. В табл. 1 приведены сравнительные данные по источникам загрязнения окружающей среды Российской Федерации свинцом. Анализ приведенных в ней материалов свидетельствует, что несомненным лидером в загрязнении свинцом всех компонентов природной среды России является автотранспорт (примерно 70% ...
... механизмов природопользования; · составление краткосрочных и долгосрочных прогнозов экологической обстановки в городе и здоровья населения. С целью охраны здоровья населения, обеспечения экологической безопасности окружающей среды, сохранения генетического фонда и равновесия городских и природных экосистем, обеспечения рационального использования и воспроизводства природных ресурсов ...
0 комментариев