Навигация
Активация малых молекул
1. Введение
В катализе часто применяют термин “активация”, понимая при этом повышение реакционной способности реагентов. Попытаемся наполнить этот термин конкретным физическим содержанием. Под активацией субстрата будем понимать степень и характер воздействия катализатора на субстрат, приводящих к превращению первичного комплекса в промежуточное соединение, содержащее в координационной сфере реакционноспособные фрагменты субстрата. Анализ имеющихся данных о влиянии координации на физические свойства лигандов и о реакциях координированных лигандов позволяет понять наиболее существенные черты механизма активации каждой молекулы.
Рассмотрим современные представления о механизме активации простых молекул комплексами переходных металлов. Механизмы активации молекул различного типа кислотными катализаторами рассмотрены ранее.
Сущность активации заключается в изменении определенных характеристик субстратов при образовании первичного комплекса с катализатором.
Кат-р + субстрат ® Х1 ® Х2 ….. ® Хn ® P + K
При образовании первичного комплекса возможны три варианта
Образуется очень прочный комплекс между субстратом и катализатором. Субстрат в таком комплексе оказывается менее реакционноспособным, чем в свободном виде.
В первичном комплексе происходит изменение характеристик субстрата в желательном направлении: изменение валентных углов, понижение частоты валентных колебаний и удлинение связей. Реакционная способность увеличивается.
При комплексообразовании происходит расщепление субстрата на фрагменты, часть которых или все могут оказаться в координационной сфере комплекса.
Второй и третий случаи называют активацией за счет координации и активацией за счет присоединения, соответственно.
2. Активация молекулы водорода
Проблема активации этой молекулы важна т.к. водород один из основных реагентов НХС и ООС (гидрообработка, гидрогенолиз, гидрирование ненасыщенных соединений, синтезы из синтез-газа).
Молекула Н2 – слабый донор (IH2= 15,4 эВ) и слабый акцептор (FH2= -0,7 эВ).
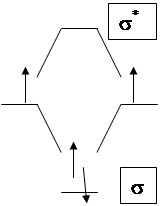
Рассмотрим возможности активации этой молекулы с точки зрения теории МО.
 | |||||||||
| |||||||||
Энергия диссоциации связи Н-Н зависит от заселенности орбиталей электронами (табл. 1).
Таблица 1
Энергия диссоциации связи Н-Н в зависимости от заселенности орбиталей
| Частица | ЕD, кДж/моль | LH-H, Å |
| Н2 | 430,5 | 0,74 |
| Н2+ | 259,2 | 1,07 |
| Н2 - | 17,14 | 0,86 |
|
Хотя сродство Н2 к Н+ довольно велико (в газовой фазе DНО = -322кДж/моль) активация протоном молекулы Н2 (вариант а) оказалась возможной только в растворе суперкислоты SbF5-HF в апротонных средах (SO2, SO2ClF ), cудя по реакциям дейтерообмена. Вариант (б) оказался более простым. Активация водорода легко осуществляется основаниями (ОН-, КNH2, К). Промотирование электронов на разрыхляющую орбиталь водорода является решающим фактором активации (К+Н2-).
Первичные комплексы для водорода были получены примерно в 1980 г. Первым из них был (CO)3W(P i-Pr3)2(h2-H2). Структура комплекса представляет собой октаэдр с молекулой водорода, занимающей одно координационное место в экваториальной плоскости вместе с тремя карбонилами. Длина связи Н-Н составляет 0,84 Å (сравни с табл 1). В аналогичном комплексе иридия Ir(H)2(h2-H2)[P(C6H11)3]2 наблюдается быстрый обмен между координированным молекулярным водородом и гидридными лигандами. Однако в этих комплексах координирована молекула водорода и ее активация сводится лишь к удлинению связи H-H.
В большинстве случаев взаимодействие водорода с комплексами переходных металлов приводит к разрыву связи в молекуле водорода. При этом возможны два основных направления превращения водорода при взаимодействии с комплексами переходных металлов.
В случае комплексов металлов в высоких степенях окисления с преобладанием акцепторных свойств происходит гетеролитический разрыв связи в водороде (электрофильное замещение Н+ на комплекс металла).
Cu2+ + H2 ® CuH+ + H+
PtCl2 + H2 ® ClPtH + HCl
RuCl63- + H2 ® H RuCl53- + HCl
Комплексы металлов в низших степенях окисления, имеющие возможность повысить степень окисления и координационное число, ведут к гомолитическому расщеплению связи Н-Н. В этом случае дативная компонента связи преобладает над донорно-акцепторной.
IrCl(CO)L2 + H2 ® (H)2 IrCl(CO)L2
Co2(CO)8 + H2 ® 2 HCo(CO)4
Похожие работы
... ткани. Тем не менее такой срок жизни реагирующих на антиген лимфоцитов достаточен для развития эффективных клеточных и гуморальных иммунных ответов. Накапливается все больше данных о том, что элиминация клеток, уже не нужных после завершения иммунного ответа, происходит путем апоптоза. ВЗАИМОДЕЙСТВИЕ В- и Т-КЛЕТОК Т- и В-лимфоциты распознают разные участки молекулы антигена Большой вклад в ...
... с кислородом, восстановлением - отнятие кислорода. С введением в химию электронных представлений понятие окислительно-восстановительных реакций было распространено на реакции, в которых кислород не участвует. В неорганической химии окислительно-восстановительные реакции (ОВР) формально могут рассматриваться как перемещение электронов от атома одного реагента (восстановителя) к атому другого ( ...
... в состав липопротеидов, во-первых, участвуют в структурной организации липопротеидных частиц; во-вторых, они могут служить кофакторами ферментов ( по-видимому, белками-модуляторами), участвующих в обмене липидов липопротеидов: апо-С-II - активатор липопротеидлипазы, апо-А-II активатор печеночной триглицеридлипазы, апо-А-I и апо-С-I -активаторы лецитин-холестерол-ацилтрансферазы; в третьих, белки ...
... (47) Величина, обратная t, характеризует скорость прироста при данной температуре концентрации триплетных молекул акцептора энергии, q = 1/t , и называется константой скорости процесса [161]. Итак, прирост в результате отжига образца числа молекул, участвующих в излучении сенсибилизированной фосфоресценции происходит по экспоненциальному закону. Константа скорости этого ...





0 комментариев