Навигация
Образование карбоновых кислот
6. Образование карбоновых кислот.
Первичные нитросоединения при нагревании 85%-ной серной кислоты переходят в карбоновые кислоты с отщеплением гидроксиламина. Реакция может служить промышленным способом получения гидроксиламина:
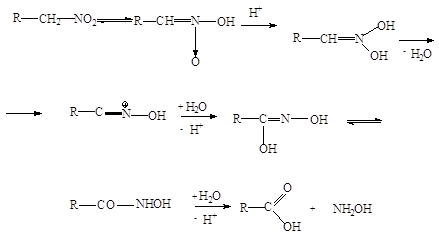
Нитропарафины используют в технике как растворители, для производства альдегидов, кислот, взрывчатых веществ, в реактивной технике, резиновой промышленности (вулканизаторы), при изготовлении пластмасс и др.
Ароматические нитросоединения
Получение ароматических нитросоединений
1. Нитросоединения с нитрогруппой в ядре получают нитрованием ароматических углеводородов смесью азотной и серной кислот (нитрующая смесь):
C6H6 + HONO2 ® C6H5NO2 + H2O
При нитровании бензола вторая нитрогруппа вступает в м-положение. Введение ее достигается применением более жестких условий нитрования - более высокая температура, концентрированные кислоты. Третья группа вводится с еще большим трудом в м-положение:
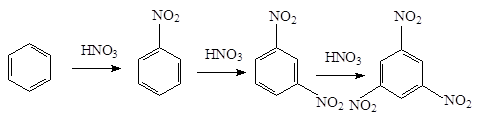
При наличии в ядре заместителей электронодонорных заместителей, удается ввести три нитрогруппы в обычных условиях. Так, толуол нитруется по следующей схеме:

При нитровании гомологов бензола, содержащих два заместителя, сказывается стерический эффект. Если эти заместители находятся в п-положении, то нитрогруппа становится рядом с меньшим заместителем:
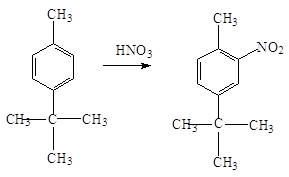
Скорость реакции нитрования зависит от субстрата и состава нитрующей смеси; для каждого соединения существует оптимальный состав. Так, при нитровании нитробензола оптимальный результат достигается при использовании 90%- ной серной кислоты. Снижение ее концентрации до 80% уменьшает скорость реакции в 3000 раз.
В настоящее время установлено, что в растворе азотной кислоты в серной имеет место равновесие:
2 H2SO4 + HNO3 « NO+2 + H3O+ + 2 HSO-4
Чистая азотная кислота в условиях нитрования диссоциирует по схеме:
2 HONO2 « NO+2 + NO-3 + H2O
Сам процесс нитрования с участием нитроний-катиона NO+2 представляет собой замещение водорода:
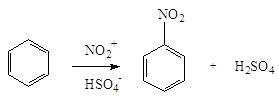
2. Нитросоединения с нитрогруппой в боковой цепи получают теми же методами, что и нитросоединения алифатического ряда:
1. Нитрование гомологов бензола разбавленной азотной кислотой (реакция Коновалова).
Ar-CH3 + HONO2 ® Ar-CH2NO2 + H2O
Реакция галогенпроизводных с галогеном в боковой цепи с нитритом серебра (реакция Мейра)
C6H5-CH2Cl + AgNO2 ® C6H5-CH2NO2 + AgCl
Химические свойства
Химические свойства нитросоединений ароматического ряда обусловлены присутствием в молекулах нитрогруппы и ароматического ядра и их взаимного влияния.
1. Восстановление.
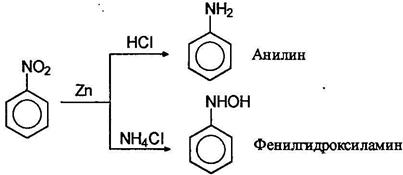
Впервые нитробензол был восстановлен в анилин с помощью сернистого аммония в 1842 г. Н.Н. Зининым. Это открытие сыграло важнейшую роль в развитии химической технологии, особенно в области химии красителей, медикаментов и фотохимикатов. Ароматические нитросоединения в зависимости от условий восстановления дают различные продукты. Ароматические амины являются конечными продуктами восстановления. Обычно их получают в кислой среде.
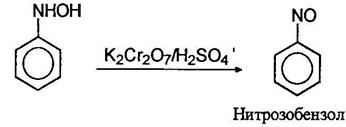
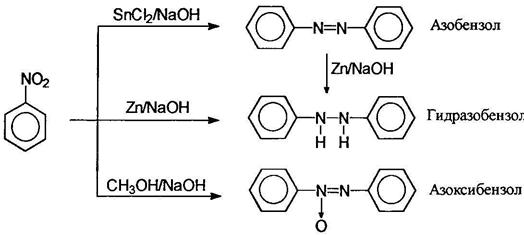
В нейтральной, щелочной и слабокислой средах можно получить различные промежуточные продукты восстановления. Ниже приведена схема восстановления нитросоединений:
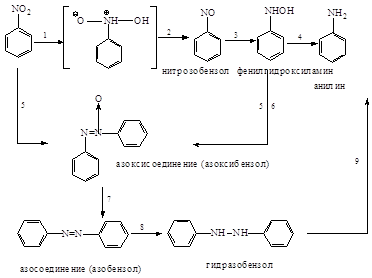
В нейтральной и кислой средах идут реакции 1-4, причем в кислой среде не удается выделить промежуточные продукты. В нейтральной среде можно выделить нитрозобензол и фенилгидроксиламин. В щелочной среде нитро- и нитрозобензолы конденсируются с фенилгидразином и идут реакции 5-9. Различные продукты восстановления можно получать, пользуясь методом электролитического восстановления. В зависимости от потенциала на электродах можно получать различные вещества.
2. Реакции замещения.
Нитрогруппа в реакциях электрофильного замещения направляет заместитель в мета-положение причем реакционная способность бензольного кольца уменьшается:
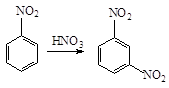
В реакциях нуклеофильного замещения нитрогруппа направляет заместители в орто- и пара-положения. Так, при нагревании нитробензола с порошкообразным KOH получается смесь о- и п-нитрофенолятов:
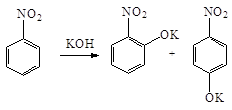
Благодаря сильно выраженному электроноакцепторному характеру нитрогруппа оказывает значительное влияние на атомы и группы, находящиеся по отношению к ней в о- и п-положениях. Так, в случае о- и п-нитрохлорбензолов галоген под влиянием нитрогруппы приобретает высокую подвижность, и легко замещается на гидроксил, алкоксил или аминогруппу:
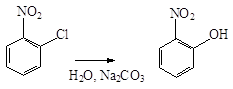
Похожие работы
... с гексаметилентетрамином мы получили 7-нитро-1,3,5-триазаадамантан: (10) Упр. 3. Напишите реакции формальдегида (а) с нитрометаном и (б) с нитроциклогексаном в щелочной среде. 1.2.3. Восстановление нитросоединений Нитрогруппу восстанавливают в аминогруппу различными восстановителями (11.3.3). Гидрированием нитробензола под давлением в присутствии никеля Ренея в промышленных условиях ...
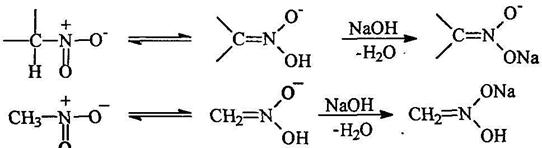
... быть получен нитрованием метана. Синтез нитросоединений из галогенуглеводородов Синтез нитрометана из хлоруксусной кислоты Нитрометан обычно получают из хлоруксусной кислоты по следующей схеме: Реакции нитросоединений Таутомерия алифатических нитросоединений Вследствие сильных электроноакцепторных свойств нитрогруппы а-атомы водорода обладают повышенной подвижностью и ...
... образом, чтобы не возникал избыток нитрозирующего агента. диазотирования – первая стадия синтеза азокрасителей, а также р-ций Зандмейера, Гомберга, Шимана, Гаттермана, Несмеянова, Барта, Меервейна. Диазотирование открыто П. Гриссом в 1858. Нитрование Введение нитрогруппы – NO2 в молекулы органических соединений. Может проходить по электрофильному, нуклеофильному и радикальному механизмам; ...
... менее выраженный основный характер, чем алифатические. Так, Кb метиламина составляет 4,4×10-5, тогда как для анилина Кb=3,8×10-10. Уменьшение основности анилина по сравнению с алифатическими аминами объясняется взаимодействием неподеленной пары электронов азота с электронами ароматического ядра - их сопряжением. Сопряжение уменьшает способность неподеленной электронной пары присоединять ...

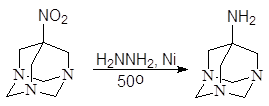
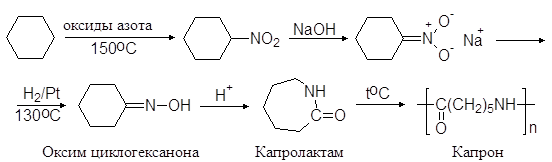

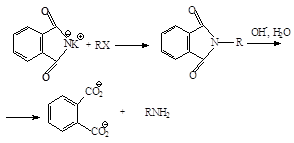
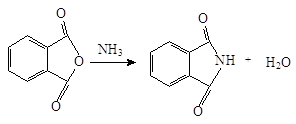
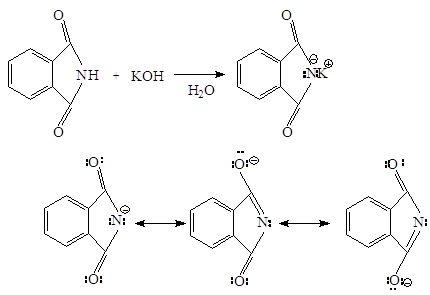
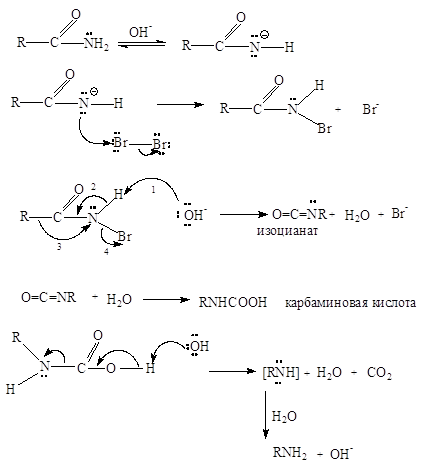
0 комментариев