Навигация
Алкилирование фенола олефинами
Федеральное агентство по образованию.
Государственное образовательное учреждение высшего профессионального образования.
Самарский государственный технический университет.
Кафедра: «Технология органического и нефтехимического синтеза»
Курсовой проект по дисциплине:
«Теория химических процессов органического синтеза»
Алкилирование фенола олефинами
Руководитель: доцент, к. х. н. Нестерова Т.Н.
Самара
2006 г.
1. Термодинамический анализ
При анализе процесса алкилирования фенола олефинами необходимо, прежде всего, определить какие вещества будут образовываться. В молекуле фенола существует два реакционных центра: ароматическое кольцо и гидроксильная группа. При взаимодействии алкена с ОН- группой образуются простые эфиры, которые легко могут перегруппировываться в алкилфенолы. Установлено, что алкилфенолы преимущественно образуются путем прямого алкилирования в ядро. Рассмотрим влияние гидроксильной группы в молекуле фенола на ароматическое кольцо. Заместитель характеризуется большим положительным эффектом сопряжения по сравнению с отрицательным индуктивным эффектом. Он сильно активирует орто- и пара- положения, поэтому 3-алкилфенолы будут находиться в продуктах в очень малых количествах. Процесс может пойти и дальше с образованием моно-, ди- и триалкилфенолов. Т.к. нас интересуют моно- замещенные фенолы то необходимо проводить процесс при небольшом избытке фенола.
Процесс идет через образование из алкена промежуточного карбкатиона, который является легко изомеризующейся и активной частицей. Возможно следующее: позиционная и структурная изомеризация, реакция крекинга, взаимодействие с ненасыщенными углеводородами, олигомеризация. Реакция изомеризации как правило опережает все прочие превращения, поэтому при алкилировании ![]() - олефинами получаем всевозможные изомеры. В условиях относительно нежестких протекают реакции только позиционной изомеризации.
- олефинами получаем всевозможные изомеры. В условиях относительно нежестких протекают реакции только позиционной изомеризации.
Учитывая выше сказанное, отберем вещества, которые вероятнее всего будут находиться в равновесной смеси:
(a)- 2-(2-гидроксифенил)тетрадекан; (b)- 3-(2-гидроксифенил)тетрадекан;
(c)- 4-(2-гидроксифенил)тетрадекан; (d)- 5-(2-гидроксифенил)тетрадекан;
(i)- 6-(2-гидроксифенил)тетрадекан; (f)- 7-(2-гидроксифенил)тетрадекан;
(g)- 2-(4-гидроксифенил)тетрадекан; (h)- 3-(4-гидроксифенил)тетрадекан;
(m)- 4-(4-гидроксифенил)тетрадекан; (n)- 5-(4-гидроксифенил)тетрадекан;
(o)- 6-(4-гидроксифенил)тетрадекан; (p)- 7-(4-гидроксифенил)тетрадекан.
Выберем (n-1) независимых реакций, где n-количество образовавшихся компонентов:
a![]() b; b
b; b![]() c; c
c; c![]() d; d
d; d![]() i; i
i; i![]() f; a
f; a![]() g; g
g; g![]() h; h
h; h![]() m;
m;
m![]() n; n
n; n![]() o; o
o; o![]() p;
p;
Запишем константы скоростей реакции:
Kxa=![]() ; Kxb=
; Kxb=![]() ; Kxc=
; Kxc=![]() ; Kxd=
; Kxd=![]() ; Kxi=
; Kxi=![]() ; Kxg=
; Kxg=![]() ; Kxh=
; Kxh=![]() ;
;
Kxm=![]() ; Kxn=
; Kxn=![]() ; Kxo=
; Kxo=![]() ; Kxp=
; Kxp=![]() .
.
Выразим концентрацию каждого компонента через константы реакций и концентрацию компонента g:
![]() =
=![]() ;
; ![]() =
=![]() ;
; ![]() =
=![]() ;
; ![]() =
=![]() ;
;
![]() =
=![]() ;
; ![]() =
=![]() ;
; ![]() =
=![]() ;
; ![]() =
=![]() ;
;
![]() =
=![]() ;
; ![]() =
=![]() ;
; ![]() =
=![]()
Для систем подчиняющихся закону Рауля можно записать для ![]() :
:
![]() =
=![]() =
=![]() =
=![]()
![]()
![]() =
=![]()
В свою очередь:
![]() =
=![]() -
- ![]()
![]()
![]() =
=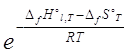
В термодинамическом анализе для расчета констант реакций необходимы точные данные энтальпии, энтропии, а если процесс идет в жидкой фазе, то критические параметры для расчета давления насыщенного пара, желательно, если это будут экспериментальные данные.
Энтальпии и энтропии. Метод Бенсона не даст в нашем случае точные значения. Для примера рассмотрим 2-(4-гидроксифенил)тетрадекан и 3-(4-гидроксифенил)тетрадекан. У этих веществ будут одинаковые вклады: Cb-(O)-1; Cb-(H)-4; Cb-(C)-1; O-(H,Cb)-1; CH-(2C,Cb)-1; CH2-(2C)-11; CH3-(C)-2. Поэтому ![]() =0 и
=0 и ![]() =0. Исключение составит реакция (a)
=0. Исключение составит реакция (a)![]() (g).
(g). ![]() =-9,9 кДж/моль за счет орто- взаимодействия в молекуле (a);
=-9,9 кДж/моль за счет орто- взаимодействия в молекуле (a); ![]() =-Rln2 кДж/(моль·K) за счет вращения ароматического ядра в молекуле (g).
=-Rln2 кДж/(моль·K) за счет вращения ароматического ядра в молекуле (g).
Давления насыщенного пара. Используя метод Лидерсена или Джобака можно рассчитать критические параметры, а потом и ![]() . Но вклады для всех веществ одинаковы, поэтому критические параметры равны, следовательно,
. Но вклады для всех веществ одинаковы, поэтому критические параметры равны, следовательно, ![]() равны, их можно не учитывать,
равны, их можно не учитывать, ![]()
![]() =
=![]() . Давление не оказывает влияние на реакцию. Применение разбавителя скажется отрицательно на скорости реакции.
. Давление не оказывает влияние на реакцию. Применение разбавителя скажется отрицательно на скорости реакции.
Зависимость константы скорости реакции от температуры.
| Kxa | Kxb | Kxc | Kxd | Kxi | Kxg | Kxh | Kxm | Kxn | Kxo | |
| 298 | 1 | 1 | 1 | 1 | 1 | 27,23829 | 1 | 1 | 1 | 1 |
| 350 | 1 | 1 | 1 | 1 | 1 | 15,03934 | 1 | 1 | 1 | 1 |
| 400 | 1 | 1 | 1 | 1 | 1 | 9,827575 | 1 | 1 | 1 | 1 |
| 450 | 1 | 1 | 1 | 1 | 1 | 7,058733 | 1 | 1 | 1 | 1 |
| 500 | 1 | 1 | 1 | 1 | 1 | 5,416903 | 1 | 1 | 1 | 1 |
| 600 | 1 | 1 | 1 | 1 | 1 | 3,641561 | 1 | 1 | 1 | 1 |
| 700 | 1 | 1 | 1 | 1 | 1 | 2,742201 | 1 | 1 | 1 | 1 |
| 800 | 1 | 1 | 1 | 1 | 1 | 2,216706 | 1 | 1 | 1 | 1 |
| 900 | 1 | 1 | 1 | 1 | 1 | 1,878661 | 1 | 1 | 1 | 1 |
| 1000 | 1 | 1 | 1 | 1 | 1 | 1,645737 | 1 | 1 | 1 | 1 |
Сумма мольных долей всех компонентов равна 0,95, т.к. реакцию проводим в избытке фенола.
Зависимость мольной доли компонентов от температуры.
| Т, К | N | a | b | c | d | i | f | g | h | m | n | o | p |
| 298 | 0,95 | 0,0056 | 0,0056 | 0,0056 | 0,0056 | 0,0056 | 0,0056 | 0,1527 | 0,1527 | 0,1527 | 0,1527 | 0,1527 | 0,1527 |
| 350 | 0,95 | 0,0099 | 0,0099 | 0,0099 | 0,0099 | 0,0099 | 0,0099 | 0,1485 | 0,1485 | 0,1485 | 0,1485 | 0,1485 | 0,1485 |
| 400 | 0,95 | 0,0146 | 0,0146 | 0,0146 | 0,0146 | 0,0146 | 0,0146 | 0,1437 | 0,1437 | 0,1437 | 0,1437 | 0,1437 | 0,1437 |
| 450 | 0,95 | 0,0196 | 0,0196 | 0,0196 | 0,0196 | 0,0196 | 0,0196 | 0,1387 | 0,1387 | 0,1387 | 0,1387 | 0,1387 | 0,1387 |
| 500 | 0,95 | 0,0247 | 0,0247 | 0,0247 | 0,0247 | 0,0247 | 0,0247 | 0,1337 | 0,1337 | 0,1337 | 0,1337 | 0,1337 | 0,1337 |
| 600 | 0,95 | 0,0341 | 0,0341 | 0,0341 | 0,0341 | 0,0341 | 0,0341 | 0,1242 | 0,1242 | 0,1242 | 0,1242 | 0,1242 | 0,1242 |
| 700 | 0,95 | 0,0423 | 0,0423 | 0,0423 | 0,0423 | 0,0423 | 0,0423 | 0,1160 | 0,1160 | 0,1160 | 0,1160 | 0,1160 | 0,1160 |
| 800 | 0,96 | 0,0497 | 0,0497 | 0,0497 | 0,0497 | 0,0497 | 0,0497 | 0,1103 | 0,1103 | 0,1103 | 0,1103 | 0,1103 | 0,1103 |
| 900 | 0,95 | 0,0550 | 0,0550 | 0,0550 | 0,0550 | 0,0550 | 0,0550 | 0,1033 | 0,1033 | 0,1033 | 0,1033 | 0,1033 | 0,1033 |
| 1000 | 0,95 | 0,0598 | 0,0598 | 0,0598 | 0,0598 | 0,0598 | 0,0598 | 0,0985 | 0,0985 | 0,0985 | 0,0985 | 0,0985 | 0,0985 |
Строим график зависимости «мольная доля – температура» для двух веществ (g) и (a), т.к. параалкилфенолы сольются в одну линию, тоже самое произойдет и с ортоалкилфенолами.
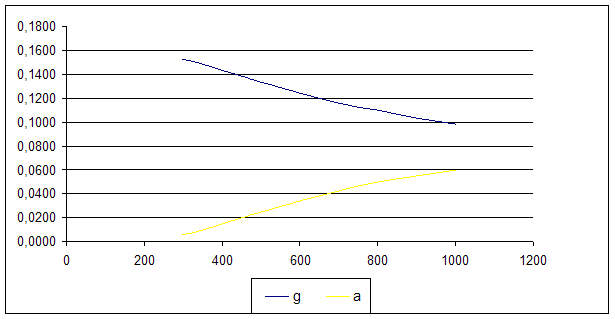
Из графика видно, что при увеличении температуры мольная доля параалкилфенолов уменьшается. Поэтому процесс следует вести при невысоких температурах.
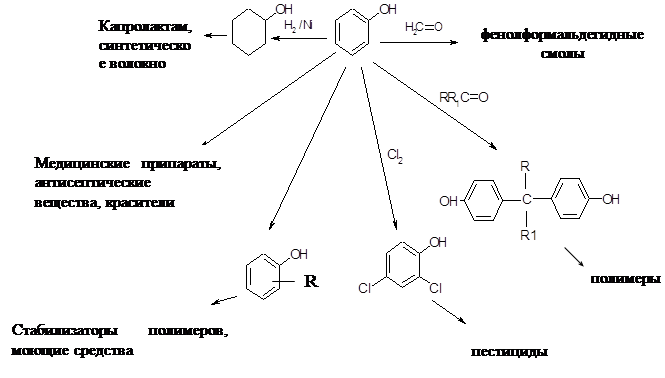
Как правило, параалкилфенолы используется как промежуточный продукт для синтеза неионогенных поверхностно-активных веществ путем их оксиэтилирования:
Чтобы получить продукты с лучшей биохимической разлагаемостью необходим алкил с менее разветвленной цепью.
Похожие работы
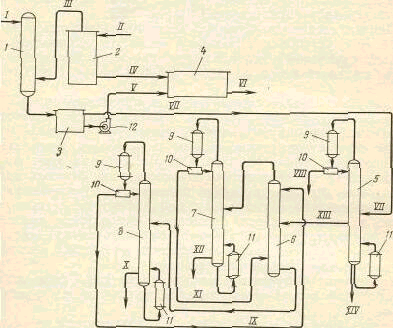
... условия проведения процесса. Технологические особенности процесса, из каких стадий он состоит. Приведите варианты аппаратурного оформления реакторного блока. Способы получения этилбензола: 1. Алкилирование бензола: а) алкилирование бензола этиленом на протонных кислотах (HF > H2SO4 (ж.ф. 10-400С, 0,1-1,0 МПа > H3PO4 г.ф. 200-4000С, 2-6 МПа); б) алкилирование бензола этиленом на ...
... и отработка методов превращения последних в крезолы. Классическим методом синтеза фенолов является щелочное плавление сульфокислот ароматических углеводородов Этот метод до сих пор используют для получения фенола и β- нафтола из бензола и нафталина соответственно. Oн, по-видимому, наиболее перспективен для производства п-крезола из толуола и в этом варианте реализован в ряде стран. ...
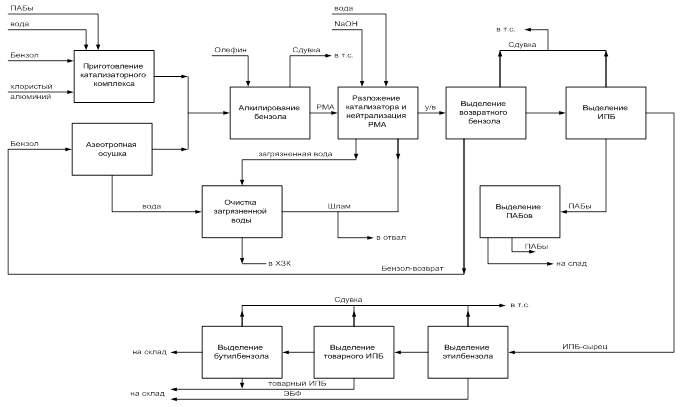
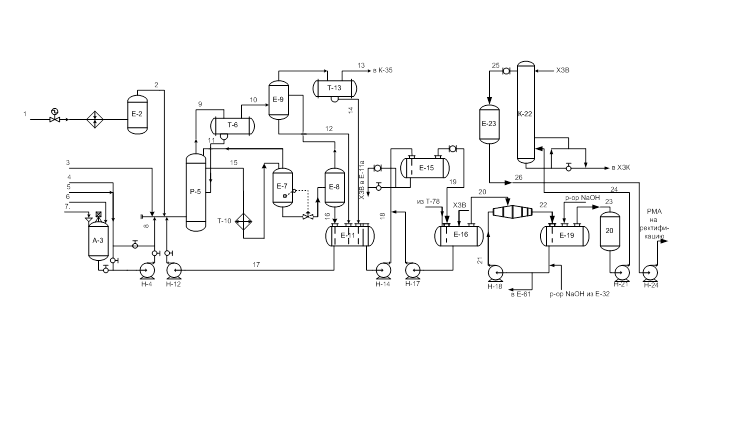
... фосфорнокислом катализаторе. В настоящее время только для получения фенола и ацетона производится свыше 7 млн. тонн в год изопропилбензола. Задачей выпускной работы является разработка и изучение процесса производства изопропилбензола на ОАО «Омский каучук». 1. АНАЛИТИЧЕСКИЙ ОБЗОР 1.1. Теоретические основы процесса алкилирования Алкилирование – это широкий класс реакций, в результате ...
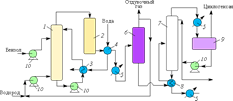
... в реакторе регулируется за счет испарения циклогексана. Гидрирование проводится при 200 °С и давлении 4 МПа (парциальное давление водорода ~0,3 МПа). Рис. 3. Технологическая схема процесса производства циклогексана: 1 — основной реактор гидрирования; 2 — вспомогательный реактор гидрирования; 3 — 5, 8 — теплообменники; 6 — сепаратор высокого давления; 7 — колонна стабилизации; 9 — сепаратор; ...


0 комментариев