Навигация
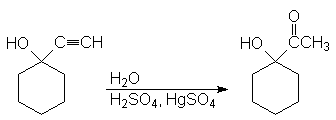
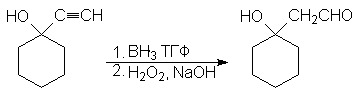
Присоединение магнийгалогенорганических соединений (реактив Гриньяра). Реакцию используют для получения спиртов
5. Присоединение магнийгалогенорганических соединений (реактив Гриньяра). Реакцию используют для получения спиртов.
6.Присоединение спиртов (безводных). При этом первоначально образуются полуацетали (как обычная реакция присоединения). Затем при нагревании с избытком спирта образуются ацетали (как простые эфиры).
![]()
![]()
![]()
![]()
![]() R – C = O + СН3 – ОН R – CН – О – СН3+СН3ОН
R – C = O + СН3 – ОН R – CН – О – СН3+СН3ОН![]() R – CН – О – СН3
R – CН – О – СН3
H ОН О – СН3
полуацеталь ацеталь
В природе очень много соединений полуацетального и ацетального характера, особенно среди углеводов (сахаров).
Реакции замещения
Кислород карбонильных групп может замещаться на галогены и некоторые азотсодержащие соединения.
1.Замещение галогенами. Происходит при действии на альдегиды и кетоны фосфорных соединений галогенов PCL3 и PCL5. При действии же свободными галогенами замещается водород в углеводородном радикале при α-углеродном атоме.
![]()
![]() + PCL5 CH3 – CH2 – CH –CL2 + POCL3
+ PCL5 CH3 – CH2 – CH –CL2 + POCL3
![]()
![]() СН3 – СН2 – С = О 1,1-дихлорпопин (фосфора хлорокись)
СН3 – СН2 – С = О 1,1-дихлорпопин (фосфора хлорокись)
![]()
![]() Н
+CL2 CH3 – CH – CH = O + HCL
Н
+CL2 CH3 – CH – CH = O + HCL
пропаналь CL
α-монохлорпропионовый альдегид
2.Реакция с гидроксиамином NH2OH. При этом образуются окислы альдегидов (альдоксилы) и кетонов (кетоксины).
![]() СН3 – СН = О + Н2N – OH CH3 – CH – N – OH + H2O
СН3 – СН = О + Н2N – OH CH3 – CH – N – OH + H2O
уксусный альдегид оксиэтаналь
Эту реакцию применяют для количественного определения карбоксильных соединений.
3.Реакция с гидразином NH2 – NH2 . Продуктами реакции являются гидразины (когда реагирует одна молекула альдегида или кетона) и азины (когда реагируют две молекулы).
![]() СН3 – СН = О + NH2 – NH2 СН3 – СН = N – NH2
СН3 – СН = О + NH2 – NH2 СН3 – СН = N – NH2
этаналь гидразин гидразин этаналь
![]() СН3 – СН = N – NH2 + О = СН – СН3 СН3 – СН =N – N = НС – СН3
СН3 – СН = N – NH2 + О = СН – СН3 СН3 – СН =N – N = НС – СН3
азин этаналь (альдазин)
4.Реакции с фенилгидразином. С6Н5 – NH – NH2 . Продуктами реакции являются фенилгидразины.
![]() СН3 – СН = О + Н2N – NH – C6H5 CH3 – CH = N – NH – C6H5
СН3 – СН = О + Н2N – NH – C6H5 CH3 – CH = N – NH – C6H5
Фенилгидразонэтаналь
Окислы, гидразины, азины, фенилгидразины – твердые кристаллические вещества с характерными температурами плавления, по которым определяют природу (строение) карбонильного соединения.
Реакции полимеризации
Характерны только для альдегидов. Но и то, только газообразные и летучие альдегиды (муравьиный, уксусный) подвергаются полимеризации. Это очень удобно при хранении этих альдегидов. муравьиный альдегид полимеризуется в присутствии серной кислоты или соляной, при нормальной температуре. Коэффициент полимеризации n=10-50. Продукт полимеризации – твердое вещество, называется – полиоксиметилен (формалин).
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() Н Н Н Н
Н Н Н Н
![]()
![]()
![]()
![]()
![]()
![]()
![]() Н – С = О – С – О – С – О – ...– С – … – С – О –
Н – С = О – С – О – С – О – ...– С – … – С – О –
![]()
![]() Н Н Н Н Н n
Н Н Н Н Н n
Полиоксиметилен
Это твердое вещество, но его можно превратить в муравьиный альдегид, разбавляя водой и слегка подогревая.
Уксусный альдегид под влиянием кислот образует жидкий циклический триммер- паральдозу и твердый тетрамер – метальдозу («сухой спирт»).

![]() 3 СН3 – СН = О О
3 СН3 – СН = О О
СН3 - НС СН – СН3
О О
СН – СН3
паральдегид
![]()
![]()
![]()
![]() 4 СН3 – СН = О СН3 – НС О
4 СН3 – СН = О СН3 – НС О
![]()
![]() О СН – СН3
О СН – СН3
![]()
![]() СН5 – НС О
СН5 – НС О
![]() О СН – СН3
О СН – СН3
Метальдегид
Реакции конденсации
1.Альдегиды в слабо основной среде (в присутствии ацетона калия, поташа, сульфата калия) подвергаются альдольной конденсации с образованием альдегидо - спиртов, сокращенно называемых альдолями. Разработана эта реакция химиком А.П. Бородиным (он же композитор). В реакции участвует одна молекула своей карбонильной группой, а другая молекула водородом при α- углеродном атоме.
![]()
![]() СН3 – СН = О + НСН2 – СН = О СН3 – СН – СН2 – СН = О
СН3 – СН = О + НСН2 – СН = О СН3 – СН – СН2 – СН = О
ОН альдоль
(3 – оксибутаналь или β-оксимасляный альдегид)
![]()
![]()
![]()
![]() СН3 – СН – СН2 – СН = О + НСН2 – СН = О СН3 – СН – СН2 – СН – СН2 –СН =О
СН3 – СН – СН2 – СН = О + НСН2 – СН = О СН3 – СН – СН2 – СН – СН2 –СН =О
ОН ОН ОН
гексенциол-3,5-аль
С каждым разом увеличивается число групп ОН. Получается альдегидная смола при уплотнении большого числа молекул.
2. Кротоновая конденсация . для альдегидов она является продолжением альдольной конденсации, то есть при нагревании альдоль отщепляет воду с образованием непредельного альдегида.
![]()
![]()
![]() СН3 – СН – СН2 – СН = О СН3 – СН = СН – С = О
СН3 – СН – СН2 – СН = О СН3 – СН = СН – С = О
ОН ОН
кротоновый альдегид
Рассмотрим эти реакции для кетонов.
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]()
![]() СН3 – С = О + НСН2 – С = О СН3 – С – СН2 – С = О СН3 – С = СН – С = О
СН3 – С = О + НСН2 – С = О СН3 – С – СН2 – С = О СН3 – С = СН – С = О
СН3 СН3 ОН СН3 СН3 СН3 СН3
4 – окси – 4 – метилпентанон-2 4 – метилпентан -3-он-2
3.Сложноэфирная конденсация. Характерна только для альдегидов. Разработана В.Е.Тищенко. протекает в присутствии катализаторов алкоголятов алюминия (CH3 – CH2 – O)3 AL.
![]()
![]() CH3 – CH = O + O = HC – CH3 CH3 – СН2 – О – С = О
CH3 – CH = O + O = HC – CH3 CH3 – СН2 – О – С = О
СН3
уксусноэтиловый эфир
Они содержат в углеводородном радикале двойную связь. Представители:
1.СН2 = СН – СН =О – пропен-2-аль - акриловый альдегид или акролеин
2.СН3 – СН = СН – СН = О – бутен – 2 – аль - кротоновый альдегид
Акролеин иначе называют чад, он получается при нагревании горении жиров. В химическом отношении непредельные альдегиды обладают всеми свойствами предельных по карбонильной группе, а за счет двойной связи в радикале могут вступать в реакции присоединения.
У этих альдегидов сопряженная система двойных связей, поэтому в химическом отношении они отличаются реакциями присоединения. Присоединение водорода, галогенов, галогенводородов происходит по концам сопряженной системы.
Электронная плотность смещена к кислороду и к нему направляются положительно заряженная часть реагента, а к положительно поляризованному углероду – отрицательная часть реагента.
![]()
![]()
![]()
![]() СН2+ = СН- – СН+= О- + Н+: Br- CH2 – CH = CH – OH CH2 – CH2 – CH = O
СН2+ = СН- – СН+= О- + Н+: Br- CH2 – CH = CH – OH CH2 – CH2 – CH = O
Br Br
3-бромпропаналь
Образующаяся при этом енольная форма альдегида немедленно превращается в более устойчивую карбонильную форму. Таким образом присоединение галогенводородов в радикал идет против правила Марковникова.
Ароматические альдегиды
Представители С6Н5 –СН = О – бензойный альдегид. Это жидкость с запахом горького миндаля, содержится в косточках слив, вишен, диких абрикос и других плодах.
Список использованной литературы
1) Гранберг И.И. Органическая химия. - М., 2002
2) Ким А.М. Органическая химия. - Новосибирск, 2007
Похожие работы
... ;¾® ОNa Если же взять два различных альдегида, то идет перекрестная реакция: Н КОН конц. О —С=О + С=О ¾¾¾® Н—С + —СН2ОН Н Н ОК Способы получения альдегидов и кетонов Окисление и дегидрирование спиртов Как уже было указано, соединения с карбонильной группой могут быть получены при окислении и дегидрировании спиртов. При ...
... в реакциях окисления. Ненасыщенные и ароматические углеводородные радикалы, подвергающиеся атаке электрофильными или нуклеофильными реагентами. Реакции окисления и восстановления Реакции окисления. По отношению к различным окислителям свойства альдегидов и кетонов сильно различаются. Большинство окислителей, включая воздух, легко окисляют альдегиды до кислот. Особенно легко ...
... сами по себе водородных связей не образуют. Низшие альдегиды и кетоны растворимы в воде, видимо, за счет образования водородных связей: Способы получения. Многие методы получения альдегидов и кетонов сходны, но существует и ряд особых способов, пригодных для синтеза только альдегидов или только кетонов. Окисление углеводородов. Простейший альдегид – формальдегид – можно получать ...
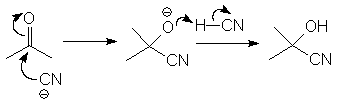
... заряда на атоме углерода. (М 3) так и основаниями. В этом случае катализатор отнимает протон от реагента, давая более сильный нуклеофил: (М 4) Присоединение углеродных нуклеофилов В результате взаимодействия альдегидов и кетонов с углеродными нуклеофила-ми образуются новые связи С¾С.Такими нуклеофилами служат реактивы Гри- ньяра, литийорганические соединения, ацетилениды и ...
0 комментариев