Навигация
Алюминий и основные его соединения
МИНИСТЕРСТВО ОБРАЗОВАНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
Государственное общеобразовательное учреждение
высшего профессионального образования
«Мичуринский государственный педагогический институт»
Факультет биологии
Кафедра химии
Студент 12 группы
Попов Дмитрий Иванович
Алюминий и основные его соединения
Реферат
Руководитель: Околелов О.С.
МИЧУРИНСК
2009
Оглавление
Введение
Глава I. Свойства алюминия
1.1. Получение
1.2. Химические свойства
1.3. Нахождение в природе и применение
Глава II. Основные соединения
2.1. Оксиды алюминия
2.2. Гидроксиды алюминия
2.3. Алюминаты. Алюминатные растворы
Заключение
Список литературы
Введение
Алюминий был открыт Х. Эрстедом в 1825 году. Этот элемент относится к p-элементам главной подгруппы III группы Периодической системы химических элементов Д.И. Менделеева.
Радиус атома равен 0,143 нм. Запишем это. Почти во всех соединениях алюминий трёхвалентен и имеет окисление +3. Это тоже запишите.
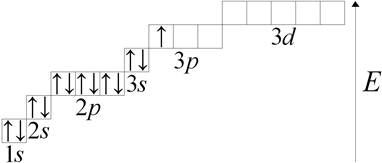
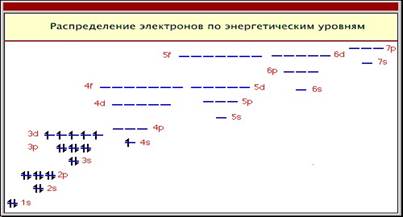
Рассмотрим строение атома алюминия:
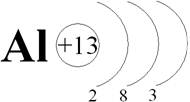
1s22s22p63s23p13d0
В простом виде алюминий – металл серебристо-белого цвета. Он относится к лёгким и легкоплавким, обладает большой электрической проводимостью и теплопроводимостью. На воздухе изделия из алюминия покрываются тонкой оксидной плёнкой. Температура плавления у этого металла 659°С, а плотность 2,7 г/см3.
Алюминий один из самых активных металлов, т.е. он является сильным восстановителем.
Глава I. Свойства алюминия
1.1. Получение
Впервые этот металл получили восстановлением его хлорида металлическим калием или натрием без доступа воздуха:
AlCl3 + 3Na = Al + 3NaCl.
В промышленности алюминий получают электролизом раствора глинозёма (техн. Al2O3) в расплаве криолита Na3AlF6 с добавкой CaF2. Криолит используется как растворитель оксида алюминия, а добавка фторида кальция позволяет поддерживать температуру плавления в электролитической ванне не выше 1000°С.
1.2. Химические свойства
1. Алюминий легко окисляется кислородом воздуха, покрываясь прочной защитной плёнкой оксида алюминия Al2O3. Подобная реакция протекает при горении раскалённого алюминия в чистом кислороде:
4Al + 3O2![]() 2Al2O3.
2Al2O3.
Данную реакцию мы можем наблюдать при горении бенгальских огней.
2. Если плёнку оксида алюминия разрушить, то этот металл будет активно взаимодействовать с водой при обычной температуре:
2Al + 6H2O = 2Al(OH)2 + H2↑.
3. Лишённый оксидной плёнки алюминий легко растворяется в щелочах с образованием алюминатов:
2Al + 2NaOH + 2H2O = 2NaAlO2 + 3H2↑.
4. Лишённый оксидной плёнки алюминий легко растворяется в разбавленных кислотах с выделением водорода:
2Al + 6HCl (разб.) = 2AlCl3 + 3H2↑,
2Al + 3H2SO4 (разб.) = Al2(SO4)3 + 3H2↑.
5. Сильно разбавленная и концентрированная азотная кислота пассивирует алюминий, поэтому для хранения и перевозки азотной кислоты используются алюминиевые ёмкости. Но при нагревании алюминий растворяется в азотной кислоте:
Al + 6HNO3 (конц.) = Al(NO3)3 + 3NO2↑ + 3H2O.
6. Алюминий взаимодействует с галогенами:
2Al + 3Br2![]() 2AlBr3.
2AlBr3.
7. При высоких температурах алюминий взаимодействует с другими неметаллами (серой, азотом, углеродом):
2Al + 3S ![]() Al2S3 (сульфид алюминия),
Al2S3 (сульфид алюминия),
2Al + N2![]() 2AlN (нитрид алюминия),
2AlN (нитрид алюминия),
4Al + 3C ![]() Al4C3 (карбид алюминия).
Al4C3 (карбид алюминия).
Реакции протекают с выделением большого количества тепла.
8. Для алюминия характерны реакции алюминотермии – восстановления металлов из их оксидов алюминием.
Алюминотермия используется для получения редких металлов, образующих прочную связь с кислородом: ниобия Nb, тантала Та, молибдена Мо, вольфрама W и др.
2Al + 3WO3![]() 3W + Al2O3.
3W + Al2O3.
Смесь мелкого порошка Al и магнитного железняка Fe3O4 называется термитом, при поджоге которого выделяется большое количество тепла, и температура смеси повышается до 3500°С. Этот процесс используется при термитной сварке:
8Al + 3Fe3O4![]() 9Fe + 4Al2O3.
9Fe + 4Al2O3.
Похожие работы
... были обнаружены в парах. Известен ряд двойных карбидов галлия различного состава с марганцем, железом, платиной, ниобием, хромом и некоторыми другими металлами. Соединения галлия с кремнием и бором не получены. 6. ОСОБЫЕ СВОЙСТВА ЭЛЕМЕНТА И ЕГО СОЕДИНЕНИЙ, ИХ ПРИМЕНЕНИЕ. Не стоит брать этот элемент в руки - тепла человеческого тела достаточно, чтобы этот серебристый мягкий (его можно резать ...
... определение NH+4 без предварительной отгонки аммиака. В частности, было показано, что определение без предварительной отгонки вполне применимо при анализе сточных вод, содержащих наряду с аммиаком ряд органических соединений, в состав которых входит азот (меламин, дицианамид, карбамид, циануровая кислота). Мешают сильно сероводород и сульфиды. Их можно удалить, подкислив пробу до pH=3 и ...
... в процессе его производства. Первая стадия производства титана заключается в рудно-восстановительной плавке, которая проводится с целью обогащения исходного материала окисными соединениями титана. Во всех последующих стадиях производства взаимодействие титана и его соединений с кислородом нежелательно. Титан растворяет такие элементы, как азот, водород и углерод. С последним он образует стойкие ...
... разделам школьной программе по химии, тем более, что в учебнике этот материал, по-моему, незаслуженно отсутствует. Данная работа посвящена изучению основных физических и химических свойств хрома и его соединений, позволяет оценить важность этого химического элемента. 1.Исторические сведения В 1766 году петербургский профессор химии И.Г.Леман описал новый минерал, найденный на Урале на ...
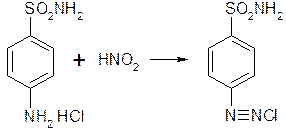
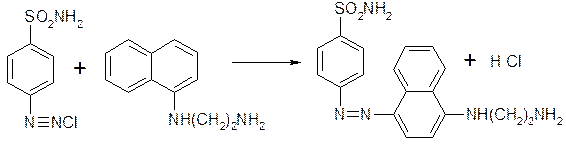
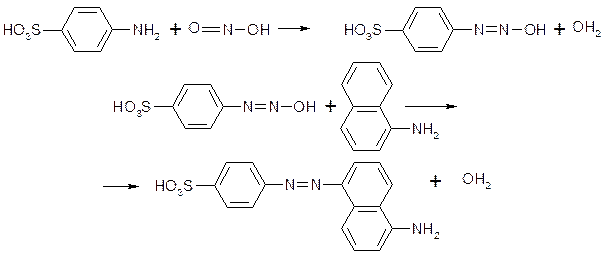
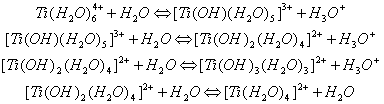
0 комментариев