Навигация
Свойства титана и его соединений
Министерство Образования и Науки РФ
Министерство по Атомной Энергетике РФ
Северская Государственная Технологическая Академия
Кафедра ХиТМСЭ
Свойства титана и его соединений
Северск – 2005
Введение
Титан находится в побочной подгруппе четвертой группы, следовательно относится к переходным элементам. Переходные элементы обладают определенными схожими свойствами.
Общая характеристика переходных элементов. Особенности переходных элементов определяются, прежде всего, электронным строением их атомов, во внешнем электронном слое которых содержаться, как правило, два s-электрона (иногда один; исключение составляет палладий: в его невозбужденном атоме нет 6s-электронов). Невысокие значения энергии ионизации этих атомов указывают на сравнительно слабую связь внешних электронов с ядром; так, для ванадия, хрома, марганца, железа, кобальта энергии ионизации составляют соответственно 6,74; 6,76; 7,43; 7,90 и 7,86 эВ. Именно поэтому переходные элементы в образуемых ими соединениях имеют положительную окисленность и выступают в качестве характерных металлов, проявляя тем самым сходство с металлами главных подгрупп.
Однако между металлами главных и побочных подгрупп есть и существенные различия. Они также связаны с особенностями электронного строения переходных элементов, а именно с тем, что во втором снаружи электронном слое их атомов имеется не полностью занятый электронами d-подуровень. Для образования химических связей атомы переходных элементов могут использовать не только внешний электронный слой (как это имеет место у элементов главных групп), но также d-электроны и свободные d-орбитали предшествующего слоя. Поэтому для переходных элементов значительно более характерна переменная валентность, чем для металлов главных подгрупп. Возможность создания химических связей с участием d-электронов и свободных d-орбиталей обусловливает и ярко выраженную способность переходных элементов к образованию устойчивых комплексных соединений. С этим же связана характерная окраска многих соединений переходных элементов, тогда как соединения металлов главных подгрупп в большинстве случаев бесцветны.
Почти все элементы главных подгрупп IV-VII групп периодической системы представляют собой неметаллы, в то время как элементы побочных подгрупп – металлы. Поэтому в правой части периодической системы различия в свойствах элементов главных и побочных подгрупп проявляются особенно резко. Однако в тех случаях, когда элементы главной и побочной подгруппы находятся в высшей степени окисленности, их аналогичные соединения проявляют существенное сходство. Так, хром, расположенный в побочной подгруппе VI группы, образует кислотный оксид Cr2O3, близкий по свойствам к триоксиду серы SO3. Оба эти вещества в обычных условиях находятся в твердом состоянии и образуют при взаимодействии с водой кислоты состава H2ЭО4. Точно также оксиды марганца и хлора, соответствующие высшей степени окисленности этих элементов, - Mn2O7 и Cl2O7 – обладают сходными свойствами и представляют собой ангидриды сильных кислот, отвечающих общей формуле HЭО4.
Подобная близость Свойств объясняется тем, что в высшей степени окисленности атомы элементов лавных и побочных подгрупп приобретают сходное электронное строение. Например, атом хрома имеет электронную структуру 1s22s22p63s23p63d54s1. Когда хром находится в степени окисленности +6 (например, в оксиде CrО3), шесть электронов его атома (пять 3d- и один 4s-электрон) вместе с валентными электронами соседних атомов (в случае CrО3 – атомов кислорода) образуют общие электронные пары, осуществляющие химические связи. Остальные электроны, непосредственно не участвующие в образовании связей, имеют конфигурацию 1s22s22p63s23p6, отвечающую электронной структуре благородного газа. Аналогично у атома серы, находящегося в степени окисленности +6 (например, в триоксиде серы SO3), шесть электронов участвуют в образовании ковалентных связей, а конфигурация остальных (1s22s22p6) также соответствует электронной структуре благородного газа.
Мы знаем, что в пределах одного периода у элементов главных подгрупп, т.е. у s- и p-элементов, с возрастанием их порядкового номера число электронов во внешнем электронном слое атомов возрастает, что приводит к довольно быстрому переходу от типичных металлов к типичным неметаллам. У переходных элементов возрастание порядкового номера не сопровождается существенным изменением структуры внешнего электронного слоя; поэтому химические свойства этих элементов изменяются в периоде хотя и закономерно, но гораздо менее резко, чем у элементов главных подгрупп.
В пределах одной декады переходных элементов (например, от скандия до цинка) максимальная устойчивая степень окисленности элементов сначала возрастает (благодаря увеличению числа d-электронов, способных участвовать в образовании химических связей), а затем убывает (вследствие усиления взаимодействия d-электронов с ядром по мере увеличения его заряда). Так, максимальная степень окисленности скандия, титана, ванадия, хрома и марганца совпадает с номером группы, тогда как для железа она равна шести, для кобальта, никеля и меди – трем, а для цинка – двум. В соответствии с этим изменяется и устойчивость соединений, отвечающих определенной степени окисленности элемента. Например, оксиды TiO2 и VO, содержащие титан и ванадий в степени окисленности +2, - сильные восстановители, а аналогичные оксиды меди и цинка (CuO и ZnO) восстановительных свойств не проявляют.
В главных подгруппах устойчивость соединений, в которых элемент проявляет высшую степень окисленности, с увеличением порядкового номера элемента, как правило, уменьшается. Так, соединения, в которых степень окисленности углерода или кремния равна +4, вполне устойчивы, тогда как аналогичные соединения свинца (например, PbO2) мало устойчивы и легко восстанавливаются. В побочных подгруппах проявляется обратная закономерность: с возрастанием порядкового номера элемента устойчивость высших окислительных состояний повышается. Так, соединения хрома (VI) – сильные окислители, а для молибдена(VI) и вольфрама(VI) окислительные свойства нехарактерны.
В пределах каждой побочной подгруппы отмечается значительное сходство в свойствах элементов пятого и шестого периодов. Это связано с явлением лантаноидного сжатия.[1,c.646]
Похожие работы
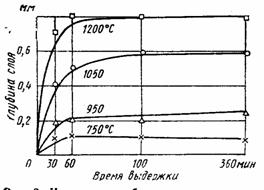
... при больших значениях пленки получаются несплошные, легко отделяющиеся от поверхности металла (железная окалина) в результате возникающих внутренних напряжений. Поведение титана и его сплавов в различных агрессивных средах Реакции титана со многими элементами происходят только при высоких температурах. При обычных температурах химическая активность титана чрезвычайно мала и он практически ...
... были обнаружены в парах. Известен ряд двойных карбидов галлия различного состава с марганцем, железом, платиной, ниобием, хромом и некоторыми другими металлами. Соединения галлия с кремнием и бором не получены. 6. ОСОБЫЕ СВОЙСТВА ЭЛЕМЕНТА И ЕГО СОЕДИНЕНИЙ, ИХ ПРИМЕНЕНИЕ. Не стоит брать этот элемент в руки - тепла человеческого тела достаточно, чтобы этот серебристый мягкий (его можно резать ...
... и азота образуются нитриды железа состава Fe2N и Fe4N (N2+6Fe=Fe2N+Fe4N). При нагревании азота с ацетиленом C2H2 может быть получен цианистый водород HCN (N2+C2H2=2HCN). Из сложных неорганических соединений азота наибольшее значение имеют азотная кислота HNO3, ее соли нитраты, а также азотистая кислота HNO2 и ее соли нитриты. Получение В промышленности азот получают из воздуха. Для этого воздух ...
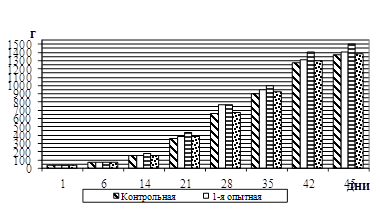
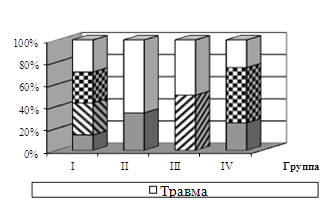
... выше сохранность поголовья на 4,6%, прирост живой массы на 7,0%, ниже затраты корма и себестоимость 1 кг прироста. Выводы На основании проведенных исследований по изучению влияния разных дозировок комплексоната титана на продуктивность цыплят-бройлеров можно сделать следующие выводы: Оптимальной дозой кормовой добавки комплексоната титана в рационе цыплят-бройлеров является 0,1 мг/кг живой ...
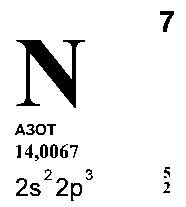
0 комментариев