Навигация
Амины
По систематической номенклатуре амины называют путем добавления приставки амин к названию углеводорода. По рациоальной номенклатуре их рассматривают как алкил или ариламины.
![]()
![]()
![]()
![]()
Метанамин Этанамин N-Метилэтанамин N-Этилэтанамин
(метиламин) (этиламин) (метилэтиламин) (диэтиламин)
![]()
![]()
![]()
N,N-Диэтилэтанамин 2-Аминоэтанол 3-Аминопропановая
триэтиламин) (этаноламин) кислота



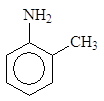
Циклогексанамин Бензоламин N-Метилбензоламин 2-Метилбензоламин
(циклогексиламин) (анилин) (N-метиланилин) (о-толуидин)
Гетероциклические амиы называют по соответствующему углеводороду вставляя приставку аза-, диаза- или триаза- для обозачения количества атомов азота.
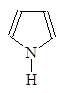
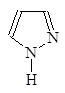
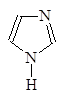
1-Азациклопета- 1,2-Диазациклопета- 1,3-Диазациклопета-
2,4-диен 2,4-диен 2,4-диен
1. Основность аминов
Аммиак и амины благодаря наличию на их атомах азота неподеленной пары электронов обладают нуклеофильными свойствами, т.е. предоставляют эту пару обедненному электронами атому углерода. Они способны предоставлять ее и протону, т.е. обладать основностью.
Основные свойства аминов (Kb = 10-4) обусловлены способностью свободных (неподеленных) электронов атомов азота присоединять протон. Подобно аммиаку амины при действии минеральных кислот превращаются в соли:
![]() (22)
(22)
Метиламмонийхлорид
Основность аминов тем выше, чем больше электронная плотность на атоме азота (чем выше электронодонорный характер атома азота).
Все простейшие алифатические амины, взаимодействуя с водой, генерируют гидроксид-анион и, следовательно, окрашивают лакмус в синий цвет:
![]()
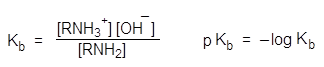
Сравнивать основность аминов можно и по значениям pKa сопряженных им кислот – аммониевых ионов.
![]()
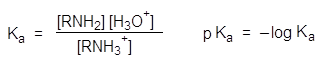
pKa + pKb = 14
Чем выше основность амина, тем сильнее он удерживает протон в аммониевом катионе RNH3+ и наоборот.
Алифатические амины - более сильные основания, чем аммиак, поскольку алкильные группы обладают +I-эффектом.
Нуклеофильность и основность аминов изменяются, как правило, симбатно: они уменьшаются с уменьшением электроннной плотности на атоме азота или при его пространственном экранировании и увеличиваются с увеличением электронной плотности на атоме азота или с увеличением его доступности. В качестве примера можно привести основность метиламинов. По силе основности они располагаются в следующий ряд:
(СH3)2NH > СH3NH2 > (СH3)3N >> NH3 ![]()
![]()
![]()
pKb 3,28 3,36 4,30 4,74 9,42 13,00 13,20
pKa 10,72 10,64 9,70 9,26 4,58 1,00 0,80
Влияние пространственного фактора на основность и на нуклеофильность аминов наглядно демонстрируется сравнением свойств некоторых вторичных аминов.
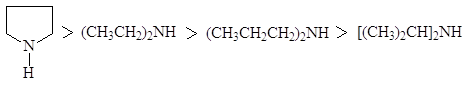
Анилин и другие ароматические амины являются слабыми основаниями.
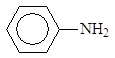
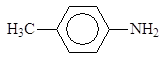
рKb 3,36 9,42 8,92
Это может быть объяснено делокализацией неподеленных электронов:
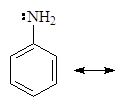
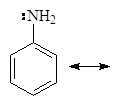
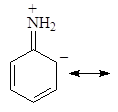
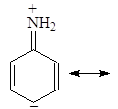
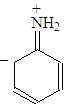
Делокализация электронной пары делает ее с одной стороны менее доступной для протона, а с другой стороны, что еще важнее, она стабилизирует молекулу. У протонированного анилина имеется лишь две граничные структуры:
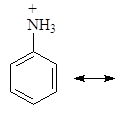
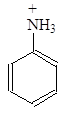
В отличие от алифатических аминов ароматические амины водные растворы лакмуса в синий цвет не окрашивают, т.е. не генерируют гидроксид-анион при взаимодействии с водой. Анилин не образует солей с такими слабыми кислотами, как угольная, синильная, сероводород и др. Гидрохлорид анилина гидролизуется в воде, а сульфат анилина в воде не растворим.
Амиды являются гораздо более слабыми основаниями, чем даже ароматические амины (рKb = 14). У амидов неподеленная пара электронов азота также делокализована:
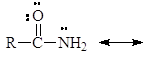
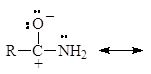
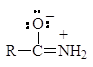
У протонированного амида имеется лишь две граничные структуры:
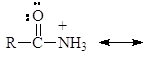
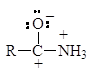
Однако, наиболее важным фактором, обусловливающим меньшую основность амидов, чем аминов, является электроноакцепторный эффект их карбонильной группы, смещающий ниже следующее равновесие влево
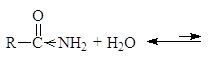
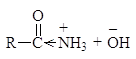 (23)
(23)
Атом азота в амидах настолько слабо основен, что их протонизация проходит по атому кислорода несмотря на его большую электроотрицательность, чем азот. Протонизированный по кислороду амид стабилизируется за счет резонанса:
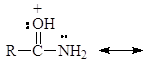
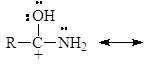
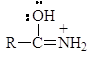
Если в соединении атом азота заряжен положительно, но не связан с протоном, то такие соединения называют четвертичными аммониевыми солями. Например:
![]()
Тетрабутиламмонийбромид
Четвертичные аммониевые гидроксиды являются такими же сильными основаниями как и гидроксиды натрия и калия.
![]()
![]() (24)
(24)
Почти все алкиламмонийхлориды, бромиды, йодиды и сульфаты растворимы в воде. Растворимость аминов в водных раcтворах кислот позволяет легко отделить их от неосновных и нерастворимых в воде соединений.
Поскольку амиды неосновны, нерастворимые в воде амиды не растворяются и в водных растворах кислот.
Четвертичную аммонийную группу содержат такие важные вещества как холин и ацетилхолин. Ацетилхолин участвует в передаче импульса между нервами и мускулами. При переходе ацетилхолина от нерва к мускулу последний сокращается. Для того чтобы мускул сократился еще раз ацетилхолин должен быть удален. Это осуществляется с помощью энзима холинэстераза, гидролизующего ацетилхолин до холина и уксусной кислоты:
![]()
![]()
![]() (25)
(25)
ацетилхолин холин
Ацетилхолин фиксируется на энзиме группой . Другие соединения, содержащие такую же группу ингибируют холинэстеразу. Например, для расслабления мышц в хирургии используют бромиды декаметония и сукцинилхолина
![]()
![]()
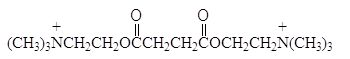
![]()
Упр.6. Расположите в порядке уменьшения основности в воде следующие амины: метиламин, диметиламин, триметиламин, анилин, дифениламин, трифениламин. Ответ обоснуйте.
Упр.7. Предложите схему разделения смеси, состоящей из бензойной кислоты, фенола, анилина и бензола используя кислоты, основания и органические растворители.
2. Методы получения
2.1. Восстановление нитросоединений
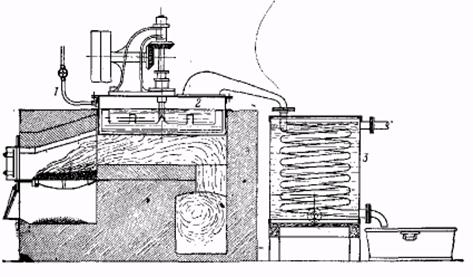
Восстановление ароматических нитросоединений (1.2.3) в сочетании с нитрованием аренов является главным способом получения аминов.
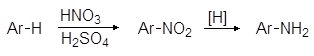
Похожие работы
... метильную группу в р-положении к аминогруппе, эта метальная группа отщепляется и образуются р-хиноны; из мезидина образуется 2,6-диметил-р-бензохинон, из псевдокумидина получается р-ксилохинон. Методы синтеза дифениламина Синтез на основе анилина и анилиновой соли 93 г анилина и 93г солянокислого анилина (анилиновой соли) нагревают в течение 20 час. при 230° в эмалированном автоклаве ...
... менее выраженный основный характер, чем алифатические. Так, Кb метиламина составляет 4,4×10-5, тогда как для анилина Кb=3,8×10-10. Уменьшение основности анилина по сравнению с алифатическими аминами объясняется взаимодействием неподеленной пары электронов азота с электронами ароматического ядра - их сопряжением. Сопряжение уменьшает способность неподеленной электронной пары присоединять ...
ения количества атомов азота. 1-Азациклопета- 1,2-Диазациклопета- 1,3-Диазациклопета- 2,4-диен 2,4-диен 2,4-диен 2. Реакции аминов 2.1. Алкилирование алкилгалогенидами (реакция Меншуткина) Амины бурно реагируют с алкилгалогенидами, образуя смеси аминов и солей четвертичных аммониевых оснований: Соли четвертичных аммониевых оснований переводят в щелочной среде в сами основания. ...
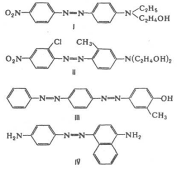
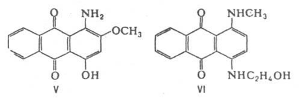
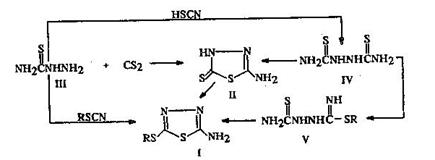
... (I) [11]. Нами установлено, что алкил (аралкил) тиоционаты в среде полифосфорной кислоты при 90–100°С реагируют с тиосемикарбазидом (III) с образованием производных аминотиадиазолов (I). 2.3 Красители на основе 2-амино-5-меркапто – 1,3,4-тиадиазолов Некоторые новые гетероциклические моноазокрасители, синтезированные на основе 2-амино-5-меркапто – 1,3,4-тиадиазола с различными N- ...
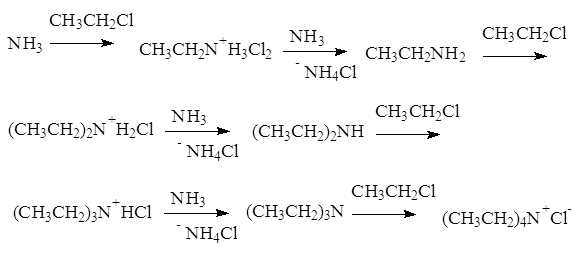



0 комментариев