Навигация
Вирішення задач по аналітичній хімії
№ 1
В задачі потрібно знайти масу KOH, необхідну для приготування 1,0 л 20% розчину КОН густиною 1,19 г/мл, як також розрахувати молярну та нормальну концентрації розчину
Молярна маса
М(КОН) = 39 + 16 + 1 = 56 г/моль;
еквівалент рівний 1 моль; еквівалентна маса Е(КOH) = 56 г/моль-екв.
Маса 1 л розчину 1,19∙1000 = 1190 г.
20%-на концентрація означає, що у 100 г розчину має знаходитись 20 г КОН, а у 1190 г розчину (в 1 л) буде
Маса(КОН) = ![]()
Кількість молей КОН в 1 л розчину
![]() Тому,
Тому,
СМ = 4,25 М.
Кількість моль-екв. КОН в 1 л розчину
![]() моль-екв. Отже,
моль-екв. Отже,
СН = 4,25 н.
№ 2
В задачі потрібно знайти об’єм 0,2 М розчину H2SO4 густиною 1,09 г/мл за умови розчинення маси 98,0 г H2SO4, як також розрахувати процентну та нормальну концентрації розчину
Молярна маса M(H2SO4) = 2 + 32 + 16∙4 = 98 г/моль; еквівалент рівний ![]() моль; еквівалентна маса
моль; еквівалентна маса
![]() г/моль-екв.
г/моль-екв.
Маса 1 л розчину 1,09∙1000 = 1090 г.
В 1 л розчину має бути m = 0,2∙98 = 19,6 г H2SO4, а в невідомому об’ємі Vрозч її буде 98,0 г. Звідси
![]()
Якщо у 1090 г розчину маємо 19,6 г H2SO4, то у 100 г буде ![]() Тому, С% = 1,80 %.
Тому, С% = 1,80 %.
Кількість моль-екв. H2SO4 в 1 л розчину ![]() моль-екв. Отже, СН = 0,4 н.
моль-екв. Отже, СН = 0,4 н.
№ 3
В задачі потрібно знайти масу HCl, необхідну для приготування 0,5 л 0,1 н розчину HCl густиною 1,02 г/мл, як також розрахувати процентну та молярну концентрації розчину
Молярна маса М(HCl) = 35,5 + 1 = 36,5 г/моль; еквівалент рівний 1 моль; екві-валентна маса Е(НCl) = 36,5 г/моль-екв.
Маса 1 л розчину 1,02∙1000 = 1020 г.
В 1 л розчину має знаходитись m = 0,1∙36,5 = 3,65 г HCl, а у 0,5 л буде
Маса(HCl) = 3,65∙0,5 = 1,825 г.
Якщо у 1020 г розчину маємо 3,65 г HCl, то у 100 г буде ![]() Тому, С% = 0,36 %.
Тому, С% = 0,36 %.
Кількість молей HCl в 1 л розчину ![]() Отже, СМ = 0,1 М.
Отже, СМ = 0,1 М.
№ 4
В задачі потрібно знайти масу NaOH, необхідну для приготування 2,0 л 0,5 н розчину NaOH густиною 1,06 г/мл, як також розрахувати процентну та молярну концентрації розчину
Молярна маса
M(NaOH) = 23 + 16 + 1 = 40 г/моль;
еквівалент рівний 1 моль; еквівалентна маса E(NaOH) = 40 г/моль-екв.
Маса 1 л розчину 1,06∙1000 = 1060 г.
В 1 л розчину має знаходитись
m = 0,5∙40 = 20 г NaOH, а у 2,0 л буде
Маса(NaOH) = 2∙20 = 40 г.
Якщо у 1060 г розчину маємо 20 г NaOH, то у 100 г буде ![]() Тому, С% = 1,89 %.
Тому, С% = 1,89 %.
Кількість молей NaOH в 1 л розчину ![]() Отже,
Отже,
СМ = 0,5 М.
№ 5
В задачі потрібно знайти масу H2SO4, необхідну для приготування 2,5 л 2,0 н розчину H2SO4 густиною 1,04 г/мл, як також розрахувати процентну та молярну концентрації розчину
Молярна маса M(H2SO4) = 2 + 32 + 16∙4 = 98 г/моль; еквівалент рівний ![]() моль; еквівалентна маса
моль; еквівалентна маса ![]() г/моль-екв.
г/моль-екв.
Маса 1 л розчину 1,04∙1000 = 1040 г.
В 1 л розчину має знаходитись m = 2∙49 = 98 г H2SO4, а у 2,5 л буде
Маса(H2SO4) = 98 ∙ 2,5 = 245 г.
Якщо у 1040 г розчину маємо 98 г H2SO4, то у 100 г буде ![]() Тому, С% = 9,42 %.
Тому, С% = 9,42 %.
Кількість молей H2SO4 в 1 л розчину ![]() Отже,
Отже,
СМ = 1,0 М.
№ 6
В задачі потрібно знайти об’єм 10%-го розчину NH3 густиною 0,96 г/мл за умови розчинення маси 28,8 г аміаку, як також розрахувати молярну та нормальну концентрації розчину
Молярна маса M(NH3) = 14 + 3 = 17 г/моль; еквівалент рівний ![]() моль; еквівалентна маса
моль; еквівалентна маса
![]() г/моль-екв.
г/моль-екв.
10%-на концентрація означає, що у 100 г розчину має знаходитись 10 г NH3. А 28,8 г аміаку мають бути у ![]() розчину.
розчину.
Якщо об’єм розчину 1л має масу 0,96∙1000 = 960 г, то невідомий об’єм розчину Vрозч має масу 288 г. Звідси ![]()
Якщо в 0,3 л розчину знаходиться 28,8 г аміаку, то в 1 л розчину буде ![]() NН3. Кількість молей аміаку в 1 л розчину Тому,
NН3. Кількість молей аміаку в 1 л розчину Тому,
![]()
СМ = 5,647 М.
Кількість моль-екв. аміаку в 1л розчину
![]() моль-екв.
моль-екв.
Отже,
СН = 16,941 н.
№ 7
Знайти масу КОН, необхідну для приготування 4,0 л 0,5 М розчину КОН густиною 1,03 г/мл. Розрахувати процентну та нормальну концентрації розчину
Молярна маса
М(КОН) = 39 + 16 + 1 = 56 г/моль;
еквівалент рівний 1 моль; еквівалентна маса
Е(КОН) = 56 г/моль-екв.
Маса 1 л розчину 1,03∙1000 = 1030 г.
В 1 л розчину має знаходитись m = 0,5∙56 = 28 г КОН, а в 4 л будеМаса(КОН) = 4∙28 = 112 г.
Якщо у 1030 г розчину маємо 28 г КОН, то у 100 г буде ![]() Тому, С% = 2,72 %.
Тому, С% = 2,72 %.
Кількість моль-екв. КОН в 1 л розчину ![]() моль-екв. Отже,
моль-екв. Отже,
СН = 0,5 н.
№ 8
В задачі потрібно знайти масу MgCl2, необхідну для приготування 0,5 л 0,2 н розчину MgCl2 густиною 1,01 г/мл, як також знайти процентну та молярну концентрації розчину
Молярна маса М(MgCl2) = 24,3+35,5∙2 = 95,3г/моль; еквівалент рівний ![]() моль; еквівалентна маса
моль; еквівалентна маса
![]() г/моль-екв.
г/моль-екв.
Маса 1 л розчину 1,01∙1000 = 1010 г.
В 1 л розчину має знаходитись m = 0,2∙47,65 = 9,53 г MgCl2, а у 0,5 л буде
Маса(MgCl2) = ![]()
Якщо у 1010 г розчину маємо 9,53 г MgCl2, то у 100 г буде ![]() Тому,
Тому,
С% = 0,94 %.
Кількість молей MgCl2 в 1 л розчину ![]() Отже,
Отже,
СМ = 0,1 М.
№ 9
В задачі потрібно знайти об’єм 0,1 М розчину CaCl2 густиною 1,03 г/мл при розчиненні 55,5 г препарату CaCl2, як також розрахувати процентну та нормальну концентрації розчину
Молярна маса М(CaCl2) = 40 + 35,5∙2 = 111 г/моль; еквівалент рівний ![]() моль; еквівалентна маса
моль; еквівалентна маса
![]() г/моль-екв.
г/моль-екв.
Маса 1 л розчину 1,03∙1000 = 1030 г.
В 1л розчину має бути m = 0,1∙111 = 11,1г CaCl2, а в невідомому об’ємі Vрозч буде 55,5 г. Звідси ![]()
Якщо у 1030 г розчину міститься 11,1 г CaCl2, то у 100 г буде ![]() Тому С% = 1,08 %.
Тому С% = 1,08 %.
Кількість моль-екв. CaCl2 в 1 л розчину ![]() моль-екв. Отже,
моль-екв. Отже,
СН= 0,2 н.
№ 10
В задачі потрібно знайти масу NaOH, необхідну для приготування 0,2 л 15% розчину NaOH густиною 1,12 г/мл, як також знайти молярну та нормальну концентрації розчину
Молярна маса М(NaOH) = 23 + 16 + 1 = 40 г/моль; еквівалент рівний 1 моль; еквівалентна маса Е(NaOH) = 40 г/моль-екв.
Маса 1 л розчину 1,12∙1000 = 1120 г.
Концентрація 15% означає, що у 100 г розчину має знаходитись 15 г NaOH, а у 1120 г (в 1 л) його має бути
![]()
Маса(NaOH) = 168∙0,2 = 33,6 г.
Кількість молей NaOH в 1 л розчину ![]() Тому,
Тому,
СМ= 4,2 М.
Кількісь моль-екв. NaOH в 1 л розчину ![]() моль-екв. Отже,
моль-екв. Отже,
СН = 4,2 н.
№ 11
Що собою уявляє: а) якісний аналіз у розчині та “сухий” метод аналізу; б) макро-, мікро- та напівмікроаналіз?
У переважній більшості випадків аналізовану речовину переводять спочатку в розчин, потім визначають окремі компоненти – іони або молекули. Так наприклад, для визначення іонів калію в солі KCl останню розчиняють у воді, і, за допомогою певних, характерних для іонів калію, реакцій визначають їх присутність. Поруч з цим, наявність ряду іонів можна встановити, не переводячи речовину в розчин. Так, щоб виявити натрій, невелику кількість речовини на платиновій дротинці вносять у безбарвне полум’я. Якщо в досліджуваній речовині присутній натрій, полум’я забарвиться в жовтий колір. Наявність іонів амонію також можна встановити, не переводячи речовину в розчин. Досить розтерти дослідний зразок з вапном або лугом. При наявності іонів амонію з’явиться характерний запах аміаку. Такий метод називають“сухим”. Метод, коли для аналізу беруть 0,1–1,0 г речовини, називають макроаналізом. Якщо для аналізу беруть менше 0,01 г речовини, такий метод називають мікроаналізом. Проміжні значення маси досліджуваної речовини (від 0,01 до 0,1 г) визначають метод напівмікроаналізу.
№ 12
Поняття про аналітичну реакцію. Чутливість, селективність та специфічність аналітичної реакції. Навести приклади
Аналітичною називається реакція, за допомогою якої відкривають ті чи інші речовини (або іони) і/або встановлюють кількість речовини.
Найменша кількість речовини або іонів, яку можна виявити за допомогою тієї чи іншої реакції в даних умовах називається відкриваним мінімумом або чутливістю реакції. Ця величина дуже мала і позначається буквою γ (γ = 10-6г).
Чутливість не слід характеризувати лише абсолютною кількістю речовини. Має значення ще концентрація іона або речовини в розчині. Найменшу концентрацію іонів або речовини, при якій їх ще можна виявити, називають граничним розведенням.
Наприклад, треба встановити чутливість реакціїFe3+ + 3SCN ↔ Fe(SCN)3.
Для цього готують розчин, в 500 мл якого міститься 1г-іон заліза. Відомо, що при розведенні в 20 разів в 1 краплі об’ємом 0,02 мл ще можна виявити іони заліза (ІІІ). Граничне розведення суть
![]()
Знаходимо відкриваний мінімум: ![]() , звідси
, звідси
![]()
Селективність реакції – її вибірковість до тих чи інших речовин або іонів. Існують реакції, проведенню яких не заважають сторонні іони. Так, іони амонію можна виявити лугом.
Ця реакція, та їй подібні називаються специфічними. Високоспецифічних реакцій відомо надзвичайно мало.
№ 13
Умови виконання аналітичних реакцій. Приклади реакцій, що проходять на холоді і при нагріванні розчину
Реакції проводять при нагріванні чи охолодженні лише в тих випадках, коли нагрівання чи охолодження сприяє проходженню прямої реакції до кінця, прискорює її.
Так, при виявленні іону амонію реакція NH4OH ↔ NH3↑ + H2Oйде швидше при підвищеній температурі, як також при даних умовах зростає чутливість і вихід даної реакції.
Приклад реакції, яку слід проводити на холоді:
NaCl + K[Sb(OH)6] → Na[Sb(OH)6]↓ + KCl
З ростом температури розчинність осаду Na[Sb(OH)6] зростає, через це вищезазначену реакцію треба вести на холоді.
Умовами проведення аналітичних реакцій взагалі є температура, концентрація і тиск, які максимально сприяють виявленню тих чи інших іонів.
№ 14
Що собою уявляють буферні розчини? Яка їх роль у виконанні аналітичних реакцій? Навести конкретні приклади
Буферними називають розчини суміші слабкої кислоти (або слабкої основи) та її солі. Такою є, наприклад, суміш оцтової кислоти і оцтовокислого натрію. При добавлянні до такої суміші сильної кислоти або сильної основи мають місце наступні реакції:
CH3COONa + HCl → CH3COOH + NaCl
CH3COOH + NaOH → CH3COONa + H2O.
Звідси видно, що при дії на буферний розчин сильної кислоти або сильної основи змінюється концентрація слабкої кислоти. У першому випадку вона збільшується, у другому – зменшується. Проте, рН розчину практично не змінюється. Це пояснюється тим, що слабка кислота взагалі мало дисоціює, а в присутності однойменних іонів її солі дисоціація йде значно меншою мірою. Отже, концентрація іонів Н+ буферної суміші під впливом сильної кислоти або сильної основи практично є величина стала.
У хімії, біології, медицині, у промисловому виробництві в результаті тих чи інших процесів можуть виділятись або поглинатись іони Н+. Щоб процес відбувався при сталому значенні рН, у розчин вводять буферні суміші, які поглинають водневі або гідроксильні іони. Можна також довести, що при розведенні буферної суміші рН розчину залишається сталим.
№ 15
Хімічні реактиви. Поняття про їх чистоту, кваліфікацію. Чи можна застосовувати для хімічного аналізу технічні реактиви?
Хімічними реактивами називають речовини, склад яких відповідає їх хімічним формулам в межах кваліфікації, і які застосовуються для проведення хімічних реакцій. Кваліфікація хімічних реактивів та відповідні їй позначення наступні:
Т – технічний реактив. Вміст основної речовини менше 98%. Найнижча ступінь чистоти реактиву.
Ч – чистий. Вміст основної речовини 98% і вище. Вміст домішок або нелеткого залишку 0,01– 0,5%, масова доля залишку після прожарювання до 0,5%.
ЧДА – чистий для аналізу. Вміст основної речовини не менше 99%. Домішки не перевищують допустимої межі, яка дозволяє проводити точні аналітичні дослідження.
ХЧ – хімічно чистий. Найвища ступінь чистоти реактиву. Вміст основної речовини більше 99%, домішок – в межах 0,001– 0,00001%, масова доля залишку після прожарювання не більше 0,1%.
Для хімічного аналізу застосовують реактиви з кваліфікацією не нижче ЧДА. Технічні реактиви для проведення аналітичних визначень застосовувати ні в якому разі не можна через велику кількість домішок.
№ 16
Що собою уявляють кристалічний та аморфний осади? Навести приклади та основні умови отримання
Кристалічний осад – це осад з порівняно сильними зв’язками між його частинками. Утворення кристалічних осадів характеризується тим, що при додаванні окремих порцій осаджувача нові центри кристалізації утворюються не відразу. Основною умовою отримання кристалічних осадів є повільне додавання реактиву, при якому кристалічні центри виростають у порівняно великі кристали.
Концентрація розчинів. Для осадження кристалічних осадів користуються розбавленими розчинами, так як у цих умовах утворюються осади у формі більших кристалів. Температура. При осаджуванні кристалічних осадів з гарячих розчинів збільшується їх розчинність, тому виникає менше центрів кристалізації. Внаслідок цього створюються умови для утворення крупніших кристалів.
Приклади: BaSO4, BaCrO4, CaC2O4 та ін. Аморфний осад характеризується слабкими зв’язками між його частинками. По суті це коагульований внаслідок швидкого доливання розчину осаджувача колоїдний розчин. При швидкому доливанні реактиву, яке, до речі, є основною умовою отримання аморфного осаду, відразу виникає багато центрів кристалізації та дрібних агрегатів кристалів. Концентрація розчинів. Аморфні осади, особливо гідроксиди металів, краще осаджувати з концентрованих розчинів. Це сприяє зменшенню загальної поверхні і утворенню осаду. Внаслідок зменшення загальної поверхні зменшується адсорбція сторонніх речовин, що робить осади чистішими.Температура. При осаджуванні аморфних осадів нагрівання сприяє коагуляції колоїдних частинок і укрупненню зерен осаду.
Аморфні осади характерні для багатьох важкорозчинних сполук: гідроксидів та сульфітів металів, силікатної та вольфрамової кислот, та інших.
№ 17
Який основний посуд використовують та як його готують для якісного аналізу?
У якісному аналізі (в основному напівмікроаналізі) застосовують такий посуд: колби, пробірки, чашки, стакани, скляні лійки, скляні палички, промивалки, бюкси, кухлі, ступки, ексикатори. Піпетки градуйовані та бюретки застосовують тільки в кількісному аналізі. Застосовуваний для якісного аналізу посуд має бути чистим. Його слід мити відразу після вживання. Для миття посуду застосовують теплий насичений розчин соди, теплий лужний розчин KMnO4 або розчин хромової суміші. Посудина вважається чистою, якщо після виливання з неї води внутрішні стінки змочуються водою рівномірно і на них не залишається крапель. Добре вимитий посуд, перекинутий догори дном, має здаватись сухим. Після миття посуд споліскують 2–3 рази невеликою кількістю дистильованої води, що є також способом перевірки чистоти посудини.
№ 18
Чим дистильована вода відрізняється від звичайної питної води? Чому посуд для аналітичних визначень обов’язково споліскують дистильованою водою?
Головна відмінність дистильованої води від питної – практично нульовий рівень концентрації солей кальцію і магнію та інших речовин, які обов’язково присутні в питній воді. Вимитий посуд двічі споліскують невеликою кількістю дистильованої води. Мета споліскування – перевірка чистоти посудини. Посудина вважається чистою, якщо при обмиванні внутрішньої поверхні дистильованою водою остання рівномірно стікає, не залишаючи краплин.
№ 19
Розкрити суть дробного та систематичного методів якісного аналізу. Чи можливе виконання аналізу речовини з використанням лише одного з цих методів?
Дробний метод аналізу передбачає виявлення кожного іона певними, характерними реакціями в присутності всіх інших іонів. У складніших випадках спочатку відділяють даний іон від тих, які заважають визначенню.
Систематичний аналіз полягає в тому, що складну суміш іонів спочатку розділяють за допомогою групових реактивів на кілька окремих груп, потім у межах кожної групи виявляють окремі іони певними, характерними реакціями. Розділяють іони на групи і виявляють їх в кожній групі в цілком певній послідовності, що виключає помилки, які часто роблять недосвідчені хіміки, проводячи аналіз дробним методом.
Використання лише одного з цих методів (дробного) можливе тільки у випадку високоспецифічних реакцій (таких, наприклад, як визначення іона амонію за допомогою лугу), та у випадку, коли визначуваний іон вдається без проблем відділити від іонів, які заважають визначенню.
№ 20
Які хімічні реагенти належать до групових, селективних, специфічних? Навести приклади. Написати рівняння реакцій
Груповими називають реактиви, якими визначають певну групу катіонів або аніонів. Наприклад, розчин сульфіду амонію є груповим реактивом на катіони 3-ї аналітичної групи. Розчин хлориду барію є груповим реактивом на аніони 1-ї аналітичної групи, і т. п.
Селективними називають реактиви, що визначають ті чи інші іони за певних умов. Так, фероціанід калію дає з іонами Ca2+ осад K2Ca[Fe(CN)6]. Якщо в розчині немає зовсім або є незначна концентрація іонів Ba2+, даний реактив “віддає перевагу” іонам Ca2+. Якщо ж має місце значна концентрація іонів Ba2+, фероціанід калію вже не буде селективним на іони Ca2+, тому що іони Ba2+ в значних концентраціях утворюють аналогічний осад.
Специфічними називають реактиви, дії яких не заважає жоден сторонній іон. Так, в одній з небагатьох високоспецифічних реакцій визначення іону амонію
NH4Cl + NaOH → NH4OH + NaCl
↕
NH3↑ + H2O
гідроксид натрію можна вважати специфічним на іон амонію. Специфічних реактивів, рівно як і специфічних реакцій, дуже мало.
№ 21
Що покладено в основу розподілу катіонів на аналітичні групи? Чи збігається даний розподіл з розподілом на групи в періодичній системі Д.І. Менделєєва?
Навести молекулярні та іонні рівняння реакцій дії групових реактивів на катіони: NH4+, Ca2+, Fe3+.
Зазначити колір осаду, розчинність. Пояснити, чому відсутній груповий реактив на катіони 1-ї аналітичної групи.
Систематичний аналіз ділить всі катіони на 5 аналітичних груп за розчинностями карбонатів і сульфідів. Принцип класифікації катіонів на аналітичні групи наступний:
1-ша група – карбонати і сульфіди катіонів даної групи добре розчинні у воді;
2-га група – катіони даної групи утворюють нерозчинні у воді карбонати;
3-тя група – сульфіди і гідроксиди катіонів даної групи нерозчинні у воді, але розчинні в розведених кислотах;
4-та група – сульфіди катіонів даної групи нерозчинні у воді і у розведеній соляній кислоті;
5-та група – сульфіди катіонів даної групи нерозчинні у воді і у розведеній соляній кислоті, проте розчинні у полісульфіді амонію.
Багато в чому класифікація катіонів на аналітичні групи збігається з поділом на групи в Періодичному Законі. Особливо це стосується катіонів 1-ї, 2-ї та 5-ї аналітичних груп. У 3-ю аналітичну групу включені катіони тріад.
За визначенням, до 1-ї аналітичної групи входять катіони, які не утворюють важкорозчинних сполук з карбонат- і сульфід-іонами. Наприклад, майже всі солі натрію, калію та амонію добре розчинні у воді. Тому не існує групового реактиву, здатного осадити всі катіони 1-ї аналітичної групи.
Рівняння реакцій:
1) груповий реактив на іони амонію відсутній через належність вказаного катіона до 1-ї аналітичної групи;
2) CaCl2 + (NH4)2CO3 → CaCO3↓ + 2NH4Cl
Ca2+ + CO32– → CaCO3↓
білий аморфний осад, розчинний в кислотах;
3) Fe2(SO4)3 + 3(NH4)2S → Fe2S3↓ + 3(NH4)2SO4
2Fe3+ + 3S2– → Fe2S3↓
чорний осад, розчинний в оцтовій і мінеральних кислотах.
№ 22
Що покладено в основу розподілу катіонів на аналітичні групи? Чи збігається даний розподіл з розподілом на групи в періодичній системі Д.І. Менделєєва?
Навести молекулярні та іонні рівняння реакцій дії групових реактивів на катіони: K+, Mn2+, Ca2+.
Зазначити колір осаду, розчинність. Пояснити, чому відсутній груповий реактив на катіони 1-ї аналітичної групи.
Систематичний аналіз ділить всі катіони на 5 аналітичних груп за розчинностями карбонатів і сульфідів. Принцип класифікації катіонів на аналітичні групи наступний:
1-ша група – карбонати і сульфіди катіонів даної групи добре розчинні у воді;
2-га група – катіони даної групи утворюють нерозчинні у воді карбонати;
3-тя група – сульфіди і гідроксиди катіонів даної групи нерозчинні у воді, але розчинні в розведених кислотах;
4-та група – сульфіди катіонів даної групи нерозчинні у воді і у розведеній соляній кислоті;
5-та група – сульфіди катіонів даної групи нерозчинні у воді і у розведеній соляній кислоті, проте розчинні у полісульфіді амонію.
Багато в чому класифікація катіонів на аналітичні групи збігається з поділом на групи в Періодичному Законі. Особливо це стосується катіонів 1-ї, 2-ї та 5-ї аналітичних груп. У 3-ю аналітичну групу включені катіони тріад.
За визначенням, до 1-ї аналітичної групи входять катіони, які не утворюють важкорозчинних сполук з карбонат- і сульфід-іонами. Наприклад, майже всі солі натрію, калію та амонію добре розчинні у воді. Тому не існує групового реактиву, здатного осадити всі катіони 1-ї аналітичної групи.
Рівняння реакцій:
1) на іон калію груповий реактив відсутній через належність вказаного катіона до 1-ї аналітичної групи;
2) MnSO4 + (NH4)2S → MnS↓ + (NH4)2SO4
Mn2+ + S2– → MnS↓
світло-рожевий осад, розчинний в кислотах;
3) CaCl2 + (NH4)2CO3 → CaCO3↓ + 2NH4Cl
Ca2+ + CO32– → CaCO3↓
білий аморфний осад, розчинний в кислотах.
№ 23
Що покладено в основу розподілу катіонів на аналітичні групи? Чи збігається даний розподіл з розподілом на групи в періодичній системі Д.І. Менделєєва?
Навести молекулярні та іонні рівняння реакцій дії групових реактивів на катіони: Na+, Cu2+, Zn2+.
Зазначити колір осаду, розчинність. Пояснити, чому відсутній груповий реактив на катіони 1-ї аналітичної групи.
Систематичний аналіз ділить всі катіони на 5 аналітичних груп за розчинностями карбонатів і сульфідів. Принцип класифікації катіонів на аналітичні групи наступний:
1-ша група – карбонати і сульфіди катіонів даної групи добре розчинні у воді;
2-га група – катіони даної групи утворюють нерозчинні у воді карбонати;
3-тя група – сульфіди і гідроксиди катіонів даної групи нерозчинні у воді, але розчинні в розведених кислотах;
4-та група – сульфіди катіонів даної групи нерозчинні у воді і у розведеній соляній кислоті;
5-та група – сульфіди катіонів даної групи нерозчинні у воді і у розведеній соляній кислоті, проте розчинні у полісульфіді амонію.
Багато в чому класифікація катіонів на аналітичні групи збігається з поділом на групи в Періодичному Законі. Особливо це стосується катіонів 1-ї, 2-ї та 5-ї аналітичних груп. У 3-ю аналітичну групу включені катіони тріад.
За визначенням, до 1-ї аналітичної групи входять катіони, які не утворюють важкорозчинних сполук з карбонат- і сульфід-іонами. Наприклад, майже всі солі натрію, калію та амонію добре розчинні у воді. Тому не існує групового реактиву, здатного осадити всі катіони 1-ї аналітичної групи.
Рівняння реакцій:
1) на іон натрію груповий реактив відсутній через належність вказаного катіона до 1-ї аналітичної групи;
2) CuSO4 + H2S → CuS↓ + H2SO4
Cu2+ + S2– → CuS↓
чорний осад, нерозчинний в розведених соляній та сірчаній кислотах, проте розчинний в 2 н розчині азотної кислоти;
3) ZnSO4 + (NH4)2S → ZnS↓ + (NH4)2SO4
Zn2+ + S2– → ZnS↓
білий осад, нерозчинний в оцтовій кислоті, але розчинний в розведених міне-ральних кислотах.
№ 24
Що покладено в основу розподілу катіонів на аналітичні групи? Чи збігається даний розподіл з розподілом на групи в періодичній системі Д.І. Менделєєва?
Навести молекулярні та іонні рівняння реакцій дії групових реактивів на катіони: Mg2+, Fe3+, Cu2+.
Зазначити колір осаду, розчинність. Пояснити, чому відсутній груповий реактив на катіони 1-ї аналітичної групи.
Систематичний аналіз ділить всі катіони на 5 аналітичних груп за розчинностями карбонатів і сульфідів. Принцип класифікації катіонів на аналітичні групи наступний:
1-ша група – карбонати і сульфіди катіонів даної групи добре розчинні у воді;
2-га група – катіони даної групи утворюють нерозчинні у воді карбонати;
3-тя група – сульфіди і гідроксиди катіонів даної групи нерозчинні у воді, але розчинні в розведених кислотах;
4-та група – сульфіди катіонів даної групи нерозчинні у воді і у розведеній соляній кислоті;
5-та група – сульфіди катіонів даної групи нерозчинні у воді і у розведеній соляній кислоті, проте розчинні у полісульфіді амонію.
Багато в чому класифікація катіонів на аналітичні групи збігається з поділом на групи в Періодичному Законі. Особливо це стосується катіонів 1-ї, 2-ї та 5-ї аналітичних груп. У 3-ю аналітичну групу включені катіони тріад.
За визначенням, до 1-ї аналітичної групи входять катіони, які не утворюють важкорозчинних сполук з карбонат- і сульфід-іонами. Наприклад, майже всі солі натрію, калію та амонію добре розчинні у воді. Тому не існує групового реактиву, здатного осадити всі катіони 1-ї аналітичної групи.
Рівняння реакцій:
1) Іноді Mg2+ відносять до 1-ї аналітичної групи, на катіони якої не існує групового реактиву. Проте, карбонат амонію при нагріванні з солями магнію і відсутності солей амонію осаджує магній у вигляді білого аморфного осаду непостійного складу, найчастіше утворюється Mg(OH)2∙3MgCO3. Саме тому Mg2+ часто відносять до 2-ї аналітичної групи;
2) Fe2(SO4)3 + 3(NH4)2S → Fe2S3↓ + 3(NH4)2SO4
2Fe3+ + 3S2– → Fe2S3↓
чорний осад, розчинний в оцтовій і мінеральних кислотах;
3) CuSO4 + H2S → CuS↓ + H2SO4
Cu2+ + S2– → CuS↓
чорний осад, нерозчинний в розведених соляній та сірчаній кислотах, проте розчинний в 2 н розчині азотної кислоти.
№ 25
Що покладено в основу розподілу катіонів на аналітичні групи? Чи збігається даний розподіл з розподілом на групи в періодичній системі Д.І. Менделєєва?
Навести молекулярні та іонні рівняння реакцій дії групових реактивів на катіони: NH4+, Cu2+, Mn2+.
Зазначити колір осаду, розчинність. Пояснити, чому відсутній груповий реактив на катіони 1-ї аналітичної групи.
Систематичний аналіз ділить всі катіони на 5 аналітичних груп за розчинностями карбонатів і сульфідів. Принцип класифікації катіонів на аналітичні групи наступний:
1-ша група – карбонати і сульфіди катіонів даної групи добре розчинні у воді;
2-га група – катіони даної групи утворюють нерозчинні у воді карбонати;
3-тя група – сульфіди і гідроксиди катіонів даної групи нерозчинні у воді, але розчинні в розведених кислотах;
4-та група – сульфіди катіонів даної групи нерозчинні у воді і у розведеній соляній кислоті;
5-та група – сульфіди катіонів даної групи нерозчинні у воді і у розведеній соляній кислоті, проте розчинні у полісульфіді амонію.
Багато в чому класифікація катіонів на аналітичні групи збігається з поділом на групи в Періодичному Законі. Особливо це стосується катіонів 1-ї, 2-ї та 5-ї аналітичних груп. У 3-ю аналітичну групу включені катіони тріад.
За визначенням, до 1-ї аналітичної групи входять катіони, які не утворюють важкорозчинних сполук з карбонат- і сульфід-іонами. Наприклад, майже всі солі натрію, калію та амонію добре розчинні у воді. Тому не існує групового реактиву, здатного осадити всі катіони 1-ї аналітичної групи.
Рівняння реакцій:
1) на іон амонію груповий реактив відсутній через належність вказаного катіона до 1-ї аналітичної групи;
2) CuSO4 + H2S → CuS↓ + H2SO4
Cu2+ + S2– → CuS↓
чорний осад, нерозчинний в розведених соляній та сірчаній кислотах, але розчинний в 2 н розчині HNO3 ;
3) MnSO4 + (NH4)2S → MnS↓ + (NH4)2SO4
Mn2+ + S2– → MnS↓
світло-рожевий осад, розчинний в кислотах.
№ 26
Що покладено в основу розподілу катіонів на аналітичні групи? Чи збігається даний розподіл з розподілом на групи в періодичній системі Д.І. Менделєєва?
Навести молекулярні та іонні рівняння реакцій дії групових реактивів на катіони: Ca2+, Mg2+, Zn2+.
Зазначити колір осаду, розчинність. Пояснити, чому відсутній груповий реактив на катіони 1-ї аналітичної групи.
Систематичний аналіз ділить всі катіони на 5 аналітичних груп за розчинностями карбонатів і сульфідів. Принцип класифікації катіонів на аналітичні групи наступний:
1-ша група – карбонати і сульфіди катіонів даної групи добре розчинні у воді;
2-га група – катіони даної групи утворюють нерозчинні у воді карбонати;
3-тя група – сульфіди і гідроксиди катіонів даної групи нерозчинні у воді, але розчинні в розведених кислотах;
4-та група – сульфіди катіонів даної групи нерозчинні у воді і у розведеній соляній кислоті;
5-та група – сульфіди катіонів даної групи нерозчинні у воді і у розведеній соляній кислоті, проте розчинні у полісульфіді амонію.
Багато в чому класифікація катіонів на аналітичні групи збігається з поділом на групи в Періодичному Законі. Особливо це стосується катіонів 1-ї, 2-ї та 5-ї аналітичних груп. У 3-ю аналітичну групу включені катіони тріад.
За визначенням, до 1-ї аналітичної групи входять катіони, які не утворюють важкорозчинних сполук з карбонат- і сульфід-іонами. Наприклад, майже всі солі натрію, калію та амонію добре розчинні у воді. Тому не існує групового реактиву, здатного осадити всі катіони 1-ї аналітичної групи.
Рівняння реакцій:
1) CaCl2 + (NH4)2CO3 → CaCO3↓ + 2NH4Cl
Ca2+ + CO32– → CaCO3↓
білий аморфний осад, розчинний в кислотах;
2) іноді Mg2+ відносять до 1-ї аналітичної групи, на катіони якої не існує групового реактиву. Проте, карбонат амонію при нагріванні з солями магнію і відсутності солей амонію осаджує магній у вигляді білого аморфного осаду непостійного складу. Найчастіше утворюється Mg(OH)2∙3MgCO3. Саме тому Mg2+ часто відносять до 2-ї аналітичної групи;
3) ZnSO4 + (NH4)2S → ZnS↓ + (NH4)2SO4
Zn2+ + S2– → ZnS↓
білий осад, нерозчинний в оцтовій кислоті, проте розчинний в розведених мінеральних кислотах.
№ 27
Що покладено в основу розподілу катіонів на аналітичні групи? Чи збігається даний розподіл з розподілом на групи в періодичній системі Д.І. Менделєєва?
Навести молекулярні та іонні рівняння реакцій дії групових реактивів на катіони: Na+, Ba2+, Al3+.
Зазначити колір осаду, розчинність. Пояснити, чому відсутній груповий реактив на катіони 1-ї аналітичної групи.
Систематичний аналіз ділить всі катіони на 5 аналітичних груп за розчинностями карбонатів і сульфідів. Принцип класифікації катіонів на аналітичні групи наступний:
1-ша група – карбонати і сульфіди катіонів даної групи добре розчинні у воді;
2-га група – катіони даної групи утворюють нерозчинні у воді карбонати;
3-тя група – сульфіди і гідроксиди катіонів даної групи нерозчинні у воді, але розчинні в розведених кислотах;
4-та група – сульфіди катіонів даної групи нерозчинні у воді і у розведеній соляній кислоті;
5-та група – сульфіди катіонів даної групи нерозчинні у воді і у розведеній соляній кислоті, проте розчинні у полісульфіді амонію.
Багато в чому класифікація катіонів на аналітичні групи збігається з поділом на групи в Періодичному Законі. Особливо це стосується катіонів 1-ї, 2-ї та 5-ї аналітичних груп. У 3-ю аналітичну групу включені катіони тріад.
За визначенням, до 1-ї аналітичної групи входять катіони, які не утворюють важкорозчинних сполук з карбонат- і сульфід-іонами. Наприклад, майже всі солі натрію, калію та амонію добре розчинні у воді. Тому не існує групового реактиву, здатного осадити всі катіони 1-ї аналітичної групи.
Рівняння реакцій:
1) на іон натрію груповий реактив відсутній через належність вказаного катіона до 1-ї аналітичної групи;
2) BaCl2 + (NH4)2CO3 → BaCO3↓ + 2NH4Cl
Ba2+ + CO32– → BaCO3↓
білий аморфний осад, розчинний в кислотах, крім сірчаної;
3) 2AlCl3 + 3(NH4)2S + 6H2O → 2Al(OH)3↓ + 6NH4Cl + 3H2S↑
2Al3+ + 3S2– + 6HOH → 2Al(OH)3↓ + 3H2S↑
осад білого кольору, що має амфотерні властивості.
№ 28
Що покладено в основу розподілу катіонів на аналітичні групи? Чи збігається даний розподіл з розподілом на групи в періодичній системі Д.І. Менделєєва? Навести молекулярні та іонні рівняння реакцій дії групових реактивів на катіони: Mn2+, Fe2+, Na+. Зазначити колір осаду, розчинність. Пояснити, чому відсутній груповий реактив на катіони 1-ї аналітичної групи
Систематичний аналіз ділить всі катіони на 5 аналітичних груп за розчинностями карбонатів і сульфідів. Принцип класифікації катіонів на аналітичні групи наступний:
1-ша група – карбонати і сульфіди катіонів даної групи добре розчинні у воді;
2-га група – катіони даної групи утворюють нерозчинні у воді карбонати;
3-тя група – сульфіди і гідроксиди катіонів даної групи нерозчинні у воді, але розчинні в розведених кислотах;
4-та група – сульфіди катіонів даної групи нерозчинні у воді і у розведеній соляній кислоті;
5-та група – сульфіди катіонів даної групи нерозчинні у воді і у розведеній соляній кислоті, проте розчинні у полісульфіді амонію.
Багато в чому класифікація катіонів на аналітичні групи збігається з поділом на групи в Періодичному Законі. Особливо це стосується катіонів 1-ї, 2-ї та 5-ї аналітичних груп. У 3-ю аналітичну групу включені катіони тріад.
За визначенням, до 1-ї аналітичної групи входять катіони, які не утворюють важкорозчинних сполук з карбонат- і сульфід-іонами. Наприклад, майже всі солі натрію, калію та амонію добре розчинні у воді. Тому не існує групового реактиву, здатного осадити всі катіони 1-ї аналітичної групи.
Рівняння реакцій:
1) MnSO4 + (NH4)2S → MnS↓ + (NH4)2SO4
Mn2+ + S2– → MnS↓
світло-рожевий осад, розчинний в кислотах;
2) FeSO4 + (NH4)2S → FeS↓ + (NH4)2SO4
Fe2+ + S2– → FeS↓
чорний осад, розчинний в кислотах;
3) на іон натрію груповий реактив відсутній через належність вказаного катіона до 1-ї аналітичної групи.
№ 29
Що покладено в основу розподілу катіонів на аналітичні групи? Чи збігається даний розподіл з розподілом на групи в періодичній системі Д.І. Менделєєва? Навести молекулярні та іонні рівняння реакцій дії групових реактивів на катіони: Mg2+, Fe3+, Cu2+. Зазначити колір осаду, розчинність. Пояснити, чому відсутній груповий реактив на катіони 1-ї аналітичної групи
Систематичний аналіз ділить всі катіони на 5 аналітичних груп за розчинностями карбонатів і сульфідів. Принцип класифікації катіонів на аналітичні групи наступний:
1-ша група – карбонати і сульфіди катіонів даної групи добре розчинні у воді;
2-га група – катіони даної групи утворюють нерозчинні у воді карбонати;
3-тя група – сульфіди і гідроксиди катіонів даної групи нерозчинні у воді, але розчинні в розведених кислотах;
4-та група – сульфіди катіонів даної групи нерозчинні у воді і у розведеній соляній кислоті;
5-та група – сульфіди катіонів даної групи нерозчинні у воді і у розведеній соляній кислоті, проте розчинні у полісульфіді амонію.
Багато в чому класифікація катіонів на аналітичні групи збігається з поділом на групи в Періодичному Законі. Особливо це стосується катіонів 1-ї, 2-ї та 5-ї аналітичних груп. У 3-ю аналітичну групу включені катіони тріад.
За визначенням, до 1-ї аналітичної групи входять катіони, які не утворюють важкорозчинних сполук з карбонат- і сульфід-іонами. Наприклад, майже всі солі натрію, калію та амонію добре розчинні у воді. Тому не існує групового реактиву, здатного осадити всі катіони 1-ї аналітичної групи.
Рівняння реакцій:
1) Іноді Mg2+ відносять до 1-ї аналітичної групи, на катіони якої не існує групового реактиву. Проте, карбонат амонію при нагріванні з солями магнію і відсутності солей амонію осаджує магній у вигляді білого аморфного осаду непостійного складу, найчастіше утворюється Mg(OH)2∙3MgCO3. Саме тому Mg2+ часто відносять до 2-ї аналітичної групи;
2) Fe2(SO4)3 + 3(NH4)2S → Fe2S3↓ + 3(NH4)2SO4
2Fe3+ + 3S2– → Fe2S3↓
чорний осад, розчинний в оцтовій і мінеральних кислотах;
3) CuSO4 + H2S → CuS↓ + H2SO4
Cu2+ + S2– → CuS↓
чорний осад, нерозчинний в розведених соляній і сірчаній кислотах, проте розчинний в 2 н розчині азотної кислоти.
№ 30
Що покладено в основу розподілу катіонів на аналітичні групи? Чи збігається даний розподіл з розподілом на групи в періодичній системі Д.І. Менделєєва? Навести молекулярні та іонні рівняння реакцій дії групових реактивів на катіони: Mn2+, Ba2+, NH4+. Зазначити колір осаду, розчинність. Пояснити, чому відсутній груповий реактив на катіони 1-ї аналітичної групи
Систематичний аналіз ділить всі катіони на 5 аналітичних груп за розчинностями карбонатів і сульфідів. Принцип класифікації катіонів на аналітичні групи наступний:
1-ша група – карбонати і сульфіди катіонів даної групи добре розчинні у воді;
2-га група – катіони даної групи утворюють нерозчинні у воді карбонати;
3-тя група – сульфіди і гідроксиди катіонів даної групи нерозчинні у воді, але розчинні в розведених кислотах;
4-та група – сульфіди катіонів даної групи нерозчинні у воді і у розведеній соляній кислоті;
5-та група – сульфіди катіонів даної групи нерозчинні у воді і у розведеній соляній кислоті, проте розчинні у полісульфіді амонію.
Багато в чому класифікація катіонів на аналітичні групи збігається з поділом на групи в Періодичному Законі. Особливо це стосується катіонів 1-ї, 2-ї та 5-ї аналітичних груп. У 3-ю аналітичну групу включені катіони тріад.
За визначенням, до 1-ї аналітичної групи входять катіони, які не утворюють важкорозчинних сполук з карбонат- і сульфід-іонами. Наприклад, майже всі солі натрію, калію та амонію добре розчинні у воді. Тому не існує групового реактиву, здатного осадити всі катіони 1-ї аналітичної групи.
Рівняння реакцій:
1) MnSO4 + (NH4)2S → MnS↓ + (NH4)2SO4
Mn2+ + S2– → MnS↓
світло-рожевий осад, розчинний в кислотах;
2) BaCl2 + (NH4)2CO3 → BaCO3↓ + 2NH4Cl
Ba2+ + CO32– → BaCO3↓
білий аморфний осад, розчинний в кислотах (крім сірчаної);
3) на іон амонію груповий реактив відсутній через належність даного катіона до 1-ї аналітичної групи.
№ 35-36-37
Відповідно до номеру завдання вказати, які з катіонів
NH4+, Na+, K+, Mg2+, Ca2+, Ba2+, Mn2+, Fe2+, Fe3+, Al3+, Cu2+, Zn2+
та за допомогою яких специфічних реактивів визначають дробним аналізом. Напи-сати молекулярні та іонні рівняння відповідних реакцій, казати умови виконання та зовнішній ефект для катіонів 2-ї аналітичної групи
Характерна реакція на іон Ba2+:
К2Сr2O7 + 2ВаСl2 + H2O + 2NaCH3COO → 2ВаСrO4 + 2КСl + 2NaСl + 2CH3COOН
Основна умова – присутність ацетату натрію. Хромати стронцію і кальцію, розчиняючись в оцтовій кислоті, не заважають виявленню іона Ba2+. Спостерігатиметься жовтий осад у присутності вказаного іона.
Характерна реакція на іон Ca2+:
CaSO4 + K4[Fe(CN)6] → K2Ca[Fe(CN)6]↓ + K2SO4
2K+ + Ca2+ + [Fe(CN)6]4– → K2Ca[Fe(CN)6]↓
В даному випадку утворюється білий осад фероціаніду калію і кальцію K2Ca[Fe(CN)6]. У присутності солей амонію утворюється менш розчинна сіль фероціаніду кальцію, калію і амонію змінного складу. Ця реакція виявляє іон кальцію у присутності іона Sr2+, але іони Ba2+ в значних концентраціях можуть утворити аналогічні осади. Користуватись даною реакцією для виявлення іонів кальцію в присутності іонів барію небажано.
Катіон Cu2+ теж можна виявити дробним аналізом за допомогою надлишку гідроксиду амонію, проте вказаний катіон не належить до 2-ї аналітичної групи.
№ 38-39-40
Відповідно до номеру завдання вказати, які з катіонів
NH4+,Na+, K+, Mg2+, Ca2+, Ba2+, Mn2+, Fe2+, Fe3+, Al3+, Cu2+, Zn2+
та за допомогою яких специфічних реактивів визначають дробним аналізом? Написати молекулярні та іонні рівняння відповідних реакцій, вказати умови виконання та зовнішній ефект для катіонів 3-ї аналітичної групи. Характерні реакції на катіони Fe2+ та Fe3+:
3FeSO4 + 2K3[Fe(CN)6] → Fe3[Fe(CN)6]2↓ + 3K2SO4
3Fe2+ + 2[Fe(CN)6]3– → Fe3[Fe(CN)6]2↓
4FeCl3 + 3K4[Fe(CN)6] → Fe4[Fe(CN)6]3↓ + 12KCl
4Fe3+ + 3[Fe(CN)6]4– → Fe4[Fe(CN)6]3↓
В обох випадках у присутності вказаних іонів випаде темно-синій осад, який відповідно має назву “турнбульова синь” та “берлінська лазур”.
Характерна реакція на катіон Mn2+:
2MnSO4 + 5NaBiO3 + 16HNO3 → 2HMnO4 + 5Bi(NO3)3 + 2Na2SO4 + NaNO3 + 7H2O
2Mn2+ + 5BiO3‾ + 14H+ → 2MnO4‾ + 5Bi3+ + 7H2O
Умови: холодний азотнокислий розчин. Зовнішній ефект – малиново-фіолетове забарвлення у присутності іонів Mn2+.
Інша характерна реакція на цей же катіон:
2MnSO4 + 5(NH4)2S2O8 + 8H2O → 2HMnO4 + 5(NH4)2SO4 + 7H2SO4
2Mn2+ + 5S2O82– + 8HOH → 2MnO4‾ + 12SO42– + 16H+
Умови: присутність AgNO3. Зовнішній ефект: малиново-фіолетове забарвлення у присутності іонів Mn2+. Буре забарвлення при надлишку вказаних іонів.
Характерна реакція на катіон Zn2+:
ZnSO4 + H2S + 2CH3COONa → ZnS↓ + 2CH3COOH + Na2SO4
Zn2+ + H2S + 2CH3COO‾ → ZnS↓ + 2CH3COOH
Умови: повне осадження тільки за присутності ацетату лужного металу; середовище з РН 2–3. Зовнішній ефект – білий осад ZnS у присутності іонів Zn2+.
Характерна реакція на катіон Al3+:
NaAlO2 + NH4Cl + 2H2O → Al(OH)3↓ + NH4OH + NaCl
AlO2‾ + NH4+ + 2H2O → Al(OH)3↓ + NH4OH
Умови: присутність твердої солі NH4Cl. Зовнішній ефект – білий осад Al(OH)3 у присутності іонів Al3+.
Катіон Cu2+ теж можна виявити дробним аналізом за допомогою надлишку гідроксиду амонію, проте вказаний катіон відносять не до 3-ї, а до 4-ї аналітичної групи.
№ 41Дати обґрунтовану відповідь, який висновок роблять за результатами дробного аналізу, якщо при дії на окрему порцію розчину, що аналізується: гідроксиду калію чи натрію (при нагріванні) виділяється газ з різким запахом, в присутності якого синіє червоний лакмусовий папірець, змочений водою. Написати молекулярне та іонне рівняння реакції відкриття встановленого катіону. Зазначити умови її виконання
Це означає, що в досліджуваному розчині присутні катіони амонію:
NH4Cl + KOH → NH4OH + KCl
↨
NH3↑ + H2O
NH4+ + OH– ↔ NH3↑ + H2O
Умови – нагрівання. Червоний лакмусовий папірець, змочений водою, синіє у присутності пари аміаку, оскільки утворює з водою луг:
NH3 + H2O → NH4OH
№ 42
Дати обґрунтовану відповідь, який висновок роблять за результатами дробного аналізу, якщо при дії на окрему порцію розчину, що аналізується:
дихромату калію (у присутності ацетату натрію) утворюється жовтий осад.
Написати молекулярне та іонне рівняння реакції відкриття встановленого катіону. Зазначити умови її виконання.
Це означає, що у досліджуваному розчині присутні катіони Ва2+:
K2Cr2O7 + 2BaCl2 + H2O + 2NaCH3COO → 2BaCrO4↓ + 2KCl + 2NaCl + 2CH3COOH
2Ba2+ + Cr2O72– + 2CH3COO– + H2O → 2BaCrO4↓ + 2CH3COOH
Основна умова – присутність ацетату натрію. Хромати стронцію і кальцію, розчиняючись в оцтовій кислоті, не заважають виявленню іона Ba2+.
№ 43-44
Дати обґрунтовану відповідь, який висновок роблять за результатами дробного аналізу, якщо при дії на окрему порцію розчину, що аналізується: гексаціаноферату (ІІІ) калію утворюється темно-синій осад. Написати молекулярне та іонне рівняння реакції відкриття встановленого катіону. Зазначити умови її виконання
Це означає, що досліджуваний розчин містить катіони Fe2+:
3FeSO4 + 2K3[Fe(CN)6] → Fe3[Fe(CN)6]2↓ + 3K2SO4
3Fe2+ + 2[Fe(CN)6]3– → Fe3[Fe(CN)6]2↓
Осад має назву “турнбульова синь”.
Умови: нелужне середовище (нейтральне або слабокисле), оскільки вказаний осад розчинний в лугах.
№ 45-46
Дати обґрунтовану відповідь, який висновок роблять за результатами дробного аналізу, якщо при дії на окрему порцію розчину, що аналізується: гексаціаноферату (ІІ) калію утворюється темно-синій осад. Написати молекулярне та іонне рівняння реакції відкриття встановленого катіону. Зазначити умови її виконання
Це означає, що досліджуваний розчин містить катіони Fe3+:
4FeCl3 + 3K4[Fe(CN)6] → Fe4[Fe(CN)6]3↓ + 12KCl
4Fe3+ + 3[Fe(CN)6]4– → Fe4[Fe(CN)6]3↓
Осад має назву “берлінська лазур”.
Умови: не додавати надлишок реактиву; не додавати щавелеву кислоту (осад в ній розчинний); нейтральне середовище.
№ 47-48
Дати обґрунтовану відповідь, який висновок роблять за результатами дробного аналізу, якщо при дії на окрему порцію розчину, що аналізується: вісмутату натрію в присутності HNO3 розчин забарвлюється в малиново-фіолетовий колір. Написати молекулярне та іонне рівняння реакції відкриття встановленого катіону. Зазначити умови її виконання
Це означає присутність у досліджуваному розчині катіонів Mn2+:
2Mn(NO3)2 + 5NaBiO3 + 14HNO3 → 2NaMnO4 + 3NaNO3 + 5Bi(NO3)3 + 7H2O
2 Mn2+ + 4H2O – 5е– → MnO4– + 8H+
5 BiO3– + 6H+ + 2е– → Bi3+ + 3H2O
2Mn2+ + 5BiO3– + 14H+ → 2MnO4– + 5Bi3+ + 7H2O
Умови: реакцію виконувати на холоді.
№ 49-50
Дати обґрунтовану відповідь, який висновок роблять за результатами дробного аналізу, якщо при дії на окрему порцію розчину, що аналізується: надлишку гідроксиду амонію утворюється розчин координаційної сполуки інтенсивно-синього кольору. Написати молекулярне та іонне рівняння реакції відкриття встановленого катіону. Зазначити умови її виконання
Це означає присутність у досліджуваному розчині катіонів Cu2+:
2Cu2+ + 2SO42– + 2NH4OH → [Cu(OH)]2SO4 + 2NH4+ + SO42–
[Cu(OH)]2SO4 + 2NH4+ + 6NH3 → 2[Cu(NH3)4]2+ + SO42– + 2H2O
Умови виконання реакції – непідкислений розчин.
№ 51
Скласти молекулярні та іонні рівняння основних реакцій визначення катіонів Ca2+, Al3+. Навести умови виконання цих реакцій. Звернути увагу на іони, що заважають визначенню
CaCl2 + (NH4)2C2O4 → CaC2O4↓ + 2NH4Cl
Ca2+ + C2O42– → CaC2O4↓
Іони барію та стронцію заважають виявленню іона Ca2+, так як дають з оксалатом амонію аналогічні осади.
CaCl2 + K4[Fe(CN)6] → K2Ca[Fe(CN)6]↓ + 2KCl
2K+ + Ca2+ + [Fe(CN)6]4– → K2Ca[Fe(CN)6]↓
Іони барію в значних концентраціях можуть заважати визначенню іонів кальцію, так як утворюють аналогічний осад.
NaAlO2 + NH4Cl + 2H2O → Al(OH)3↓ + NaCl + NH4OH
AlO2‾ + NH4+ + 2HOH → Al(OH)3↓ + NH4OH
Реакція йде за присутності твердого хлориду амонію. Визначенню іонів Al3+ заважають іони Cr3+.
№ 52
Скласти молекулярні та іонні рівняння основних реакцій визначення катіонів K+, Ca2+. Навести умови виконання цих реакцій. Звернути увагу на іони, що заважають визначенню
KCl + NaHC4H4O6 → KHC4H4O6↓ + NaCl
K+ + HC4H4O6‾ → KHC4H4O6↓
Умови: нейтральний або оцтовокислий холодний розчин, велика концентрація іонів К+. Заважають іони амонію.
2KNO3 + Na3[Co(NO2)6] → K2Na[Co(NO2)6]↓ + 2NaNO3
2K+ + Na+ + [Co(NO2)6]3– → K2Na[Co(NO2)6]↓
Умови: нейтральний чи оцтовокислий розчин. Заважають іони амонію.
CaSO4 + (NH4)2C2O4 → CaC2O4↓ + (NH4)2SO4
Ca2+ + C2O42– → CaC2O4↓
Заважають іони барію та стронцію, які з оксалатом амонію дають аналогічні осади.
CaCl2 + K4[Fe(CN)6] → K2Ca[Fe(CN)6]↓ + 2KCl
2K+ + Ca2+ + [Fe(CN)6]4– → K2Ca[Fe(CN)6]↓
Іони барію в значних концентраціях можуть заважати визначенню іонів кальцію, оскільки утворюють аналогічний осад.
№ 53
Скласти молекулярні та іонні рівняння основних реакцій визначення катіонів Na+, Zn2+. Навести умови виконання цих реакцій. Звернути увагу на іони, що заважають визначенню
NaCl + K[Sb(OH)6] → Na[Sb(OH)6]↓ + KCl
Na+ + [Sb(OH)6]‾ → Na[Sb(OH)6]↓
Умови: нейтральне або слабколужне середовище, досить висока концентрація солі натрію, холодний розчин. Солі амонію заважають даній реакції тому що гідролізують, результуючи іони водню. Реактив K[Sb(OH)6] у присутності солей амонію розкладається так само, як при дії кислот.
Na+ + Zn[(UO2)3(CH3COO)8] + CH3COO‾ + 9H2O →
→ NaZn[(UO2)3(CH3COO)9]∙9H2O↓
Умови: нейтральний або оцтовокислий розчин.
ZnSO4 + H2S + 2CH3COONa → ZnS↓ + 2CH3COOH + Na2SO4
Zn2+ + H2S + 2CH3COO‾ → ZnS↓ + 2CH3COOH
Осад ZnS розчинний в мінеральних кислотах. В даній реакції присутність ацетату натрію необхідна тому що сильна кислота HCl, яка утворюється без його присутності, замінюється на слабку CH3COOH, в якій ZnS не розчиняється. Заважають іони Co2+ та Ni2+ якщо рН розчину не дорівнює 2.
№ 54
Скласти молекулярні та іонні рівняння основних реакцій визначення катіонів Mg2+, Al3+. Навести умови виконання цих реакцій. Звернути увагу на іони, що заважають визначенню
MgSO4 + 2NH4OH ↔ Mg(OH)2↓ + (NH4)2SO4
Mg2+ + 2NH4OH ↔ Mg(OH)2↓ + 2NH4+
Іони амонію заважають визначеннню іонів магнію.
NaAlO2 + NH4Cl + 2H2O → Al(OH)3↓ + NaCl + NH4OH
AlO2‾ + NH4+ + 2HOH → Al(OH)3↓ + NH4OH
Умови: присутність твердого хлориду амонію. Іони Cr3+ заважають визначенню іонів Al3+.
№ 55
Скласти молекулярні та іонні рівняння основних реакцій визначення катіонів Na+, Al3+. Навести умови виконання цих реакцій. Звернути увагу на іони, що заважають визначенню
NaCl + K[Sb(OH)6] → Na[Sb(OH)6]↓ + KCl
Na+ + [Sb(OH)6]‾ → Na[Sb(OH)6]↓
Умови: нейтральне або слабколужне середовище, досить висока концентрація солі натрію, холодний розчин.
Солі амонію заважають даній реакції тому що гідролізують, результуючи іони водню. Реактив K[Sb(OH)6] у присутності солей амонію розкладається так само, як при дії кислот.
Na+ + Zn[(UO2)3(CH3COO)8] + CH3COO‾ + 9H2O →
→ NaZn[(UO2)3(CH3COO)9]∙9H2O↓
Умови: нейтральний або оцтовокислий розчин.
NaAlO2 + NH4Cl + 2H2O → Al(OH)3↓ + NaCl + NH4OH
AlO2‾ + NH4+ + 2HOH → Al(OH)3↓ + NH4OH
Реакція йде за присутності твердого хлориду амонію. Визначенню іонів Al3+ заважають іони Cr3+.
№ 56
Скласти молекулярні та іонні рівняння основних реакцій визначення катіонів Ca2+, Zn2+. Навести умови виконання цих реакцій. Звернути увагу на іони, що заважають визначенню
CaSO4 + (NH4)2C2O4 → CaC2O4↓ + (NH4)2SO4
Ca2+ + C2O42– → CaC2O4↓
Виявленню іонів кальцію заважають іони барію та стронцію, які дають з оксалатом амонію аналогічні осади.
CaCl2 + K4[Fe(CN)6] → K2Ca[Fe(CN)6]↓ + 2KCl
2K+ + Ca2+ + [Fe(CN)6]4– → K2Ca[Fe(CN)6]↓
Іони барію в значних концентраціях можуть заважати визначенню іонів кальцію, оскільки дають аналогічні осади.
ZnSO4 + H2S + 2CH3COONa → ZnS↓ + 2CH3COOH + Na2SO4
Zn2+ + H2S + 2CH3COO‾ → ZnS↓ + 2CH3COOH
Осад ZnS розчинний в мінеральних кислотах. В даній реакції присутність ацетату натрію необхідна тому що сильна кислота HCl, яка утворюється без його присутності, замінюється на слабку CH3COOH, в якій ZnS не розчиняється.
Заважають іони Co2+ та Ni2+ якщо рН розчину не дорівнює 2.
№ 57
Скласти молекулярні та іонні рівняння основних реакцій визначення катіонів K+, Al3+. Навести умови виконання цих реакцій. Звернути увагу на іони, що заважають визначенню
KCl + NaHC4H4O6 → KHC4H4O6↓ + NaCl
K+ + HC4H4O6‾ → KHC4H4O6↓
Умови : нейтральний або оцтовокислий розчин, велика концентрація іонів К+, холодний розчин. Іони амонію заважають виявленню іонів калію.
2KNO3 + Na3[Co(NO2)6] → K2Na[Co(NO2)6]↓ + 2NaNO3
2K+ + Na+ + [Co(NO2)6]3– → K2Na[Co(NO2)6]↓
Умови: нейтральний або оцтовокислий розчин. Іони амонію заважають визначенню іонів калію.
NaAlO2 + NH4Cl + 2H2O → Al(OH)3↓ + NaCl + NH4OH
AlO2‾ + NH4+ + 2HOH → Al(OH)3↓ + NH4OH
Умови: присутність твердого хлориду амонію. Іони Cr3+заважають визначенню іонів Al3+.
№ 58
Скласти молекулярні та іонні рівняння основних реакцій визначення катіонів Zn2+, Na+. Навести умови виконання цих реакцій. Звернути увагу на іони, що заважають визначенню
ZnSO4 + H2S + 2CH3COONa → ZnS↓ + 2CH3COOH + Na2SO4
Zn2+ + H2S + 2CH3COO‾ → ZnS↓ + 2CH3COOH
Осад ZnS розчинний в мінеральних кислотах. В даній реакції присутність ацетату натрію необхідна тому що сильна кислота HCl, яка утворюється без його присутності, замінюється на слабку CH3COOH, в якій ZnS не розчиняється.
Заважають іони Co2+та Ni2+ якщо рН розчину не дорівнює 2.
NaCl + K[Sb(OH)6] → Na[Sb(OH)6]↓ + KCl
Na+ + [Sb(OH)6]‾ → Na[Sb(OH)6]↓
Умови: нейтральне або слабколужне середовище, досить висока концентрація солі натрію, холодний розчин.
Солі амонію заважають даній реакції тому що гідролізують, результуючи іони водню. Реактив K[Sb(OH)6] у присутності солей амонію розкладається так само, як при дії кислот.
Na+ + Zn[(UO2)3(CH3COO)8] + CH3COO‾ + 9H2O →
→ NaZn[(UO2)3(CH3COO)9]∙9H2O↓
Умови: нейтральний або оцтовокислий розчин.
№ 59
Скласти молекулярні та іонні рівняння основних реакцій визначення катіонів Mg2+, Na+. Навести умови виконання цих реакцій. Звернути увагу на іони, що заважають визначенню
MgSO4 + 2NH4OH ↔ Mg(OH)2↓ + (NH4)2SO4
Mg2+ + 2NH4OH ↔ Mg(OH)2↓ + 2NH4+
Іони амонію заважають визначенню іонів магнію.
NaCl + K[Sb(OH)6] → Na[Sb(OH)6]↓ + KCl
Na+ + [Sb(OH)6]‾ → Na[Sb(OH)6]↓
Умови: нейтральне або слабколужне середовище, досить висока концентрація солі натрію, холодний розчин.
Солі амонію заважають даній реакції тому що гідролізують, результуючи іони водню. Реактив K[SB(OH)6] у присутності солей амонію розкладається так само, як при дії кислот.
Na+ + Zn[(UO2)3(CH3COO)8] + CH3COO‾ + 9H2O →
→ NaZn[(UO2)3(CH3COO)9]∙9H2O↓
Умови: нейтральний або оцтовокислий розчин.
№ 60
Скласти молекулярні та іонні рівняння основних реакцій визначення катіонів Ca2+, Mg2+. Навести умови виконання цих реакцій. Звернути увагу на іони, що заважають визначенню
CaSO4 + (NH4)2C2O4 → CaC2O4↓ + (NH4)2SO4
Ca2+ + C2O42– → CaC2O4↓
Виявленню іонів кальцію заважають іони барію та стронцію, які дають з оксалатом амонію аналогічні осади.
CaCl2 + K4[Fe(CN)6] → K2Ca[Fe(CN)6]↓ + 2KCl
2K+ + Ca2+ + [Fe(CN)6]4– → K2Ca[Fe(CN)6]↓
Іони барію в значних концентраціях можуть заважати визначенню іонів кальцію, так як утворюють аналогічні осади.
MgSO4 + 2NH4OH ↔ Mg(OH)2↓ + (NH4)2SO4
Mg2+ + 2NH4OH ↔ Mg(OH)2↓ + 2NH4+
Іони амонію заважають визначенню іонів магнію.
№ 61
Принцип аналітичної класифікації аніонів. До яких аналітичних груп належать аніони SO42–, PO43–, CO32–,Cl‾, Br‾, I‾, NO2‾, NO3‾ ?
Написати молекулярні та іонні рівняння реакцій дії групових реактивів, якщо в розчині присутні такі аніони: SO42– , I‾, NO2‾. Зазначити колір осадів, розчинність
Поділ аніонів на аналітичні групи оснований на різній розчинності солей барію і солей срібла: І група – аніони, солі барію яких важкорозчинні у воді; ІІ група – аніони, солі срібла яких важкорозчинні у воді і у розведеній азотній кислоті;ІІІ група – не утворюють важкорозчинних солей з іонами барію і срібла.
Аніони SO42–, PO43–, CO32– належать до І групи;
″Cl‾, Br‾, I‾ ″ до ІІ групи;
″NO2‾, NO3‾ ″ до ІІІ групи.
Рівняння реакцій:
1) Na2SO4 + BaCl2 ↔ BaSO4↓ + 2NaCl
SO42– + Ba2+ ↔ BaSO4↓
Білий кристалічний осад, практично нерозчинний у воді і кислотах.
2) KI + AgNO3 ↔ KNO3 + AgI↓
I‾ + Ag+ ↔ AgI↓
Осад жовтого кольору, розчинний в тіосульфаті натрію і ціаніді калію, але нерозчинний в гідроксиді амонію.
3) На аніон NO2‾ груповий реактив відсутній через належність вказаного аніона до ІІІ аналітичної групи.
№ 62
Принцип аналітичної класифікації аніонів. До яких аналітичних груп належать аніони SO42–, PO43–, CO32–,Cl‾, Br‾, I‾, NO2‾, NO3‾ ? Написати молекулярні та іонні рівняння реакцій дії групових реактивів, якщо в розчині присутні такі аніони: PO43–, Cl‾, NO3‾. Зазначити колір осадів, розчинністьПоділ аніонів на аналітичні групи оснований на різній розчинності солей барію і солей срібла: І група – аніони, солі барію яких важкорозчинні у воді; ІІ група – аніони, солі срібла яких важкорозчинні у воді і у розведеній азотній кислоті;
ІІІ група – не утворюють важкорозчинних солей з іонами барію і срібла.
Аніони SO42–, PO43–, CO32– належать до І групи;
″Cl‾, Br‾, I‾ ″ до ІІ групи;
″NO2‾, NO3‾ ″ до ІІІ групи.
Рівняння реакцій:
1) Серед фосфатів добре розчинними у воді є лише фосфати лужних металів та однозаміщені фосфати лужноземельних металів. Тому, з нейтральних розчинів хлорид барію осаджує білий гідрофосфат барію за рівнянням:
HPO42– + Ba2+ ↔ BaHPO4↓
З лужних розчинів осаджується білий фосфат барію:
2PO43– + 3Ba2+ ↔ Ba3(PO4)2↓
Обидва осади розчинні в оцтовій та мінеральних кислотах.
2) KCl + AgNO3 ↔ KNO3 + AgCl↓
Cl‾ + Ag+ ↔ AgCl↓
Білий сирнистий осад, нерозчинний в розведених кислотах, але добре розчинний в гідроксиді та карбонаті амонію. Подано лише перше рівняння реакції. Фактично вказаний осад оброблюють або 10%-ним розчином (NH4)2CO3 або 2 н. розчином NH4OH до отримання прозорого розчину, потім по краплях додають 2 н. розчин НNO3 до кислої реакції. В присутності іонів Cl‾ знову випадає осад AgCl.
3) На аніон NO3‾ груповий реактив відсутній через належність вказаного аніона до ІІІ аналітичної групи.
№ 63
Принцип аналітичної класифікації аніонів. До яких аналітичних груп належать аніони SO42–, PO43–, CO32–,Cl‾, Br‾, I‾, NO2‾, NO3‾ ? Написати молекулярні та іонні рівняння реакцій дії групових реактивів, якщо в розчині присутні такі аніони: CO32–, Br‾, SO42–. Зазначити колір осадів, розчинність Поділ аніонів на аналітичні групи оснований на різній розчинності солей барію і солей срібла: І група – аніони, солі барію яких важкорозчинні у воді; ІІ група – аніони, солі срібла яких важкорозчинні у воді і у розведеній азотній кислоті;ІІІ група – не утворюють важкорозчинних солей з іонами барію і срібла.
Аніони SO42–, PO43–, CO32– належать до І групи;
″Cl‾, Br‾, I‾ ″ до ІІ групи;
″NO2‾, NO3‾ ″ до ІІІ групи.
Рівняння реакцій:
1) Na2CO3 + BaCl2 ↔ BaCO3↓ + 2NaCl
CO32– + Ba2+ ↔ BaCO3↓
Об’ємистий білий осад, практично нерозчинний у воді, але розчинний в азотній кислоті.
2) KBr + AgNO3 ↔ KNO3 + AgBr↓
Br‾+ Ag+ ↔ AgBr↓
Жовтуватий сирнистий осад, нерозчинний в азотній кислоті, але розчинний в гідроксиді амонію, тіосульфаті натрію та ціаніді калію. Подано лише перше рівняння реакції. Фактично вказаний осад оброблюють 2 н. розчином NH4OH до отримання прозорого розчину, потім по краплях додають 2 н. розчин НNO3 до кислої реакції. В присутності іонів Br‾ знову випадає осад AgBr.
3)Na2SO4 + BaCl2 ↔ BaSO4↓ + 2NaCl
SO42– + Ba2+ ↔ BaSO4↓
Білий кристалічний осад, практично нерозчинний у воді і кислотах.
№ 64
Принцип аналітичної класифікації аніонів. До яких аналітичних груп належать аніони SO42–, PO43–, CO32–,Cl‾, Br‾, I‾, NO2‾, NO3‾ ? Написати молекулярні та іонні рівняння реакцій дії групових реактивів, якщо в розчині присутні такі аніони: Cl‾, PO43–, CO32–. Зазначити колір осадів, розчинність Поділ аніонів на аналітичні групи оснований на різній розчинності солей барію і солей срібла: І група – аніони, солі барію яких важкорозчинні у воді; ІІ група – аніони, солі срібла яких важкорозчинні у воді і у розведеній азотній кислоті;ІІІ група – не утворюють важкорозчинних солей з іонами барію і срібла.
Аніони SO42–, PO43–, CO32– належать до І групи;
″Cl‾, Br‾, I‾ ″ до ІІ групи;
″NO2‾, NO3‾ ″ до ІІІ групи.
Рівняння реакцій:
1) KCl + AgNO3 ↔ KNO3 + AgCl↓
Cl‾+ Ag+ ↔ AgCl↓
Білий сирнистий осад, нерозчинний в розведених кислотах, але добре розчинний в гідроксиді та карбонаті амонію. Подано лише перше рівняння реакції. Фактично вказаний осад оброблюють або 10%-ним розчином (NH4)2CO3 або 2 н. розчином NH4OH до отримання прозорого розчину, потім по краплях додають 2 н. розчин НNO3 до кислої реакції. В присутності іонів Cl‾ знову випадає осад AgCl.
2) Серед фосфатів добре розчинними у воді є лише фосфати лужних металів та однозаміщені фосфати лужноземельних металів. Тому з нейтральних розчинів осаджується білий гідрофосфат барію:
HPO42– + Ba2+ ↔ BaHPO4↓
З лужних розчинів осаджується білий фосфат барію:
2PO43– + 3Ba2+ ↔ Ba3(PO4)2↓
Обидва осади розчинні в оцтовій та мінеральних кислотах.
3) Na2CO3 + BaCl2 ↔ BaCO3↓ + 2NaCl
CO32– + Ba2+ ↔ BaCO3↓
Об’ємистий білий осад, практично нерозчинний у воді, але розчинний в азотній кислоті.
№ 65
Принцип аналітичної класифікації аніонів. До яких аналітичних груп належать аніони SO42–, PO43–, CO32–,Cl‾, Br‾, I‾, NO2‾, NO3‾ ? Написати молекулярні та іонні рівняння реакцій дії групових реактивів, якщо в розчині присутні такі аніони: I‾, SO42–, NO3‾. Зазначити колір осадів, розчинність
Поділ аніонів на аналітичні групи оснований на різній розчинності солей барію і солей срібла: І група – аніони, солі барію яких важкорозчинні у воді; ІІ група – аніони, солі срібла яких важкорозчинні у воді і у розведеній азотній кислоті;ІІІ група – не утворюють важкорозчинних солей з іонами барію і срібла.
Аніони SO42–, PO43–, CO32– належать до І групи;
″Cl‾, Br‾, I‾ ″ до ІІ групи;
″NO2‾, NO3‾ ″ до ІІІ групи.
Рівняння реакцій:
1) KI + AgNO3 ↔ KNO3 + AgI↓
I‾ + Ag+ ↔ AgI↓
Осад жовтого кольору, розчинний в тіосульфаті натрію і ціаніді калію, проте нерозчинний в гідроксиді амонію.
2) Na2SO4 + BaCl2 ↔ BaSO4↓ + 2NaCl
SO42– + Ba2+ ↔ BaSO4↓
Білий кристалічний осад, практично нерозчинний у воді і кислотах.
3) На аніон NO3‾ груповий реактив відсутній через належність даного аніона до ІІІ аналітичної групи.
№ 66
Принцип аналітичної класифікації аніонів. До яких аналітичних груп належать аніони SO42–, PO43–, CO32–,Cl‾, Br‾, I‾, NO2‾, NO3‾ ? Написати молекулярні та іонні рівняння реакцій дії групових реактивів, якщо в розчині присутні такі аніони: NO3‾, Br‾, PO43–. Зазначити колір осадів, розчинність Поділ аніонів на аналітичні групи оснований на різній розчинності солей барію і солей срібла: І група – аніони, солі барію яких важкорозчинні у воді; ІІ група – аніони, солі срібла яких важкорозчинні у воді і у розведеній азотній кислоті;ІІІ група – не утворюють важкорозчинних солей з іонами барію і срібла.
Аніони SO42–, PO43–, CO32– належать до І групи;
″Cl‾, Br‾, I‾ ″ до ІІ групи;
″NO2‾, NO3‾ ″ до ІІІ групи.
Рівняння реакцій:
1) На аніон NO3‾ груповий реактив відсутній через належність даного аніона до ІІІ аналітичної групи.
2) KBr + AgNO3 ↔ KNO3 + AgBr↓
Br‾ + Ag+ ↔ AgBr↓
Жовтуватий сирнистий осад, нерозчинний в азотній кислоті, але розчинний в гідроксиді амонію, тіосульфаті натрію та ціаніді калію. Подано лише перше рівняння реакції. Фактично вказаний осад оброблюють 2 н. розчином NH4OH до отримання прозорого розчину, потім по краплях додають 2 н. розчин НNO3 до кислої реакції. В присутності іонів Br‾ знову випадає осад AgBr.
3) Серед фосфатів добре розчинними у воді є лише фосфати лужних металів та однозаміщені фосфати лужноземельних металів. Тому, з нейтральних розчинів осаджується білий гідрофосфат барію:
HPO42– + Ba2+ ↔ BaHPO4↓
З лужних розчинів осаджується білий фосфат барію:
2PO43– + 3Ba2+ ↔ Ba3(PO4)2↓
Обидва осади розчинні в оцтовій і мінеральних кислотах.
№ 67
Принцип аналітичної класифікації аніонів. До яких аналітичних груп належать аніони SO42–, PO43–, CO32–,Cl‾, Br‾, I‾, NO2‾, NO3‾ ? Написати молекулярні та іонні рівняння реакцій дії групових реактивів, якщо в розчині присутні такі аніони: PO43–, Cl‾, CO32–.Зазначити колір осадів, розчинність
Поділ аніонів на аналітичні групи оснований на різній розчинності солей барію і солей срібла: І група – аніони, солі барію яких важкорозчинні у воді; ІІ група – аніони, солі срібла яких важкорозчинні у воді і у розведеній азотній кислоті;
ІІІ група – не утворюють важкорозчинних солей з іонами барію і срібла.
Аніони SO42–, PO43–, CO32– належать до І групи;
″Cl‾, Br‾, I‾ ″ до ІІ групи;
″NO2‾, NO3‾ ″ до ІІІ групи.
Рівняння реакцій:
1) Серед фосфатів добре розчинними у воді є лише фосфати лужних металів та однозаміщені фосфати лужноземельних металів. Тому, з нейтральних розчинів осаджується білий гідрофосфат барію:
HPO42– + Ba2+ ↔ BaHPO4↓
З лужних розчинів осаджується білий фосфат барію:
2PO43– + 3Ba2+ ↔ Ba3(PO4)2↓
Обидва осади розчинні в оцтовій та мінеральних кислотах.
2) KCl + AgNO3 ↔ KNO3 + AgCl↓
Cl‾ + Ag+ ↔ AgCl↓
Білий сирнистий осад, нерозчинний в розведених кислотах, але добре розчинний в гідроксиді та карбонаті амонію. Подано лише перше рівняння реакції. Фактично вказаний осад оброблюють або 10%-ним розчином (NH4)2CO3 або 2 н. розчином NH4OH до отримання прозорого розчину, потім по краплях додають 2 н. розчин НNO3 до кислої реакції. В присутності іонів Cl‾ знову випадає осад AgCl.
3) Na2CO3 + BaCl2 ↔ BaCO3↓ + 2NaCl
CO32– + Ba2+ ↔ BaCO3↓
Об’ємистий білий осад, практично нерозчинний у воді, проте розчинний в азотній кислоті.
№ 68
Принцип аналітичної класифікації аніонів. До яких аналітичних груп належать аніони SO42–, PO43–, CO32–,Cl‾, Br‾, I‾, NO2‾, NO3‾ ? Написати молекулярні та іонні рівняння реакцій дії групових реактивів, якщо в розчині присутні такі аніони: I‾, CO32–, NO3‾.Зазначити колір осадів, розчинність
Поділ аніонів на аналітичні групи оснований на різній розчинності солей барію і солей срібла: І група – аніони, солі барію яких важкорозчинні у воді; ІІ група – аніони, солі срібла яких важкорозчинні у воді і у розведеній азотній кислоті;
ІІІ група – не утворюють важкорозчинних солей з іонами барію і срібла.
Аніони SO42–, PO43–, CO32– належать до І групи;
″Cl‾, Br‾, I‾ ″ до ІІ групи;
″NO2‾, NO3‾ ″ до ІІІ групи.
Рівняння реакцій:
1) KI + AgNO3 ↔ KNO3 + AgI↓
I‾ + Ag+ ↔ AgI↓
Осад жовтого кольору, розчинний в тіосульфаті натрію і ціаніді калію, проте нерозчинний в гідроксиді амонію.
2) Na2CO3 + BaCl2 ↔ BaCO3↓ + 2NaCl
CO32– + Ba2+ ↔ BaCO3↓
Об’ємистий білий осад, практично нерозчинний у воді, проте розчинний в азотній кислоті.
3) На аніон NO3‾ груповий реактив відсутній через належність даного аніона до ІІІ аналітичної групи.
№ 69
Принцип аналітичної класифікації аніонів. До яких аналітичних груп належать аніони SO42–, PO43–, CO32–,Cl‾, Br‾, I‾, NO2‾, NO3‾ ? Написати молекулярні та іонні рівняння реакцій дії групових реактивів, якщо в розчині присутні такі аніони: NO2‾, I‾, SO42–.Зазначити колір осадів, розчинність
Поділ аніонів на аналітичні групи оснований на різній розчинності солей барію і солей срібла: І група – аніони, солі барію яких важкорозчинні у воді; ІІ група – аніони, солі срібла яких важкорозчинні у воді і у розведеній азотній кислоті;
ІІІ група – не утворюють важкорозчинних солей з іонами барію і срібла.
Аніони SO42–, PO43–, CO32 належать до І групи;
″Cl‾, Br‾, I‾ ″ до ІІ групи;
″NO2‾, NO3‾ ″ до ІІІ групи.
Рівняння реакцій:
1) На аніон NO2‾ груповий реактив відсутній через належність даного аніона до ІІІ аналітичної групи.
2) KI + AgNO3 ↔ KNO3 + AgI↓
I‾ + Ag+ ↔ AgI↓
Осад жовтого кольору, розчинний в тіосульфаті натрію і ціаніді калію, проте нерозчинний в гідроксиді амонію.
3) Na2SO4 + BaCl2 ↔ BaSO4↓ + 2NaCl
SO42– + Ba2+ ↔ BaSO4↓
Білий кристалічний осад, практично нерозчинний у воді і кислотах.
№ 70
Принцип аналітичної класифікації аніонів. До яких аналітичних груп належать аніони SO42–, PO43–, CO32–,Cl‾, Br‾, I‾, NO2‾, NO3‾ ? Написати молекулярні та іонні рівняння реакцій дії групових реактивів, якщо в розчині присутні такі аніони: SO42– , PO43– , Cl‾.
Зазначити колір осадів, розчинність
Поділ аніонів на аналітичні групи оснований на різній розчинності солей барію і солей срібла: І група – аніони, солі барію яких важкорозчинні у воді; ІІ група – аніони, солі срібла яких важкорозчинні у воді і у розведеній азотній кислоті;ІІІ група – не утворюють важкорозчинних солей з іонами барію і срібла.
Аніони SO42–, PO43–, CO32– належать до І групи;
″Cl‾, Br‾, I‾ ″ до ІІ групи;
″NO2‾, NO3‾ ″ до ІІІ групи.
Рівняння реакцій:
1) Na2SO4 + BaCl2 ↔ BaSO4↓ + 2NaCl
SO42– + Ba2+ ↔ BaSO4↓
Білий кристалічний осад, практично нерозчинний у воді і в кислотах.
2) Серед фосфатів добре розчинними у воді є лише фосфати лужних металів та однозаміщені фосфати лужноземельних металів. Тому, з нейтральних розчинів хлорид барію осаджує білий гідрофосфат барію за рівнянням:
HPO42– + Ba2+ ↔ BaHPO4↓
З лужних розчинів осаджується білий фосфат барію:
2PO43– + 3Ba2+ ↔ Ba3(PO4)2↓
Обидва осади розчинні в оцтовій та мінеральних кислотах.
3) KCl + AgNO3 ↔ KNO3 + AgCl↓
Cl‾ + Ag+ ↔ AgCl↓
Білий сирнистий осад, нерозчинний в розведених кислотах, але добре розчинний в гідроксиді та карбонаті амонію. Подано лише перше рівняння реакції. Фактично вказаний осад оброблюють або 10%-ним розчином (NH4)2CO3 або 2 н. розчином NH4OH до отримання прозорого розчину, потім по краплях додають 2 н. розчин НNO3 до кислої реакції. В присутності іонів Cl‾ знову випадає осад AgCl.
№ 71-72
Пояснити, чому відсутній груповий реактив на аніони третьої аналітичної групи
До ІІІ аналітичної групи належать аніони NO2‾ , NO3‾, ClO3‾ , ClО4‾ , CH3COO‾. Всі солі барію і срібла вказаних аніонів добре розчинні у воді, тому груповими реактивами – хлоридом барію і нітратом срібла вони не осаджуються.
№ 73-74-75
Дати мотивовану відповідь, чи можна замість BaCl2 використовувати для осадження аніонів першої аналітичної групи інші солі барію. Скласти відповідні рівняння реакцій
Крім BaCl2 можна використовувати ВаBr2, ВаI2 та Ва(NO3)2. Всі три названі солі добре розчинні у воді і дадуть з аніонами I-ї аналітичної групи аналогічні осади:
Na2SO4 + ВаBr2 ↔ ВаSO4↓ + 2NaBr
Na2SO4 + ВаI2 ↔ ВаSO4↓ + 2NaІ
Na2SO4 + Ва(NO3)2 ↔ ВаSO4↓ + 2NaNO3
№ 76-77-78
Чому осадження аніонів другої аналітичної групи за допомогою групового реактиву проводять в присутності НNO3? Відповідь обґрунтувати рівняннями реакцій
До ІІ-ї аналітичної групи належать аніони, які утворюють з катіонами срібла солі, важкорозчинні у воді і у розведеній азотній кислоті. Фактично реакцію на аніони ІІ-ї аналітичної групи проводять таким чином: до 2-3 крапель досліджуваного розчину додають 2-3 краплі 0,1 н розчину AgNO3; осад відділяють і оброблюють 2-3 краплями 2 н розчину NH4OH і/або 10%-го розчину (NH4)2CO3. На цьому етапі роблять висновок, який саме аніон присутній в досліджуваному розчині: хлорид срібла добре розчинний і в NH4OH і в (NH4)2CO3. Бромід срібла малорозчинний в NH4OH і нерозчинний в (NH4)2CO3. Йодиди і сульфіди срібла нерозчинні ні в розчині аміаку, ні в карбонаті амонію. Отримавши там, де це можливо, прозорий розчин, до нього додають по краплях розчин НNO3 до кислої реакції (проба на лакмус). В присутності іонів Cl‾ і Br‾ знову випадають аналогічні осади AgCl та AgBr.Рівняння реакцій подаю на прикладі виявлення аніона Cl‾ :
1) NaCl + AgNO3 ↔ NaNO3 + AgCl↓
Ag+ + Cl‾ ↔ AgCl↓
2) AgCl + 2NH4OH → [Ag(NH3)2]+ + Cl‾ + 2H2O
3) [Ag(NH3)2]Cl + 2HNO3 → AgCl↓ + 2NH4NO3
[Ag(NH3)2]+ + Cl‾ + 2H+ → AgCl↓ + 2NH4+
№ 79-80
Пояснити, як можна відокремити аніони ІІІ аналітичної групи від аніонів І та ІІ аналітичних груп. Скласти відповідні рівняння реакцій
Припускаємо, що в розчині є суміш аніонів І, ІІ, та ІІІ аналітичних груп.
Як відомо, на аніони ІІІ аналітичної групи не існує групового реактиву. Через це, краще спершу дробними реакціями видалити з розчину аніони ІІІ аналітичної групи, потім вже груповими реактивами виявляти аніони І та ІІ аналітичних груп.
Спочатку видалимо нітрит-іон в присутності нітрат-іона за допомогою NH4Cl:
NO2‾ + NH4+ → N2↑ + 2H2O
Потім видалимо нітрат-іон:
2NO3‾ + 3Cu + 8H+ → 3Cu2+ + 2NO↑ + 4H2O
2NO + O2(повітря) → 2NO2↑(бурий газ)
Після видалення з розчину вищезазначених аніонів практичної потреби у видаленні інших аніонів ІІІ аналітичної групи не виникає, тому, після вказаної процедури можна вважати, що в розчині залишилась суміш аніонів І та ІІ аналітичних груп.
№ 81
Скласти молекулярні та іонні рівняння основних реакцій визначення аніонів PO43–, I– , SO42–. Навести умови їх виконання та зовнішній ефект, який супроводжує перебіг даних реакцій.Характерна реакція на фосфат-іон:
Na2HPO4+12(NH4)2MoO4+23HNO3↔(NH4)3[P(Mo3O10)4]↓+2NaNO3+21NH4NO3+12H2O
Умови: азотнокисле середовище, присутність нітрату амонію. Зовнішній ефект – жовтий осад фосфорнододекамолібдату амонію. Реакція йде швидше при нагріванні.
Характерні реакції на йодид-іон:
2NaI + Cl2 → I2 + 2NaCl
2I‾ + Cl2 → I2 + 2Cl‾
Вільний йод, що виділяється, можна виявити за допомогою крохмалю (синє забарвлення) або бензолу (червоно-фіолетове забарвлення).
2KI + 2HNO2 + H2SO4 → I2 + 2NO↑ + K2SO4 + 2H2O
2I‾ + 2NO2‾ + 4H+ → I2 + 2NO↑ + 2H2O
Умови: кисле середовище. Зовнішній ефект – синє забарвлення розчину в присутності йодид-іонів.
Характерна реакція на сульфат-іон:
Na2SO4 + BaCl2 ↔ BaSO4↓ + 2NaCl
SO42– + Ba2+ ↔ BaSO4↓
Умови: додавання кількох крапель 2 н розчину HNO3 перед вливанням розчину хлориду барію. Зовнішній ефект: білий кристалічний осад сульфату барію.
№ 82
Скласти молекулярні та іонні рівняння основних реакцій визначення аніонів PO43–, Cl‾ , NO3‾ .
Навести умови їх виконання та зовнішній ефект, який супроводжує перебіг даних реакцій
Характерна реакція на фосфат-іон:
Na2HPO4+12(NH4)2MoO4+23HNO3↔(NH4)3[P(Mo3O10)4]↓+2NaNO3+21NH4NO3+12H2O
Умови: азотнокисле середовище, присутність нітрату амонію. Зовнішній ефект – жовтий осад фосфорнододекамолібдату амонію. Реакція йде швидше при нагріванні.
Визначення хлорид-іону за допомогою групового реактиву:
KCl + AgNO3 ↔ AgCl↓ + KNO3
Cl‾ + Ag+ ↔ AgCl↓
Умови: азотнокисле середовище. Зовнішній ефект – білий сирнистий осад хлориду срібла.
Характерна реакція на хлорид-іон:
NaCl + H2SO4(конц.) ↔ NaHSO4 + HCl↑
Умова: нагрівання. Зовнішній ефект – специфічний запах хлороводню.
Характерна реакція на нітрат-іон:
2KNO3 + 3Cu + 4H2SO4 → 3CuSO4 + 2NO↑ + K2SO4 + 4H2O
2NO3‾ + 3Cu + 8H+ → 3Cu2+ + 2NO↑ + 4H2O
2NO + O2(повітря) → 2NO2↑
Умови: сірчанокисле середовище. Зовнішній ефект – бурий газ NO2.
№ 83
Скласти молекулярні та іонні рівняння основних реакцій визначення аніонів SO42–, NO2‾, PO43–. Навести умови їх виконання та зовнішній ефект, який супроводжує перебіг даних реакцій
Характерна реакція на сульфат-іон:
Na2SO4 + BaCl2 ↔ BaSO4↓ + 2NaCl
SO42– + Ba2+ ↔ BaSO4↓
Умови: додавання кількох крапель 2 н розчину HNO3 перед вливанням розчину хлориду барію. Зовнішній ефект: білий кристалічний осад сульфату барію.
Характерні реакції на нітрит-іон:
NaNO2 + H2SO4 → NaHSO4 + HNO2
3HNO2 →HNO3 + 2NO↑ + H2O
2NO + O2(повітря) → 2NO2↑
Реакцію вести на холоді. Зовнішній ефект – бурий газ NO2.
2KMnO4 + 5NaNO2 + 3H2SO4 → 2MnSO4 + 5NaNO3 + K2SO4 + 3H2O
5NO2‾ + 2MnO4‾ + 6H+ → 2Mn2+ + 5NO3‾ + 3H2O
Умови: сірчанокисле середовище. Зовнішній ефект: рожеве забарвлення розчину.
Характерна реакція на фосфат іон:
Na2HPO4+12(NH4)2MoO4+23HNO3↔(NH4)3[P(Mo3O10)4]↓+2NaNO3+21NH4NO3+12H2O
Умови: азотнокисле середовище, присутність нітрату амонію. Зовнішній ефект – жовтий осад фосфорнододекамолібдату амонію. Реакція йде швидше при нагріванні.
№ 84
Скласти молекулярні та іонні рівняння основних реакцій визначення аніонів Cl‾ , PO43–, NO2‾. Навести умови їх виконання та зовнішній ефект, який супроводжує перебіг даних реакційВизначення хлорид-іону за допомогою групового реактиву:
KCl + AgNO3 ↔ AgCl↓ + KNO3
Cl‾ + Ag+ ↔ AgCl↓
Умови: азотнокисле середовище. Зовнішній ефект – білий сирнистий осад хлориду срібла.
Характерна реакція на хлорид-іон:
NaCl + H2SO4(конц.) ↔ NaHSO4 + HCl↑
Умова: нагрівання. Зовнішній ефект – специфічний запах хлороводню.
Характерна реакція на фосфат-іон:
Na2HPO4+12(NH4)2MoO4+23HNO3↔(NH4)3[P(Mo3O10)4]↓+2NaNO3+21NH4NO3+12H2O
Умови: азотнокисле середовище, присутність нітрату амонію. Зовнішній ефект – жовтий осад фосфорнододекамолібдату амонію. Реакція йде швидше при нагріванні.
Характерні реакції на нітрит-іон:
NaNO2 + H2SO4 → NaHSO4 + HNO2
3HNO2 → HNO3 + 2NO↑ + H2O
2NO + O2(повітря) → 2NO2↑
Реакцію вести на холоді. Зовнішній ефект – бурий газ NO2.
2KMnO4 + 5NaNO2 + 3H2SO4 → 2MnSO4 + 5NaNO3 + K2SO4 + 3H2O
5NO2‾ + 2MnO4‾ + 6H+ → 2Mn2+ + 5NO3‾ + 3H2O
Умови: сірчанокисле середовище. Зовнішній ефект: рожеве забарвлення розчину.
№ 85
Скласти молекулярні та іонні рівняння основних реакцій визначення аніонів I–, SO42–, NO3‾ Навести умови їх виконання та зовнішній ефект, який супроводжує перебіг даних реакцій
Характерні реакції на йодид-іон:
2NaI + Cl2 → I2 + 2NaCl
2I‾ + Cl2 → I2 + 2Cl‾
Вільний йод, що виділяється, можна виявити за допомогою крохмалю (синє забарвлення) або бензолу (червоно-фіолетове забарвлення).
2KI + 2HNO2 + H2SO4 → I2 + 2NO↑ + K2SO4 + 2H2O
2I‾ + 2NO2‾ + 4H+ → I2 + 2NO↑ + 2H2O
Умови: кисле середовище. Зовнішній ефект – синє забарвлення розчину в присутності йодид-іонів.
Характерна реакція на сульфат-іон:
Na2SO4 + BaCl2 ↔ BaSO4↓ + 2NaCl
SO42– + Ba2+ ↔ BaSO4↓
Умови: додавання кількох крапель 2н розчину HNO3 перед вливанням розчину хлориду барію. Зовнішній ефект: білий кристалічний осад сульфату барію.
Характерна реакція на нітрат-іон:
2KNO3 + 3Cu + 4H2SO4 → 3CuSO4 + 2NO↑ + K2SO4 + 4H2O
2NO3‾ + 3Cu + 8H+ → 3Cu2+ + 2NO↑ + 4H2O
2NO + O2(повітря) → 2NO2↑
Умови: сірчанокисле середовище. Зовнішній ефект – бурий газ NO2.
№ 86
Скласти молекулярні та іонні рівняння основних реакцій визначення аніонів NO3‾ , NO2‾ , PO43–. Навести умови їх виконання та зовнішній ефект, який супроводжує перебіг даних реакцій
Характерна реакція на нітрат-іон:
2KNO3 + 3Cu + 4H2SO4 → 3CuSO4 + 2NO↑ + K2SO4 + 4H2O
2NO3‾ + 3Cu + 8H+ → 3Cu2+ + 2NO↑ + 4H2O
2NO + O2(повітря) → 2NO2↑
Умови: сірчанокисле середовище. Зовнішній ефект – бурий газ NO2.
Характерні реакції на нітрит-іон:
NaNO2 + H2SO4 → NaHSO4 + HNO2
3HNO2 → HNO3 + 2NO↑ + H2O
2NO + O2(повітря) → 2NO2↑
Реакцію вести на холоді. Зовнішній ефект – бурий газ NO2.
2KMnO4 + 5NaNO2 + 3H2SO4 → 2MnSO4 + 5NaNO3 + K2SO4 + 3H2O
5NO2‾ + 2MnO4‾ + 6H+ → 2Mn2+ + 5NO3‾ + 3H2O
Умови: сірчанокисле середовище. Зовнішній ефект: рожеве забарвлення розчину.
Характерна реакція на фосфат-іон:
Na2HPO4+12(NH4)2MoO4+23HNO3↔(NH4)3[P(Mo3O10)4]↓+2NaNO3+21NH4NO3+12H2O
Умови: азотнокисле середовище, присутність нітрату амонію. Зовнішній ефект – жовтий осад фосфорнододекамолібдату амонію. Реакція йде швидше при нагріванні.
№ 87
Скласти молекулярні та іонні рівняння основних реакцій визначення аніонів PO43–, Cl‾ , CO32–. Навести умови їх виконання та зовнішній ефект, який супроводжує перебіг даних реакцій
Характерна реакція на фосфат-іон:
Na2HPO4+12(NH4)2MoO4+23HNO3↔(NH4)3[P(Mo3O10)4]↓+2NaNO3+21NH4NO3+12H2O
Умови: азотнокисле середовище, присутність нітрату амонію. Зовнішній ефект – жовтий осад фосфорнододекамолібдату амонію. Реакція йде швидше при нагріванні.
Визначення хлорид-іону за допомогою групового реактиву:
KCl + AgNO3 ↔ AgCl↓ + KNO3
Cl‾ + Ag+ ↔ AgCl↓
Умови: азотнокисле середовище. Зовнішній ефект – білий сирнистий осад хлориду срібла.
Характерна реакція на хлорид-іон:
NaCl + H2SO4(конц.) ↔ NaHSO4 + HCl↑
Умова: нагрівання. Зовнішній ефект – специфічний запах хлороводню.
Характерна реакція на карбонат-іон:
Na2CO3 + 2HCl → 2NaCl + H2CO3
↕
CO2↑ + H2O
CO2 + Ba(OH2) ↔ BaCO3↓ + H2O
Зовнішній ефект – помутніння баритової води (випадає білий осад карбонату барію).
№ 88
Скласти молекулярні та іонні рівняння основних реакцій визначення аніонів I–, CO32–, NO3‾. Навести умови їх виконання та зовнішній ефект, який супроводжує перебіг даних реакцій
Характерні реакції на йодид-іон:
2NaI + Cl2 → I2 + 2NaCl
2I‾ + Cl2 → I2 + 2Cl‾
Вільний йод, що виділяється, можна виявити за допомогою бензолу (червоно-фіолетове забарвлення) або крохмалю (синє забарвлення).
2KI+ 2HNO2 + H2SO4 → I2 + 2NO↑ + K2SO4 + 2H2O
2I‾ + 2NO2‾ + 4H+ → I2 + 2NO↑ + 2H2O
Умови: кисле середовище. Зовнішній ефект – синє забарвлення розчину в присутності йодид-іонів.
Характерна реакція на карбонат-іон:
CaCO3 + 2HCl → CaCl2 + H2CO3
↕
CO2↑ + H2O
CO2 + Ba(OH)2 ↔ BaCO3↓ + H2O
Зовнішній ефект – помутніння баритової води (випадає білий осад карбонату барію).
Характерна реакція на нітрат-іон:
2KNO3 + 3Cu + 4H2SO4 → 3CuSO4 + 2NO↑ + K2SO4 + 4H2O
2NO3‾ + 3Cu + 8H+ → 3Cu2+ + 2NO↑ + 4H2O
2NO + O2(повітря) → 2NO2↑
Умови: сірчанокисле середовище. Зовнішній ефект – бурий газ NO2.
№ 89
Скласти молекулярні та іонні рівняння основних реакцій визначення аніонів NO3‾ , I–, SO42–. Навести умови їх виконання та зовнішній ефект, який супроводжує перебіг даних реакцій
Характерна реакція на нітрат-іон:
2KNO3 + 3Cu + 4H2SO4 → 3CuSO4 + 2NO↑ + K2SO4 + 4H2O
2NO3‾ + 3Cu + 8H+ → 3Cu2+ + 2NO↑ + 4H2O
2NO + O2(повітря) → 2NO2↑
Умови: сірчанокисле середовище. Зовнішній ефект – бурий газ NO2.
Характерні реакції на йодид-іон:
2NaI + Cl2 → I2 + 2NaCl
2I‾ + Cl2 → I2 + 2Cl‾
Вільний йод, що виділяється, можна виявити за допомогою крохмалю (синє забарвлення) або органічного розчинника (червоно-фіолетове забарвлення).
2KI + 2HNO2 + H2SO4 → I2 + 2NO↑ + K2SO4 + 2H2O
2I‾ + 2NO2‾ + 4H+ → I2 + 2NO↑ + 2H2O
Умови: кисле середовище. Зовнішній ефект – синє забарвлення розчину в присутності йодид-іонів.
Характерна реакція на сульфат-іон:
Na2SO4 + BaCl2 ↔ BaSO4↓+ 2NaCl
SO42– + Ba2+ ↔ BaSO4↓
Умови: додавання кількох крапель 2н розчину HNO3 перед вливанням розчину хлориду барію. Зовнішній ефект: білий кристалічний осад сульфату барію.
№ 90
Скласти молекулярні та іонні рівняння основних реакцій визначення аніонів NO2‾ , PO43–, Cl‾. Навести умови їх виконання та зовнішній ефект, який супроводжує перебіг даних реакційХарактерні реакції на нітрит-іон:
NaNO2 + H2SO4 → NaHSO4 + HNO2
3HNO2 → HNO3 + 2NO↑ + H2O
2NO + O2(повітря) → 2NO2↑
Реакцію вести на холоді. Зовнішній ефект – бурий газ NO2.
2KMnO4 + 5NaNO2 + 3H2SO4 → 2MnSO4 + 5NaNO3 + K2SO4 + 3H2O
5NO2‾ + 2MnO4‾ + 6H+ → 2Mn2+ + 5NO3‾ + 3H2O
Умови: сірчанокисле середовище. Зовнішній ефект: рожеве забарвлення розчину.
Характерна реакція на фосфат-іон:
Na2HPO4+12(NH4)2MoO4+23HNO3↔(NH4)3[P(Mo3O10)4]↓+2NaNO3+21NH4NO3+12H2O
Умови: азотнокисле середовище, присутність нітрату амонію. Зовнішній ефект – жовтий осад фосфорнододекамолібдату амонію. Реакція йде швидше при нагріванні.
Визначення хлорид-іону за допомогою групового реактиву:
KCl + AgNO3 ↔ AgCl↓ + KNO3
Cl‾ + Ag+ ↔ AgCl↓
Умови: азотнокисле середовище. Зовнішній ефект – білий сирнистий осад хлориду срібла.
Характерна реакція на хлорид-іон:
NaCl + H2SO4(конц.) ↔ NaHSO4 + HCl↑
Умови: концентрована сірчана кислота, нагрівання. Зовнішній ефект – специфічний запах хлороводню.
№ 91-92
Який аніон відкривають за допомогою магнезіальної суміші? Написати рівняння реакції. При визначенні якого катіону утворюється такий самий осад? Який ще реагент використовують для відкриття цього аніону?
Це аніон PO43– :
HPO42– + Mg2+ + NH4OH ↔ MgNH4PO4↓ + H2O
Такий самий білий кристалічний осад отримаємо при визначенні катіона Mg2+.
Ще для відкриття фосфат-іона використовують молібденову рідину:
Na2HPO4+12(NH4)2MoO4+23HNO3↔(NH4)3[P(Mo3O10)4]↓+2NaNO3+21NH4NO3+12H2O
№ 93-94
Для відкриття якого з аніонів застосовують молібденову рідину? Написати рівняння реакції. Навести 5 об’єктів сільськогосподарського призначення, які містять цей аніон
Це аніон PO43– :
Na2HPO4+12(NH4)2MoO4+23HNO3↔(NH4)3[P(Mo3O10)4]↓+2NaNO3+21NH4NO3+12H2O
Похожие работы
... Прийняття політичних рішень потребує від суб'єкта політики переконаності у доцільності втілення визначеної політики. Вона має бути заснована на правильно зрозумілих законах суспільного розвитку, усвідомленні необхідності втілення їх у політичних рішеннях. Та все ж при прийнятті таких рішень присутній і політичний ризик. Розвинені суспільство і держава при певному рівні політичної культури здатні ...
... процесів управління ІС наведена в додатку А та Б у вигляді діаграм IDF0, DFD програмного продукту BP-WIN. 1.3 Огляд літературних джерел з проблеми автоматизації рішення задачі «Ведення карткових рахунків фізичних осіб» Введення електронних систем обробки й передачі інформації набувають універсальний і загальний характер, охоплюючи всі напрямки банківської діяльності. Сучасні інформаційні ...
... ів: вихідні дані, реферат, вступ, аналітична частина, висновки, рекомендації, додатки, список використаних джерел, список скорочень, допоміжні покажчики, зміст [18, с. 323]. Особливу роль відіграють оглядово-аналітичні документи в ухваленні виважених управлінських рішень. Прогнозний огляд містить аналіз інформації, яка відображає характер змін стану досліджуваного об’єкта (його структури, ...
... чного аналізу наводяться у табл. 2.1. Таблиця 2.1. Визначення методу економічного аналізу Калина А.В., Конева М.И. Современный экономический анализ и прогнозирование. – К.: МАУП, 1998 Під методом економічного аналізу розуміють діалектичний спосіб підходу до вивчення господарських процесів в їх становленні та розвитку (с. 31) Маргулис А.Ш. Экономический анализ работы предприятий. – М.: ...

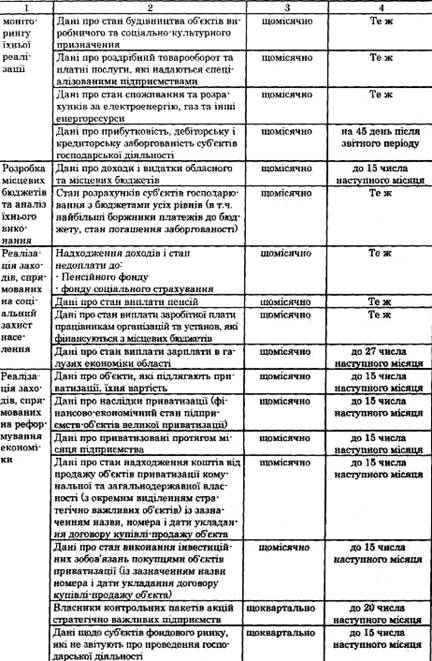
0 комментариев