Навигация
Розчини вихідних речовин мають бути стійкими і концентрація таких розчинів не повинна змінюватись під впливом зовнішніх умов
2. Розчини вихідних речовин мають бути стійкими і концентрація таких розчинів не повинна змінюватись під впливом зовнішніх умов.
№ 108
Навести визначення та дати пояснення щодо основних понять і термінів титрометричного аналізу: титрування, точка еквівалентності
Титрування – це поступове доливання робочого розчину до розчину визначуваної речовини до досягнення точки еквівалентності.
Точка еквівалентності – момент, коли кількості двох реагуючих між собою речовин стануть еквівалентними.
№ 109
Навести визначення та дати пояснення щодо основних понять і термінів титрометричного аналізу: індикатори, помилки титрування
Як відомо, у титрометричному аналізі до розчину одного компонента додають розчин другого компонента до досягнення точки еквівалентності. Для визначення кінця титрування використовують індикатори. Практично неможливо підібрати індикатор, який показував би кінець титрування в точці еквівалентності. Через це визначають так звану кінцеву точку титрування, тобто кінець титрування, визначений індикатором. Чим більше кінцева точка титрування і точка еквівалентності відрізняються між собою, тим більша помилка титрування.
Індикатори є слабкими органічними кислотами або основами, молекулярна форма яких має інше забарвлення, ніж іонна. Індикатори бувають одноколірні і двоколірні. Одноколірні індикатори безбарвні в молекулярній формі і забарвлені в іонній формі. Двоколірні – забарвлені в різні кольори як в молекулярній, так і в іонній формах.
Залежно від константи дисоціації КНIn індикатори поділяють на сильні, проміжні та слабкі.
Сильні індикатори характеризуються величиною КНIn> 10–7 і змінюють забарвлення в кислому середовищі при рН < 7. Типовий представник – метилоранж, забарвлення якого змінюється в межах 3,4 < pH < 4,3.
Проміжні індикатори змінюють забарвлення при рН ≈ 7. Типовим представником є лакмус, що змінює забарвлення при 6,8 < рН < 7,2.
Слабкі індикатори змінюють забарвлення в слабколужному середовищі. Типовий представник – фенолфталеїн, який безбарвний при рН < 8 і червоний при рН > 8.
Основними причинами помилок титрування є відхилення показника титрування рТ індикатора від рН точки еквівалентності і не досить різка зміна кольору індикатора біля точки еквівалентності.
Наприклад, при титруванні сильної основи сильною кислотою помилка титрування суть відношення об’єму витраченої на титрування кислоти до об’єму взятого розчину лугу.
При титруванні слабкої кислоти лугом помилка титрування є відношення концентрацій розчинів невідтитрованої і відтитрованої кислоти. Крім цього, в даному випадку помилку титрування можна виразити так:
![]() , де Kкисл – константа дисоціації кислоти.
, де Kкисл – константа дисоціації кислоти.
При титруванні солей слабких кислот
![]() , де Ссолі і Скисл
, де Ссолі і Скисл
відповідно нормальні концентрації солі і кислоти.
№ 110
Навести визначення та дати пояснення щодо основних понять і термінів титрометричного аналізу: мірний посуд, який застосовують у титрометричному аналізі та правила користування ним
В титрометричному аналізі для точного вимірювання об’ємів рідини застосовують мірні колби, піпетки і бюретки.
Мірні колби застосовують для приготування розчинів і для відмірювання певного об’єму рідини. Колбу перед використанням добре миють. Розчини готують, висипаючи наважку реактиву в колбу, доливають розчинник приблизно до ½ її об’єму, дають реактиву розчинитись, потім доливають цей же розчинник до мітки. Певний об’єм рідини відмірюють аналогічно, заповнюючи колбу до мітки. Доводять об’єм рідини до мітки в обох випадках так, щоб нижній край меніску був на рівні мітки колби. Очі спостерігача теж мають бути на рівні мітки.
Піпетки використовують для відбору певного об’єму рідини. Звичайна піпетка – це скляна трубка з розширенням посередині. Нижній кінець витягнуто в капіляр. На верхньому кінці є мітка, до якої слід набирати рідину, яку відмірюють. Перед використанням піпетку добре миють хромовою сумішшю, споліскують спочатку дистильованою водою, потім розчином, яким будуть її наповнювати.
Бюретки застосовують для відмірювання точних об’ємів рідини. Бюретка являє собою вузьку циліндричну трубку. Є бюретки, оснащені затискачем, а є оснащені внизу краном.
Нульова мітка шкали розміщена вгорі трубки. Бюретки градуюють вниз від нульової мітки на десяті долі мілілітра. Перед використанням бюретку добре миють хромовою сумішшю, споліскують 2-3 рази дистильованою водою, потім розчином, яким будуть її наповнювати. В роботі бюретку закріплюють на штативі у вертикальному положенні і заповнюють потрібним розчином трохи вище нульової мітки. Потрібно слідкувати, щоб в капілярі крана, в гумовій трубці і в наконечнику не було повітря.
Відкривають кран або відпускають затискач. Об’єм рідини, що витекла з бюретки, відраховують по меніску, що рухатиметься вниз по шкалі. Темні і світлі рідини бажано відмірювати по різним краям меніска, проте в будь-якому разі відмірювання слід проводити по якомусь одному (верхньому або нижньому) краю. Очі спостерігача мають бути на рівні меніска. Відмірявши певний об’єм, закривають кран або затискач.
№ 111-112-113
Розкрити суть титрометричних визначень методом нейтралізації
Основною реакцією методу є реакція нейтралізації – взаємодія кислоти і основи: Н+ + ОН‾ → Н2О
Стандартними розчинами в розглядуваному методі є розчини кислот і основ. Фактично це титрування розчину кислоти розчином лугу або навпаки до досягнення точки еквівалентності – моменту, коли кількості добавленого і взятого компонентів стануть еквівалентними. Точку еквівалентності найзручніше визначати за кольоровими індикаторами. Нормальності розчинів встановлюють за законом еквівалентів. Кількість речовини визначають за рівняннями реакцій та за розрахунковими формулами.
Головним чином метод нейтралізації застосовують для кількісного визначення кислот і основ. Даним методом можна визначати, наприклад, жорсткість води, концентрацію солей амонію та солей слабких кислот.
№ 114-115-116
Розкрити суть перманганатометрії
Перманганатометрія – один з методів об’ємного аналізу (підгрупа методів окислення-відновлення), в якому речовину визначають титруванням розчином перманганату калію.
У кислому середовищі основна реакція методу йде за рівнянням:
MnO4‾ + 8H+ + 5e‾ → Mn2+ + 4H2O
У слабокислих або лужних розчинах перманганат відновлюється до Mn4+, який випадає у вигляді нерозчинного осаду двоокису марганцю:
MnO4‾ + 4H+ + 3e‾ → MnO2↓ + 2H2O
Метод застосовують для визначення багатьох відновників, серед них Fe2+, Sn2+, Mn2+, V4+, U4+.
При титруванні розчином перманганату калію звичайно не застосовують ніяких спеціальних індикаторів. Точку еквівалентності встановлюють за рожевим забарвленням, яке виникає від невеликого надлишку добавленого розчину KMnO4. Отже, індикатором є сам робочий розчин. Оскільки препарат KMnO4 не має властивостей вихідної речовини через значну кількість домішок двоокису марганцю, нормальність розчину перманганату калію встановлюють за щавлевою кислотою.
№ 117-118
Розкрити суть йодометрії
Йодометрія – один з методів об’ємного аналізу, в основі якого лежить вимірювання кількості йоду, що витрачається на окислення відновників або виділяється при взаємодії окисників з розчином йодиду калію.
Основна реакція методу йде за рівнянням:
I2 + 2е– ↔ 2I‾
Особливість даного методу – можливість досить точно встановити точку еквівалентності, що пов’язано з використанням чутливого специфічного індикатора – розчину крохмалю (вже 0,00001 н. розчини йоду утворюють з крохмалем помітно синє забарвлення).
№ 119-120
Розкрити суть комплексонометрії
Комплексонометрія – один з методів об’ємного аналізу, в якому речовину визначають титруванням трилоном Б (динатрієва сіль етилендиамінтетраоцтової кислоти). Характерними особливостями методу, можна сказати, його перевагами є те, що трилон Б реагує з катіонами дуже багатьох металів, в тім числі лужно-земельних, що дозволяє застосовувати даний метод для визначення постійної твердості води. Крім того, 1 г-іон комплексону завжди реагує з 1 г-іоном металу у випадку всіх дво- і тривалентних металів. Під час реакції не утворюється ніяких побічних продуктів, присутність яких ускладнює визначення.
№ 121
Дати загальну характеристику методу нейтралізації
Основною реакцією методу є реакція нейтралізації – взаємодія кислоти і основи: Н+ + ОН‾ → Н2О
Стандартними розчинами в розглядуваному методі є розчини кислот і основ. Фактично це титрування розчину кислоти розчином лугу або навпаки до досягнення точки еквівалентності – моменту, коли кількості добавленого і взятого компонентів стануть еквівалентними. Точку еквівалентності найзручніше визначати за кольоровими індикаторами. Нормальності розчинів встановлюють за законом еквівалентів. Кількість речовини визначають за рівняннями реакцій та за розрахунковими формулами.
Головним чином метод нейтралізації застосовують для кількісного визначення кислот і основ. Даним методом можна визначати, наприклад, жорсткість води, концентрацію солей амонію та солей слабких кислот.
№ 122
Навести приклади робочих розчинів методу нейтралізації. Які вихідні речовини застосовують для встановлення нормальності робочих розчинів?
Робочими розчинами методу нейтралізації є розчини кислот і основ. Переважно застосовуються розчини соляної, сірчаної та азотної кислот, розчини гідроксиду натрію і гідроксиду калію.
Методи встановлення нормальності робочих розчинів приведу для HCl і NaOH: нормальність розчину соляної кислоти встановлюють за бурою, а нормальність розчину гідроксиду натрію встановлюють за щавелевою кислотою.
№ 123
Дати обґрунтовану відповідь, чи можна приготувати титрований робочий розчин гідроксиду натрію, виходячи з точної наважки речовини NaOH
Не можна. Тому що, по-перше, луги дуже важко дістати в чистому вигляді. При їх виготовленні (а особливо при зберіганні) завжди утворюється певна кількість соди в результаті поглинання CO2 з повітря. По-друге, луги містять воду та інші домішки.
У нашому випадку препарат NaOH надзвичайно гігроскопічний. Вже під час зважування на аналітичних терезах їдкий натр настільки сильно поглинає воду, що це робить сам процес зважування практично неможливим, не говорячи вже про приготування титрованого розчину.
№ 124
Дати обґрунтовану відповідь, чи можна приготувати титрований робочий розчин соляної кислоти, виходячи з точного об’єму розчину HCl відомої концентрації
Не можна. Тому що, по-перше, точна концентрація кислот звичайно невідома. По-друге, концентрована соляна кислота дуже легко втрачає хлороводень у вигляді газу (випаровується), а це означає, що її концентрація змінюється.
№ 125
Описати основні етапи визначення концентрації робочих розчинів у методі нейтралізації. Скласти рівняння реакцій, які відбуваються при визначенні концентрації НCl
Для встановлення нормальності розчинів сильних кислот найчастіше використовують буру, а для встановлення нормальності розчину лугу – щавлеву кислоту. Основні етапи визначення концентрації робочих розчинів наступні.
1. Перекристалізація бури і щавлевої кислоти. При зберіганні ці препарати втрачають певну кількість води, тому їх треба перекристалізовувати навіть тоді, коли за чистотою вони цілком придатні для роботи.
2. Приготування робочого розчину сильної кислоти або лугу. Звичайно готують 1 л 0,1 н розчину, нормальність якого відома приблизно.
3. Приготування розчину вихідної речовини. Це розчин бури у випадку встановлення нормальності розчину сильної кислоти і розчин щавлевої кислоти у випадку встановлення нормальності розчину лугу.
4. Проведення реакції титрування. У нашому випадку при визначенні концентрації розчину НCl йде реакція:
Na2В4O7 + 2НCl + 5H2O → 4Н3ВО3 + 2NaCl
5. Визначення нормальності розчину кислоти за формулою:
![]()
№ 126
Описати основні етапи визначення концентрації робочих розчинів у методі нейтралізації. Скласти рівняння реакцій, які відбуваються при визначенні концентрації NaOH
Для встановлення нормальності розчинів сильних кислот найчастіше використовують буру, а для встановлення нормальності розчину лугу – щавлеву кислоту. Основні етапи визначення концентрації робочих розчинів наступні.
1. Перекристалізація бури і щавлевої кислоти. При зберіганні ці препарати втрачають певну кількість води, тому їх треба перекристалізовувати навіть тоді, коли за чистотою вони цілком придатні для роботи.
2. Приготування робочого розчину сильної кислоти або лугу. Звичайно готують 1 л 0,1 н розчину, нормальність якого відома приблизно.
3. Приготування розчину вихідної речовини. Це розчин бури у випадку встановлення нормальності розчину сильної кислоти і розчин щавелевої кислоти у випадку встановлення нормальності розчину лугу.
4. Проведення реакції титрування. У нашому випадку при визначенні концентрації розчину NaOH йде реакція:
H2С2O4 + 2NaOH → Na2С2O4 + 2H2O
Проте, цей метод встановлення нормальності розчину лугу можна застосовувати лише у випадках коли в останньому немає карбонатів. Якщо в розчині лугу присутні карбонати, то іони С2O42– осаджують хлоридом кальцію. Соляну кислоту, яка при цьому звільняється, титрують лугом у присутності метилоранжу:
Na2С2O4 + СаCl2 ↔ СаС2O4↓ + 2NaCl
H2С2O4 + СаCl2 ↔ СаС2O4↓ + 2НCl
НCl + NaOH → NaCl + H2O
2НCl + Na2CO3 → 2NaCl + CO2↑ + H2O
Проводять 3–4 титрування і за середнім значенням обчислюють нормальність розчину лугу. Крім того, для встановлення нормальності розчину лугу можна використати титрований розчин НCl. Тоді нормальність лугу обчислюють за формулою:
![]()
Однак, точність в даному випадку буде нижча.
№ 127
Розрахувати нормальність, молярність, титр розчину HCl, якщо на титрування 25 мл 0,0936 н розчину бури витрачено 21,4 мл розчину HCl
Реакція йде за рівнянням:
2HCl + Na2B4O7 + 5H2O → 4H3BO3 + 2NaCl
Зі співвідношення закону еквівалентів
Vбури∙Nбури = VHCl∙NHCl
знайдемо нормальність соляної кислоти:
![]()
В даному випадку моль-еквівалент соляної кислоти рівний 1 молю, отже, молярність HCl становить
СМ = 0,1093 М.
Титр знайдемо із співвідношення
![]()
№ 128
Зазначити основні індикатори методу нейтралізації. Пояснити, що таке інтервал переходу та показник титрування індикатора
Основні індикатори методу показник нейтралізації: титрування (рТ)метиловий фіолетовий (І перехід) 1
тимоловий синій (І перехід) 2
метиловий фіолетовий (ІІ перехід) 2,5
метилоранж 4
бромфенол синій 4
метиловий червоний 5
лакмус 7
нейтральний червоний 7
феноловий червоний 8
тимоловий синій (ІІ перехід) 9
фенолфталеїн 9
тимолфталеїн 10
Інтервал рН, в межах якого відбувається помітна для людського ока зміна забарвлення індикатора, називають інтервалом переходу індикатора.
У межах інтервалу переходу індикатора є значення рН, при якому спостерігається найбільш помітна для людського ока зміна кольору індикатора. Це значення рН називають показником титрування індикатора (позначають рТ).
№ 129
Дати мотивовану відповідь, для чого застосовують індикатори та як їх вибирають
Індикатори в титрометричному аналізі і в його підрозділі – методі нейтралізації використовують для встановлення точки еквівалентності за різкою зміною кольору індикатора, яка повинна спостерігатись поблизу точки еквівалентності і в самій цій точці. Однак, таким методом встановити точку еквівалентності можна лише з певною точністю, так як, по-перше, показник титрування рТ вибраного індикатора і рН розчину в точці еквівалентності можуть суттєво відрізнятись; по-друге, не всякий індикатор різко змінює колір у вказаній точці.
Умовою правильного вибору індикатора, а значить, і умовою найбільш точного визначення точки еквівалентності, є те, щоб різниця значень рТ індикатора і рН розчину в точці еквівалентності була якнайменшою. При цьому показник титрування індикатора знаходять з довідників, а рН розчину в точці еквівалентності обчислюють за рівнянням реакції.
№ 130
За допомогою кривих титрування дати обґрунтовану відповідь, де точність титрування буде найвищою:
а) при титруванні сильної кислоти лугом;
б) при титруванні слабкої кислоти лугом?
Чи можна титрувати слабку кислоту слабкою основою?
а) поглянемо на криву титрування сильної кислоти лугом
(0,1 н розчин HCl 0,1 н розчином NaOH):
![]() рН 14
рН 14
![]() 7
7
![]()
![]() 0
0
0 40 80 120 160 200
об’єм NaOH, мл
З малюнка видно, що при титруванні сильної кислоти лугом біля точки еквівалентності спостерігається різка зміна рН розчину. Помилка титрування в даному випадку становить 0,1%.
б) тепер поглянемо на криву титрування слабкої кислоти лугом
(0,1 н розчину оцтової кислоти 0,1 н розчином NaOH):
![]()
![]()
 рН 14
рН 14
![]() 7
7
![]() 0
0
0 40 80 120 160 200 об’єм NaOH, мл
Характер кривої показує, що при титруванні слабкої кислоти лугом немає різкої зміни рН біля точки еквівалентності. У цьому випадку помилка титрування може сягати 10%.
Таким чином, точність титрування буде найвищою у випадку титрування сильної кислоти сильною основою.
Титрувати слабку кислоту слабкою основою практично неможливо тому що при зміні рН на ± 1 кислота буде недотитрована приблизно на 10%, потім приблизно на стільки ж буде перетитрована.
№ 131
Дати загальну характеристику методу перманганатометрії
Перманганатометрія – один з методів об’ємного аналізу (підгрупа методів окислення-відновлення), в якому речовину визначають титруванням розчином перманганату калію.
У кислому середовищі основна реакція методу йде за рівнянням:
MnO4‾ + 8H+ + 5e‾ → Mn2+ + 4H2O.
У слабокислих або лужних розчинах перманганат відновлюється до Mn4+, який випадає у вигляді нерозчинного осаду двоокису марганцю:
MnO4‾ + 4H+ + 3e‾ → MnO2↓ + 2H2O
Метод застосовують для визначення багатьох відновників, серед них
Fe2+, Sn2+, Mn2+, V4+, U4+.
При титруванні розчином перманганату калію звичайно не застосовують ніяких спеціальних індикаторів. Точку еквівалентності встановлюють за рожевим забарвленням, яке виникає від невеликого надлишку добавленого розчину перманганату. Отже, індикатором є сам робочий розчин.
Оскільки препарат KMnO4 не має властивостей вихідної речовини через значну кількість домішок двоокису марганцю, нормальність розчину перманганату калію встановлюють за щавлевою кислотою.
№ 132
Титровані розчини методу перманганатометрії. У чому полягає різниця приготування робочого титрованого розчину КMnO4 та стандартного розчину щавлевої кислоти?
Робочим розчином методу перманганатометрії є розчин перманганату калію. Після встановлення нормальності цього розчину за щавлевою кислотою він має назву титрований робочий розчин. Різниця приготування титрованого робочого розчину КMnO4 та стандартного розчину щавлевої кислоти полягає в тому, що, по-перше, препарат перманганату калію, на відміну від препарату щавлевої кислоти, не містить кристалізаційної води (яку останній з часом втрачає), отже його не треба перекристалізовувати перед розчиненням; по-друге, приготувавши стандартний розчин щавлевої кислоти, ми будемо знати його нормальність з достатньою точністю, тоді як нормальність приготовленого робочого розчину КMnO4 відома лише приблизно і встановити її буде необхідно за тим же розчином щавлевої кислоти.
№ 133
Дати мотивовану відповідь, чи можна приготувати титрований розчин KMnO4, виходячи з точної наважки, без встановлення його концентрації за вихідною речовиною
НЕ МОЖНА. Тому, що KMnO4 не має властивостей вихідної речовини. Препарат завжди має більшу або меншу кількість домішок двоокису марганцю, позбутися яких важко. Крім того, концентрація розчину KMnO4 з часом змінюється внаслідок відновлення під впливом світла, невеликих кількостей органічних речовин, які потрапляють у розчин з пилом, тощо.
Точну концентрацію розчину KMnO4 можна встановити за щавелевою кислотою.
№ 134
Розрахувати наважку КMnO4, необхідну для приготування 1,0 л 0,05 н розчину. Зазначити основні етапи приготування розчину КMnO4 Зрівняння реакції MnO4‾ + 8Н+ + 5е– → Mn2+ + 4H2Oбачимо, що еквівалент КMnO4 рівний ![]() його молярної маси. Отже, для того, щоб приготувати 1 л 0,05 н розчину, треба відважити на технічних терезах
його молярної маси. Отже, для того, щоб приготувати 1 л 0,05 н розчину, треба відважити на технічних терезах
![]() препарату КMnO4.
препарату КMnO4.
Наважку переносять у вимірювальну колбу і заливають приблизно на ½ дистильованою водою, старанно перемішують до повного розчинення кристалів. Слідкують, щоб кристали КMnO4 розчинились повністю, оскільки процес дуже повільний. Потім доводять об’єм розчину до 1 л. Не раніше, як через 10–12 діб нормальність отриманого розчину встановлюють за щавлевою кислотою.
№ 135
Скласти рівняння реакції, яка відбувається при встановленні нормальності робочого розчину КMnO4 за вихідною речовиною. Зазначити хід та умови цього визначення
Рівняння реакції:
2КMnO4 + 5H2С2O4 + 3H2SO4 → К2SO4 + 2MnSO4 + 10CO2↑ + 8H2O
2 MnO4‾ + 8H+ + 5е– → Mn2+ + 4H2O
5 ![]() C2O42– → 2е– + 2CO2↑
C2O42– → 2е– + 2CO2↑
2MnO4‾ + 5C2O42– + 16H+ → 2Mn2+ + 10CO2↑ + 8H2O
Хід визначення: піпеткою відбирають 20 або 25 мл 0,1 н розчину щавлевої кислоти і переносять у конічну колбу ємністю 200 мл. Добавляють 15–20 мл розчину сірчаної кислоти (1:4) і нагрівають до температури 80–90°С. При цьому стежать, щоб стінки колби вище рівня рідини не перегрівались, оскільки це може призвести до термічного розкладу щавлевої кислоти:
t°
H2С2O4 → CO2↑ + CO↑ + H2O
До гарячого розчину щавлевої кислоти з бюретки добавляють кілька крапель розчину перманганату калію і чекають, доки зникне рожеве забарвлення. Потім додають наступні порції розчину перманганату, щоразу чекаючи зникнення рожевого забарвлення. Після додавання 2–3 мл розчину перманганату титрування йде швидше і робочий розчин можна добавляти більшими порціями. Ознакою кінця титрування є забарвлення розчину в рожевий колір, який не зникає тривалий час. Визначення треба повторити з новими порціями розчину щавлевої кислоти ще 2–3 рази, при цьому розходження в об’ємах між окремими паралельними пробами не має перевищувати 0,02–0,03 мл. Відлічувати об’єм розчину перманганату, витраченого на титрування, зручно за верхнім меніском на бюретці. Нормальність розчину перманганату обчислюють за формулою:

№ 136
Як прискорити реакцію, що є основою визначення концентрації розчину KMnO4? Що є каталізатором?
Реакція між KMnO4 і щавлевою кислотою безпосередньо не йде або йде дуже повільно. Навпаки, швидкість реакції між KMnO4 і іонами марганцю(ІІ), в результаті якої утворюється двоокис марганцю, досить велика. Найшвидше взаємодіють MnO2 та H2C2O4.
Досліди показують, що каталізатором в даній реакції є іони марганцю(ІІ). Збільшення їх концентрації значно прискорює реакцію.
№ 137
Чому не потрібен індикатор при перманганатометричних визначеннях? Як встановлюють точку еквівалентності при титруванні розчином перманганату калію?
Тому що в даному випадку індикатором є сам робочий розчин KMnO4. Точку еквівалентності встановлюють за рожевим забарвленням, яке виникає від невеликого надлишку добавленого розчину KMnO4. Помилку титрування при такому способі визначення точки еквівалентності легко встановити за допомогою сліпої проби.
№ 138
Чому титрування перманганатом калію проводять у кислому середовищі? Чи можна використати нейтральне чи лужне середовище? Відповідь обґрунтуйте рівняннями реакцій.У кислому середовищі реакція йде за рівнянням:
MnO4‾ + 8Н+ + 5е– → Mn2+ + 4H2O
При меншій концентрації водневих іонів у слабокислих, нейтральних і слабколужних розчинах перманганат відновлюється до Mn4+, який виділяється у вигляді нерозчинного осаду двоокису марганцю:
MnO4‾ + 4Н+ + 3е– → MnO2↓ + 2H2O
Осад двоокису марганцю утруднює спостереження точки еквівалентності, роблячи визначення не досить точним.В лужному середовищі перманганат калію відновлюється до манганату К2MnO4, який в розчині самовільно розпадається на перманганат калію і той же нерозчинний осад двоокису марганцю. Титрування в слабокислих, нейтральних та лужних середовищах проводять лише з метою визначення марганцю (ІІ) та в деяких інших випадках.
№ 139
Розрахувати нормальність, молярність, титр розчину KMnO4, якщо на титрування 20 мл 0,0497 н розчину H2C2O4 витрачено 18,6 мл розчину KMnO4
З закону еквівалентів знайдемо:
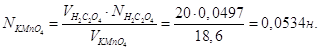
Дана реакція йде за рівнянням: MnO4‾ + 8H+ + 5e‾ = Mn2+ + 4H2O
Очевидно, що моль-еквівалент KMnO4 в даному випадку рівний ![]() його молярної маси. Отже, шукана молярність буде
його молярної маси. Отже, шукана молярність буде ![]()
Титр обчислимо із співвідношення:
![]()
№ 140
Розрахувати нормальність, молярність, титр розчину щавлевої кислоти, одержаної розчиненням 1,7334 г кислоти в мірній колбі ємністю 250 мл. Скільки мл цього розчину піде на титрування 25,00 мл 0,0912 н розчину КMnO4?
Молекулярна формула кристалогідрату щавлевої кислоти H2С2O4∙2H2O. Молярна маса її становить МH2C2O4∙2H2O = 2+12∙2+16∙4+2(2+16) = 126 г/моль. Щавлева кислота є двоосновною, тому моль-еквівалент її рівний ½ моль, а еквівалентна маса становитьКількість моль-еквівалентів щавлевої кислоти, що містяться в 1000 мл розчину:
![]() моль-екв.
моль-екв.
Отже, нормальність отриманого розчину NH2C2O4∙2H2O = 0,11н.
Кількість молей щавелевої кислоти, що містяться в 1000 мл розчину:
![]()
Тому, молярність розчину СМ = 0,055 М.
Титр розчину щавлевої кислоти знайдемо із співвідношення:
![]()
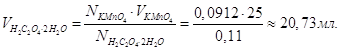
№ 141-142
За допомогою якого методу кількісного аналізу можна визначити вміст у складі зразка мінерального добрива, рослини, води, грунтів або інших об’єктів:заліза (ІІ)
Дати загальну характеристику методу, який для цього застосовується. Описати основні етапи виконання даного аналізу.
Залізо (ІІ) визначають методом перманганатометрії. Загальна характеристика: титрування робочим розчином перманганату калію, тобто розчином, нормальність якого була попередньо встановлена за щавелевою кислотою.
Метод застосовується головним чином для визначення заліза в рудах, силікатах і шлаках з великим вмістом заліза. Для переведення заліза в розчин ці матеріали безпосередньо оброблюють кислотами, а ті, що не розчиняються в кислотах, спочатку сплавляють з карбонатом натрію або іншими речовинами. Після такої обробки звичайно утворюється хлорид заліза(ІІІ). Тому перед титруванням розчином перманганату калію залізо (ІІІ) відновлюють до заліза (ІІ). Для відновлення застосовують гази, розчини відновників або тверді речовини. Відновлені іони заліза титрують робочим розчином перманганату калію. Після цього вміст заліза (ІІ) визначають за відповідною розрахунковою формулою.
№ 143
За допомогою якого методу кількісного аналізу можна визначити вміст у складі зразка мінерального добрива, рослини, води, грунтів або інших об’єктів: міді (ІІ)
Дати загальну характеристику методу, який для цього застосовується. Описати основні етапи виконання даного аналізу.
Мідь (ІІ) визначають йодометрією. В основу йодометричного визначення міді (ІІ) покладено окислювальну дію іонів міді (ІІ) відносно іонів йоду.
При взаємодії солей міді з йодидом калію мідь (ІІ) відновлюється до міді (І) з утворенням нерозчинного йодиду міді і виділенням вільного йоду, який потім титрують розчином тіосульфату натрію:
2CuSO4 + 4KI → 2CuI↓ + 2K2SO4 + I2
I2 + 2Na2S2O3 → Na2S4O6 + 2NaI
Після титрування вміст міді розраховують за відповідною формулою. Варто зазначити, що йодометричне визначення міді дуже точне.
№ 144
За допомогою якого методу кількісного аналізу можна визначити вміст у складі зразка мінерального добрива, рослини, води, грунтів або інших об’єктів: нітритів
Дати загальну характеристику методу, який для цього застосовується. Описати основні етапи виконання даного аналізу.
Цей метод – перманганатометрія. Загальна характеристика: титрування робочим розчином перманганату калію, тобто розчином, нормальність якого була попередньо встановлена за щавлевою кислотою.В основі кількісного визначення нітритів є реакція окислення останніх перманганатом калію у присутності сірчаної кислоти. Сірчана кислота, будучи сильною, витісняє слабшу азотисту кислоту, яка, будучи дуже нестійкою, розкладається на оксиди азоту. Побічні реакції виділення азотистої кислоти та її розкладання на оксиди азоту є причиною того, що пряме титрування розчинів нітритів в сірчанокислому середовищі не дає правильних результатів. Тому застосовується інша техніка.
До відміряної кількості робочого розчину перманганату калію добавляють розведену сірчану кислоту, суміш нагрівають і доливають до неї нейтральний розчин нітриту з таким розрахунком, щоб після повного окислення в розчині був ще певний надлишок KMnO4. За вказаних умов оксиди азоту не виділяються в повітря, бо в розчині весь час є великий надлишок KMnO4, який повністю окислює азотисту кислоту. Таким чином, реакція йде за рівнянням:
2KMnO4 + 5NaNO2 + 3H2SO4 → 2MnSO4 + 5NaNO3 + K2SO4 + 3H2O.
Після вищезазначених процесів вміст нітритів обчислюють за відповідною формулою.
№ 145-146
За допомогою якого методу кількісного аналізу можна визначити вміст у складі зразка мінерального добрива, рослини, води грунтів або інших об’єктів: солей кальцію і магнію (тимчасової твердості води)
Дати загальну характеристику методу, який для цього застосовується. Описати основні етапи виконання даного аналізу
Тимчасова твердість води зумовлена вмістом у воді бікарбонатів кальцію і магнію. Виявити, рівно як і позбутися її, можна процедурою кип’ятіння. При цьому йде реакція:
Ca(HCO3)2 → CaCO3↓ + CO2↑ + H2O
Після цього вміст бікарбонатів обчислюють за відповідною формулою.
№ 147
За допомогою якого методу кількісного аналізу можна визначити вміст у складі зразка мінерального добрива, рослини, води, грунтів або інших об’єктів: солей кальцію і магнію (постійної твердості води)
Дати загальну характеристику методу, який для цього застосовується. Описати основні етапи виконання даного аналізу. Постійну твердість води визначають комплексонометрією. В основі комплексонометричного визначення постійної твердості води лежить титрування відміряного об’єму води 0,1 н розчином трилону Б в присутності індикатора хромогену чорного спеціального (ЕТ-00). Для визначення беруть таку кількість води, щоб загальний вміст солей кальцію і магнію, по можливості, не перевищував 0,5 мг-екв. Так як 1 мл 0,1 н розчину трилону Б відповідає 0,1 мг-екв, на титрування має витрачатись не більше 5 мл 0,1 н розчину трилону.
Пробу води розводять дистильованою водою приблизно до 100 мл, доливають 5 мл буферного розчину (суміш NH4Cl і NH4OH), після чого добавляють краплинами індикатор до утворення помітного винно-червоного забарвлення. Потім титрують розчином трилону Б до переходу забарвлення в синє із зеленуватим відтінком. І нарешті, обчислюють вміст солей кальцію і магнію (мг-екв) за формулою:
![]()
де Nтр – нормальність розчину трилону; Vтр – об’єм розчину трилону, витраченого на титрування води; Vводи – об’єм взятої для аналізу води.
№ 148
За допомогою якого методу кількісного аналізу можна визначити вміст у складі зразка мінерального добрива, рослини, води, грунтів або інших об’єктів: фосфору
Дати загальну характеристику методу, який для цього застосовується. Описати основні етапи виконання даного аналізу
Фосфор визначають двома ваговими методами. Один з них – цитратний. Суть методу в тому, що фосфор осаджують у вигляді магній-амоній фосфату. Прожарюючи осад, дістають пірофосфат магнію, за масою якого знаходять вміст фосфору. Метод дістав свою назву від того, що іони металів утримують в розчині за допомогою цитратної кислоти.
Інший метод – молібдатний. Суть методу в тому, що фосфор осаджують у вигляді фосфорно-молібденовокислого амонію (NH4)3[P(Mo3O10)4]. Цей осад фільтрують крізь скляний фільтр, висушують і зважують.
Вміст фосфорного ангідриду обчислюють за відповідними розрахунковими формулами.
№ 149
За допомогою якого методу кількісного аналізу можна визначити вміст у складі зразка мінерального добрива, рослини, води, грунтів або інших об’єктів: оцтової кислоти. Дати загальну характеристику методу, який для цього застосовується. Описати основні етапи виконання даного аналізу
Оцтову кислоту визначають методом нейтралізації. Фактично відбувається титрування слабкої оцтової кислоти сильною основою NaOH. При цьому йде реакція:
CH3COOH + NaOH ↔ CH3COONa + H2O
Для визначення концентрації оцтової кислоти зважують бюкс з притертою кришкою, в який наливають 5–10 мл води. Потім у бюкс наливають 1–1,5 мл оцтової кислоти, закривають кришкою, знову зважують, розчин переносять у колбу об’ємом 250 мл, доводять до риски і перемішують. У конічній колбі на 150–200 мл піпеткою беруть по 25 мл титрованого розчину NaOH, добавляють по 1–2 краплинах фенолфталеїн і титрують приготовленим розчином оцтової кислоти. Нарешті, вміст оцтової кислоти розраховують за відповідною формулою.
№ 150
За допомогою якого методу кількісного аналізу можна визначити вміст у складі зразка мінерального добрива, рослини, води, грунтів або інших об’єктів: гідроксиду натрію. Дати загальну характеристику методу, який для цього застосовується. Описати основні етапи виконання даного аналізу
Застосовуваний метод має назву метод нейтралізації. Загальна характеристика: кислотно-основне титрування до досягнення точки еквівалентності, тобто моменту, коли кількості двох реагуючих речовин стануть еквівалентними.
Для визначення гідроксиду натрію у закритому бюксі зважують 0,8–1,2 г препарату, наважку переносять у вимірювальну колбу на 250 мл, розчиняють у воді, з якої видалено вуглекислоту, об’єм доводять до риски і добре перемішують. Беруть кілька проб по 250 мл, добавляють 1–2 краплі фенолфталеїну і титрують робочим розчином HCl (нормальність якого була попередньо встановлена за бурою) до знебарвлення розчину. Після цього вміст NaOH обчислюють за відповідною розрахунковою формулою.
Література
1) І.В. П’ятницький “Аналітична хімія”, Київ, Вища школа, 1969;
2) И. Шапиро, В. Шапиро “Аналитическая химия”, М.,Наука, 1978
Похожие работы
... Прийняття політичних рішень потребує від суб'єкта політики переконаності у доцільності втілення визначеної політики. Вона має бути заснована на правильно зрозумілих законах суспільного розвитку, усвідомленні необхідності втілення їх у політичних рішеннях. Та все ж при прийнятті таких рішень присутній і політичний ризик. Розвинені суспільство і держава при певному рівні політичної культури здатні ...
... процесів управління ІС наведена в додатку А та Б у вигляді діаграм IDF0, DFD програмного продукту BP-WIN. 1.3 Огляд літературних джерел з проблеми автоматизації рішення задачі «Ведення карткових рахунків фізичних осіб» Введення електронних систем обробки й передачі інформації набувають універсальний і загальний характер, охоплюючи всі напрямки банківської діяльності. Сучасні інформаційні ...
... ів: вихідні дані, реферат, вступ, аналітична частина, висновки, рекомендації, додатки, список використаних джерел, список скорочень, допоміжні покажчики, зміст [18, с. 323]. Особливу роль відіграють оглядово-аналітичні документи в ухваленні виважених управлінських рішень. Прогнозний огляд містить аналіз інформації, яка відображає характер змін стану досліджуваного об’єкта (його структури, ...
... чного аналізу наводяться у табл. 2.1. Таблиця 2.1. Визначення методу економічного аналізу Калина А.В., Конева М.И. Современный экономический анализ и прогнозирование. – К.: МАУП, 1998 Під методом економічного аналізу розуміють діалектичний спосіб підходу до вивчення господарських процесів в їх становленні та розвитку (с. 31) Маргулис А.Ш. Экономический анализ работы предприятий. – М.: ...

0 комментариев